
- •1 Оқу жұмыс бағдарламасы
- •Оқытушы туралы мәлеметтер және байланыстық ақпарат
- •1.2 Пәннің еңбек сыймдылығы
- •1.3 Пәннің сипаттамасы
- •1.4 Пәннің мақсаты
- •1.5 Пәннің міндеттері:
- •1.6 Айрықша деректемелер
- •1.7 Тұрақты деректемелер
- •Негізгі әдебиеттер тізімі
- •1.10. Қосымша әдебиеттер
- •1.11 Студенттердің білімдерін бағалау критерилері
- •1.12 Саясат және рәсімдер
- •6Оқытушымен студенттің өздік жұмысының тақырыптық жоспары
- •7 Қорытынды аттестация және бақылау кезінде студенттердің білімін тексеруге арналған материалдар
- •7.1 Пән бойынша жазба жұмыстар тақырыбы
- •7.2 Өздік тексеруге арналған( Тест)сұрақтары
- •7.3 Емтихан билеттері ( тестер)
1.12 Саясат және рәсімдер
«Физикалық және коллоидты химия» пәнін оқу кезінде келесі ережелерді сақтауды өтінеміз:
1 Сабаққа кешікпей келуді.
2 Дәлелді себепсіз сабақ босатпауды, ауырған жағдайда анықтама , ал басқа жағдайларда түсініктеме хат ұсынуды.
3 Студенттердің міндетіне барлық сабақтарға қатысу кіреді.
4 Оқу процесінің күнтізбелік жоспарына сәйкес бақылаудың барлық түрлерін тапсыру
5 Жіберілген практикалық және зертханалық сабақтар оқытушщы белгілеген уақытта қайта тапсыру.
6 Оқу процесіне белсене қатысу
1.13 Оқу-әдістемелік қамтамасыз етілушілік
Автордың аты-жөні |
Оқу-әдістемелік әдебиеттің атауы |
Баспа, Басылып шығатын күні |
Даналар саны |
||||
кітапха-нада |
кафед-рада |
||||||
Негізгі әдебиет |
|||||||
|
Краткий курс физической химии |
Москва: Химия, 1978,-624с |
50 |
2 |
|||
|
Физическая химия |
Москва: Металлург ия, 1986г
|
50 |
1 |
|||
3 Воюцкий С.С |
Курс коллоидной химии |
Москва: Химия,1976г |
10 |
- |
|||
4 Крестовников А.Н, Каретников Г.С, КудряшовИ.В. |
Сборник примеров и задач по физической химии. |
Москва: Высшая школа, 1976,-37с. |
10
|
-
|
|||
5 Матвийчук А.Я.,Федорченко В.И. |
Методическиеуказания к выполнению лабораторных работ по физической химии. |
Караганда: КарПТИ, 19993,-23с. |
10 |
10 |
|||
6 Малыбаева М.К.
|
Методическиеуказания для ведения лабораторных работ по дисциплине «Коллоидная химия». |
Караганда: КарГТУ,2002,-30с. |
10 |
20 |
|||
. |
Қосымша әдебиет |
|
|
|
|||
7 Голиков Г.А. |
Руководство по физической химии. |
Москва: Высшая школа,1988,-383с. |
20 |
1 |
|||
8 Фролов Ю.Г. |
Курс коллоидной химии. |
Москва: Химия,-1982г. |
10 |
- |
|||
2Пән бойынша тапсырмаларды орындау және тапсыру кестесі
Бақылау түрлері |
Тапсырманың мақсаты мен мазмұны |
Ұсынылатын әдебиет |
Орындалу ұзақтылығы |
Бақылау түрі |
Тапсыру мерзімі |
Зертхана-лық жұмыс №1 |
Тұздың суда еру жылуын анықтау. |
[1],[2],[3],[4]Лекциялар конспектісі |
80 минут |
Ағымда ғы |
2 апта |
Тексеру жұмысы№1
|
Есептер шығаруға практи калық дағдылану
Химиялық реакцияның тепе-теңдік константасын анықтау |
[1],[2],[3],[4]Лекциялар конспектісі
[3],[4]Лекциялар конспектісі
|
15минут |
Аралық
|
3апта |
Зертханалық жұмыс №2
|
80 минут |
Ағымда ғы |
4 апта
|
||
Зертханалық жұмыс №3
|
Таралу заңы |
[3],[4]Лекциялар конспектісі
|
80 минут |
Ағымдағы |
6 апта |
Реферат
|
Химиялық жүйелерді термодинамикалық талдау |
[1],[2]Лекциялар конспектісі
|
2-5апта |
Аралық
|
5 апта |
Тексеру жұмысы№2
|
Тақырып бойынша есептер шығаруға практикалық дағдылану |
[3],[4]Лекциялар конспектісі
|
20 минут |
Ағымда ғы |
7 апта |
Зертханалық жұмыс №4
|
Шекті араласатын сұйықтар |
[1],[2]Лекциялар конспектісі
|
80минут |
Ағымда ғы |
7 апта
|
№1Бақылау жұмысы
|
Емтиханға дайындық |
[1],[2],[3],[4]Лекциялар конспектісі |
40 минут |
Аралық
|
7 апта |
Зертханалық жұмыс №5
|
Суыту қисықтары бойынша бинарлық жүйенің балқығыштық диаграммасын құру. |
[3],[4]Лекциялар конспектісі
|
80 минут
|
Ағымда ғы
|
9 апта
|
Тексеру жұмысы№3
|
Тақырып бойынша есептер шығаруға практикалық дағдылану |
[3],[4]Лекциялар конспектісі
|
15 минут |
Аралық
|
11апта |
Зертханалық жұмыс №6
|
Беттік активті және активсіз заттардың беттік керілуін анықтау |
[3],[4]Лекциялар конспектісі
|
80 минут |
Ағымда ғы
|
10апта |
Реферат |
Химиялық кинетиканың негізгі заңдылықтары |
[3],[4]Лекциялар конспектісі
|
5-12 апта |
Аралық
|
12 апта |
Зертханалық жұмыс №7 |
Коллоид ерітінділерді алу |
[3],[4],[6], [10]Лекциялар конспектісі |
80 минут |
Ағымда ғы |
12 апта |
№2Бақылау жұмысы
|
Барлық тақырыптар бойынша теориялық және практикалық дағдыны тұжырымдау |
[1],[2],[3],[4]Лекциялар конспектісі |
40 минут |
Аралық
|
14 апта |
Зертханалық жұмыс№8
|
Коллоид ерітінділердің коагуляциясы |
[6],[2],[3],[4]Лекциялар конспектісі |
80 минут |
Аралық
|
14 апта |
Тексеру жұмысы№4
|
Тақырып бойынша есептер шығаруға практикалық дағдылану |
[6],[2],[3],[4]Лекциялар конспектісі |
15минут |
Аралық
|
14 апта |
Емтихан |
Пән материалдарының меңгерілу деңгейін тексеру |
Негізгі және қосымша әдебиеттің жалпы тізімі |
екі біріккен сағаттар |
Қорытынды |
Сессия кезеңінде |
1-ші бөлім Химиялық термодинамика(2)
Тақырып 1 Термодинамиканың негізгі түсініктері мен заңдары.
Дәрістің жоспары:
1.Термодинамикалық параметрлер, жүйе күйі функциясы,
Экстенсивті және интенсивті параметрлер,оқшауланған,жабық, ашық, гомогенді және
гетерогнді жүйелер.Жүйенің ішкі энергиясы.Жұмыс және жылу.
2.Термодинамиканың 1-ші заңы, энтальпия,үрдістің изохора және изобара жылуы.Гесс заңы
3.Химиялық үрдістердің жылу эффектілерін қалыпты түзілу және жану жылуы нейтралдау,гидратациялық еру жылуы арқылы есептеу.
4.Термодинамикалық есептеулер.Жылу сыйымдылық.Жылу эффектісінің температураға тәуелділігі,Кирхгоф теңдеуі.
5.Термодинамиканың 2-ші заңы.Заттың энтропиясы және қасиеттері. Больцманның таралу заңы. Идеал газдың изотермиялық ұлғаюы.
6.Термодинамиканың 3-ші заңы.Гиббс энергиясы және химиялық реакциялардың бағыты.
Термодинамиканың І заңы энергия сақтау заңының бір түрі. Термодинамика энергияның әр түрінің бір-біріне айналуына негізделген. Ол әр түрлі фактілерге байланысты. Термодинамика тепе-теңдік күйде реакция өздігінен жүру мүмкіндігін, жүру шегін, бағытын зерттейді. Жүйе басқа заттармен немесе денелермен энергия және зат алмасу қасиеті бар дене және денелер жиынтығы.
Осыған байланысты жүйе 3 топқа бөлінеді:
ашық жүйе – энергия және зат алмасуы бар;
жабық жүйе – энергия алмасуы бар, зат алмасуы жоқ;
оқшауланған жүйе – энергия және зат алмасуы жоқ.
Беттік бөліну ауданы бар бірдей гомогендік бөлшектер жиынтығы фаза деп аталады. Термодинамика жүйе күйі термодинамикалық параметрлер жиынтығымен сипатталады. Күй параметрлері жүйенің қандай да бір қасиеттерін сипаттайды және ол осы күйдің қандай тәсілдермен орындалғандығына тәуелсіз. (P,T,V)
Күй функциясы, ол да жүйе күйіне қандай тәсілмен орындалғандығына тәуелсіз тәуелсіз. Айналмалы үрдісте соңғы күй алғашқы күйге дәл келеді.
Термодинамиканың І заңының бірнеше анықтамасы бар.
Егер де қандай да бір үрдісте энергияның нақты бір түрі жоғалса да, онда эквивалентті мөлшерде энергияның 2-түрі пайда болады.
Оқшауланған жүйеде толық энергияның қуаты тұрақты.
Энергия жоғалмайды және жоқтан пайда болмайды.
Бірінші ретті мәңгілік двигатель болмайды.
Жүйенің ішкі энергиясы тұрақты шама.
Бөлшектерді қозғалу сипатына қарай екі топқа бөлуге болады. Егер энергия бөлшектерде хаостық қозғалыс арқылы берілсе, жылу тұрақты . болады (ал егер бөлшектердің ретті қозғалысы арқылы берілсе).Экстенсивті параметрлер жүйедегі заттар массасына тәуелді .
Интенсивті параметрлер жүйедегі заттардың массаларына тәуелсіз.
Үрдістерді сипаттауда ішкі энергия мен энтальпияның маңызы зор.
Ішкі энергияның абсолюттік мәнін есептеу мүмкін емес, сондықтан оның өзгерісін қарастырамыз.
∆U=U![]() -U
-U![]()
![]() ∆H=H
-H
кДж/моль
∆H=H
-H
кДж/моль
Термодинамикалық функция жүйенің күйін сипаттайды, сондықтан оларды жүйе күйінің функциясы деп атайды.
Сондықтн U және H изохоралық үрдісте (∆U), ∆H изобаралық үрдісте қолданылады.
Жылу мен жұмыс күй функциясы емес.
Сіңірілетін немесе шығарылатын жылудың мөлшерін жылу эффектісі деп атайды.
Айналмалы жүйеде ішкі энергия өзгерісі 0-ге тең болады.
Оқшауланған жүйеде энергия үрдісі тұрақты болады.
Егер Q сіңіріліп, A жұмыс жасалса, айналмалы жүйеде, яғни өзгеріс болмайды.
∆U=Q-A
Q=∆U+A
Термодинамиканың І заңының математикалық теңдеуін 19 ғасырдың орта шенінде Джоуль және Майер ашқан.
Газға берілетін жылудың бәрі ұлғаю жұмысына кетеді.
Изохоралық үрдіс үшін
А=P∆V
A=P(V![]() -V
)
-V
)
∆U=CdT
Q =∆U
Q![]() =C
∆T
V=const
=C
∆T
V=const
Q![]() =C
∆T
P=const
=C
∆T
P=const
Q =nC ∆T
Q =nC ∆T
Изобаралық үрдіс:
P=const
Q =C ∆T
Q =nC (T -T )
U+PV энтальпия
Q =∆H
3. Изотермиялық үрдіс: T=const
PV=RT
PV=nRT n=![]()
PV= RT
Адиабаттық үрдіс – жылу бермейді, сіңірмейді.
PV=const
Q=const
Тұрақты қысымдағы жылу
сиымдылығы тұрақты көлемдегі жылу
сиымдылығы
![]() -ға
тең болады.
-ға
тең болады.
=![]()
адиабаттық үрдісте жұмыс ішкі энергияның өзгерісіне тең болады (сан-мөлшер бойынша).
А=-U
∆U=C dT
A=-C dT
Жылу сыймдылық
Температураның өсуіне не кемуіне байланысты жүйеге берілетін жылу мөлшерін жылу сыймдылық деп атайды. Мольге есептелсе молярлық жылу сиымдылығы, ал егер жылу сиымдылық заттың бірлік салмағына есептелсе ол меншікті жылу сиымдылық деп аталады.
1мольге есептелсе молярлық деп аталады, ал температураның айырымымен сипатталса орташа жылу сыймдылық деп аталады.
C=![]() ;
C=
;
C=![]() - орташа жылу сыймдылық
- орташа жылу сыймдылық
Шынайы жылу сыймдылық 1 кг заттың температурасын,1°C температураға көтеру үшін кететін жылу мөлшері.
C=![]()
C =a+bT+cT²
a, b, c – тұрақты сандар (кестеде беріледі)
Органикалық қосылыстардың да жылу сыймдылықтары температураға сызықтық байланысты болады.
C=a+bT
Егер жылу сиымдылық Т , Т температура аралығында тұрақты болса, келесі орындаулар талданады. Мұндағы жылу мөлшерін келесі формалармен есептейді.
![]()
![]()
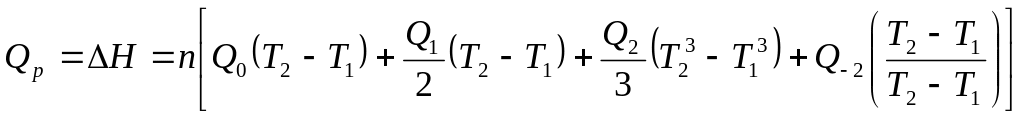 ;
;
![]()
![]()
Гесс заңы.
1840 жылы Г.И.Гесс өзінің атымен аталған заңды ашты. Гесс заңы термохимияның негізгі заңы болып табылады. Термохимия химиялық реакциялардың жылу эффектісін зерттейді. Химиялық реакцияның жылу эффектісі деп жүйенің сіңіретін және жұтатын жылу мөлшерін айтамыз. Термохимиялық белгілер термодинамикаға қарағанда өзгешелеу. Реакция барысында жылу шығарылса оң болады және экзотермиялық деп аталады, ал сіңірілсе эндотермиялық деп аталады және теріс деп саналады, яғни
Q=--q
Гесс заңы термодинамиканың І заңынан шығады. Термохимиялық теңдеуде заттардың агрегаттық күйі және жылудың мөлшері жанына жазылады.
Химиялық реакцияның жылу эффектісі заттың күйіне және түріне байланысты. Бірақ осы жағдайға жеткеніне тәуелсіз.
P=const болғанда Q =H-Q
V=const ∆U=-Q
немесе
![]()
![]()
∆n – реакцияға қатысатын газ заттарының моль өзгерісі.
Тәжірибе жүзіндегі есептеулер үшін Гесс заңынан шығатын салдарды қолданады. Олар бесеу.
Сонымен химиялық реакцияның жылу эффектісі соңғы заттың энтальпиялық суммасынан алғашқы заттың энтальпия суммасын алып тастағанына тең стехеометриялық коэффициенттерді ала отырып,
![]()
Термодинамиканың ІІ заңы.
Термодинамиканың ІІ заңы үрдістің өздігімен жүру мүмкіндігін қарастырады. Бұл заңның анықтамасының бірі.
Жылу аз қыздырылған денеден көп қыздырылған денеге ауыстырыла алмайды. Энтропия күйдің функциясы, оның өзгеру мәні қайтымды және қайтымсыз үрдістерде.
dS≥![]() ;
;
Сондықтан энтропияның өзгеру мәнін есептеу кезде қайтымды үрдістерге тән теңдеулерді қолдану керек.
Күрделі үрдістердегі энтропияның өзгерісі оның әр түрлі стадиясындағы энтропиясына тең.
Энтропия ретсіздік өлшемі оқшауланған жүйедегі энтропияның мәні 0-ден үлкен болса, яғни үрдіс өздігімен жүреді.
∆S>0
Кез-келген температурада, кез-келген зат үшін энтропияны есептеуге болады, егер оның бір температурадағы бір абсолют мәні белгілі болса.
1. P=const T -T n моль затты қыздырғанда,

С![]()
2.
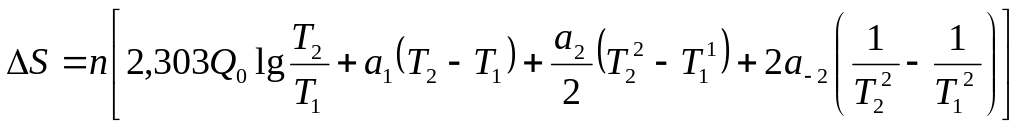
Фазалық айналым кезде есептеу
![]()
3. n моль идеал газ бір күйден екінші күйге ауысса T=const болса, онда V=const болғанда энтропия келесідей есептелінеді
![]()
![]()
![]()
![]()
4. Идеал газдарды араластырғанда Т және Р =const болса:
![]()
P=const V=const
мұндағы n және n I–шіде II –ші газдың моль саны.
V және V бастапқы көлемдері.
Термодинамиканың III–заңы изобар, изотермиялық потенциал изобар P=const болғанда, үрдістің жүру бағытын, тепе-теңдігін осы потенциалмен немесе Гиббс энергиясымен сипаттайды [кДж · моль]
Жай заттарда =0 болады
∆G=0 болғанда, қайтымсыз үдістер үшін тепе-теңдік кезде шамасы өте аз болады, ал VT=const болғанда үрдістің бағыты мен тепе-теңдігін изохора, изотармиялық потенциал сипаттайды
∆G = ∆H – ∆ST
∆F = ∆H – ∆ST
тұрақты температурада идеал газ ұлғайғанда немесе сығылғанда ∆G мәні келесі теңдеумен сипатталады:
![]()
изобара, изотермиялық үрдістер жұмыстың максимал болғандағы реакция жолына тәуелді емес және реакция процесінің өзгерісін анықтайды
![]()
∆G < 0 тура бағытта
∆G > 0 кері бағытта
∆G = 0 тепе-теңдік күй
Негізгі әдебиеттер тізімі
Киреев В.А. Краткий курс физической химии. Москва. Химия, 1978,-624с
Жуховицский А.А, Шварцман Л.А. Физическая химия. Москва: Металлургия, 1986г
Воюцский С.С. Курс коллоидной химии.Москва: Химия,1976г.
Крестовников А.Н., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Москва: Высая школа, 1976,-37с.
Семиохин И.А. Физическая химия. Учеб-изд.-МГУ, 2001,-272с
Қосымша әдебиеттер тізімі
6. Голиков Г.А. Руководство по физической химии. Москва: Высшая школа, 1988,-383с.
7. Кондратьев С.Н. Краткий курс физической химии. Москва: Высшая школа, 1978,-310с.
8. Фролов Ю.Г. Курс коллоидной химии. Москва: Химия,-1982.
9. Фридрихсберг Д.А. Курс коллоидной химии. Ленинград: Химия, 1984,-324
10. Зимон А.Д. Занимательная коллойдная химия.-4ое изд. Доп и переработанное,- Москва: Агар.-2002.-168с.
СӨЖ-на арналған бақылау жұмыстары ( тақырып 1) [1,2,3]
1.Термохимия. Гесс заңы. Жылу эффектісінің температураға тәуелділігі.
2.Термодинамиканың екінші заңы. Қайтымды үрдістердегі энтропияның өзгеруі, әртүрлі үрдістерде энтропияны анықтау
3.Изобаралық, изотермиялық және адиабаталық ұрдістердегі жұмысты есептеу.
4. Тепе-теңдікті стандартты термодинамикалық өлшемдер көмегімен есептеу.
5.Жүйенің жылу сыйымдылығы.Жылу сыйымдылық түрлері мен араларындағы байланыс.
2-ші бөлім Химиялық кинетика(2)
Тақырып 2 Химиялық кинетика негіздері.
Дәріс жоспары:
1.Гомогендік үрдістер кинетикасы. Әрекеттесуші массалар заңы.
2.Химиялық реакция реттілігі: 1-ші,2-ші,3-ші ретті реакциялар.
3.Химиялық реакциялардың кинетикалық классификациясы .Күрделі химиялық реакциялар
4Фотохимиялық және тізбекті реакциялар.
5.Гетерогенді реакциялардың кинетикасы. Ішкі және сыртқы масса алмасу.
6.Топохимиялық реакциялар. Катализ құбылысы.
Химиялық кинетика химиялық реакцияның жылдамдығын және оның әр түрлі факторларға тәуелділігін оқытады.
Химиялық реакцияның жылдамдығы дегеніміз – әрекеттесуші заттардың біреуінің концентрациясының уақыт бірлігінде өзгеруі.
Химиялық реакция жылдамдығы әр түрлі болады. Мысалы: қопарылыс, секундтың миллион үлесіне сәйкес, ал темірдің тотығуы бірнеше жылға созылуы мүмкін.
Өнеркәсіпте, химиялық үрдістерде жүретін реакцияның жылдамдығының белгілі бір шегі пайда болады.
Кинетиканы білу маңызды, химиялық аппаратураларда, өнеркәсіпті автоматтандыруда. Кинетика химиялық реакцияның механизмін зерттейді.
Химиялық реакциялар әр түрлі факторларға тәуелді:
1. Химиялық реакция жылдамдығына концентрация әсері, яғни бұл әсер ету массалар заңымен сипатталады.
Яғни әсер ету заттың молярлық концентрациясы арқылы реакцияның жылдамдығымен сипаттау. Реакцияның жылдамдығы әрекеттесуші заттар концентрациясына көбіне тура пропорционал, ал олардың стехиометриялық коэффициенті дәреже ретінде жазылады.
М: aA+bB=cC+dD
![]()
![]()
![]()
Концентрацияның физикалық мәні жылдамдыққа тең болады.
![]()
![]()
![]()
![]()
2. Жылдамдыққа температураның әсері.
Бұл әсер Вант-Гофф ережесімен сипатталады. Егер температураны 10°-қа өсіріп отырса, жылдамдық 2-4 есе өсіп отырады.
![]()
![]()
![]()
Бұл Вант-Гофф
ережесі реакцияның
жылдамдығы туралы толық мәлімет береді.
Сондықтан әрбір реакция жүру үшін
белгілі активтендіру энергиясы болады.
Бұл энергия әр молекулада болатын
энергияның артық қоры. Жылдамдық
тұрақтылығының температураға тәуелділігін
Аррениус
теңдеуі сипаттайды.
![]()
Бұл теңдеудегі
![]() мен
мен
![]() арасында сызықтық байланыс болады.
арасында сызықтық байланыс болады.
Молекулалар бір бірімен әрекеттесуі үшін қозғалыс қажет және кез-келген молекула соқтығыса бермейді, тек энергия қоры басқа молекуладан артық молекула ғана соқтығысады, яғни әрекеттеседі. Сондықтан берілген реакция үшін берілген температура белгілі бір активтендіру энергиясы болады. Активтендіру энергиясының шамасы реакцияға түсетін заттың бір мольіне шағып есептеледі.
Молекулалардың артық энергиясының көзі әр түрлі.
Термиялық активтендіру, яғни экзотермиялық реакцияның жылуын әр түрлі сәулелердің энергиясы қолданылады. Химиялық кинетика теориясы бойынша активтік соқтығысу теориясы бойынша Аррениус теңдеуі:
![]()
мұндағы -Е – активтендіру энергиясы
![]() тұрақты
көрсеткіш.
тұрақты
көрсеткіш.
Әрбір реакция үшін жалпы молекула ішінен активті молекула санын есептеуге болады.
![]()
Химиялық реакция жылдамдығына қысымның әсері:
Көлем өзгермесе, қысым жүйеге әсер етпейді.
![]()
2V=2V Р≠
![]()
4V 2V
Р↑→ моль саны көп жақ
Р↓← көп
Химиялық реакцияның молекулалығы және реттілігі.
Кинетикада химиялық реакцияларды реакциялардың молекулалығы және реттілігі бойынша жіктейді.
Химиялық реакциялардың молекулалығы дегеніміз бір уақытта химиялық үрдіске қатысатын молекуланың санын айтамыз. Егер реакцияға бір молекула түссе, оны мономолекула деп атайды, екі молекула түссе бимолекулалар, үш молекула түссе үшмолекула дейді.
![]()
![]() (бимолекула)
(бимолекула)
![]()
Химиялық реакцияның реттілігі жылдамдық теңдігі әәрекеттеуші заттардың дәреже көрсеткішінің қосындысыменмен сипатталады.
Реттілікті анықтау әдістері
Реттілік жалпы реттілік және зат бойынша реттілік болып бөлінеді.
![]()
![]() ж.р=2
ж.р=2
![]() ж.р=4
ж.р=4
Орнына қою әдісі. Алынған заттардың концентрациясының эксперименттік мәндері бойынша
 =const
анықталады. Егер әр түрлі уақыт
бірлігіндегі концентрация мәндері
бір-біріне жақын болса, онда реакция
осы реттілікпен жүреді.
=const
анықталады. Егер әр түрлі уақыт
бірлігіндегі концентрация мәндері
бір-біріне жақын болса, онда реакция
осы реттілікпен жүреді.График бойынша. Егер эксперименттік берістер түзу сызықтық бойында жатпаса, реакция реттілігіне сәйкес келмегендігі. График бойынша түзу сызық шығуы тиіс.
Жартылай ыдырау периоды, әдісі.
0,1,2,3-ші реттегі теңдеулерде
![]() ;
;
![]() ;
;
![]() концентрациясына пропорционалды түрде
сәйкес болады. Сондықтан жартылай ыдырау
периоды графиктерде, осы шамалардың
біреуіне тәуелді түзу сызық болуы керек.
концентрациясына пропорционалды түрде
сәйкес болады. Сондықтан жартылай ыдырау
периоды графиктерде, осы шамалардың
біреуіне тәуелді түзу сызық болуы керек.
4. Вант-Гофф әдісі. Бұл әдіс бойынша бүтін және бөлшек реттіліктерді анықтауға болады. Химиялық реакция реттігін біле отырып, жылдамдық концентрациясын білуге болады. Реакцияның реттілігі реакцияның жүру механизмі туралы жорамал береді.
0-ші ретті реакция үшін
І ретті реакция үшін
![]()
![]()
![]()
![]()
![]()
ІІ ретті реакция үшін ІІІ ретті реакция үшін
![]()
![]()
![]()
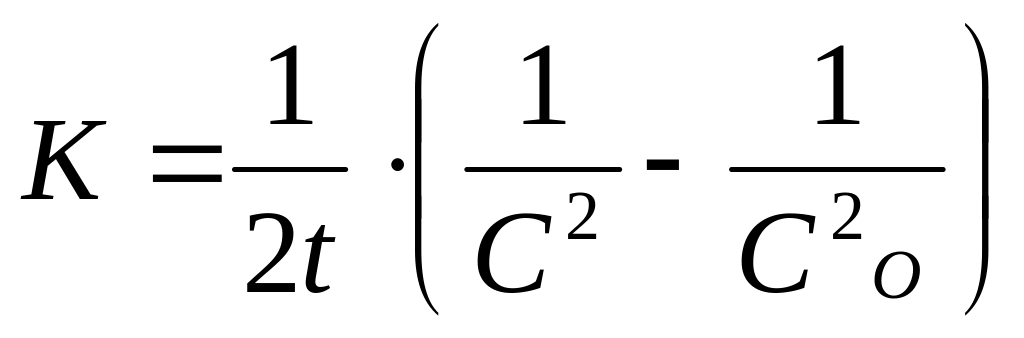
![]()
![]()
I ретті реакция үшін координатор
осіндетүзу сызық пайда болады. Жылдамдық
1-дәрежелі концентрацияға тура
пропорционал. Жартылай ыдырау периоды
натурал логарифм негізінің уақытқа
тәуелділігі сызықтық байланыс
![]() алғашқы концентрацияға тәуелді емес.
алғашқы концентрацияға тәуелді емес.
ІІ ретті реакция үшін концентрацияның уақытқа сызықтық байланысы көрінеді.
- алғашқы концентрацияға кері пропорционал.
ІІІ ретті реакция үшін концентрацияның уақытқа сызықтық байланысы байқалады, яғни алғашқы заттар концентрацияның квадратына кері пропорционал.
- алғашқы заттар концентрациясының квадратына кері пропорционал.
Реакция механизмі
Реакция жүру механизміне қарай жай және күрделі болып екіге бөлінеді. Күрделі реакциялар бірнеше сатыдан өтеді, жай реакциялар бір сатыдан өтеді.
Күрделі реакциялар параллель, ілесімді, тізбекті болып бөлінеді.
1. Параллель реакциялар бір мезгілде бірнеше бағытта әр түрлі өнімдер түзе жүреді.
М: Бертолле тұзының ыдырауы
![]()



![]()
2. Ілесімді реакциялар. Олар бірнеше сатымен бірінен кейін бірі жүреді. Онда азоттың пентаоксидін алуға болады
1)
![]()
2)
![]()
3. Тізбекті реакциялар. Оларға радиактивті заттардың ыдырауы жатады (күннің жарық шығаруы, жұлдыздың жарқырауы, термоядролық ыдырау, гелийдің түзілуі).
Химиялық тепе-теңдік.
Гомогендік химиялық реакция үшін газ ортасында тепе-теңдік тууының жағдайындағы барлық химиялық компоненттердің потенциалдық қосындысының 0-ге теңдігі
1867ж А.Гульдберг, П.Вааге химиялық реакция жылдамдығының әрекеттесуші заттың концентрациясына тәуелділігін тұжырымдаған
аА + bB = cC +dD
![]()
![]()
![]()
![]()
Химиялық реакцияның әрекеттесуші заттардың концентрациясына тура пропорционал, ал олардың стехиометриялық коэффициенті дәреже ретінде жазылады
![]()
![]()
K=const немесе пропорционалдық коэффициент const әрекеттесуші заттар табиғатына, температураға, катализатор қатысуына байланысты, бірақ әрекеттесуші зат концентрациясына тәуелсіз.
Шынайы химиялық теңдеу келесі қасиеттерге сәйкес:
Тура және кері реакциялары тең
Сыртқы жағдай өзгермеген кездегі концентрация тұрақтылығы
Тепе-теңдігі жылжымалы, біраз өзгерістен кейін қайтадан өзгермей тепе-теңдік күйге келеді
Газ ортасындағы тепе-теңдік.
Бұл жағдайда потенциал қысымын аламыз
![]()
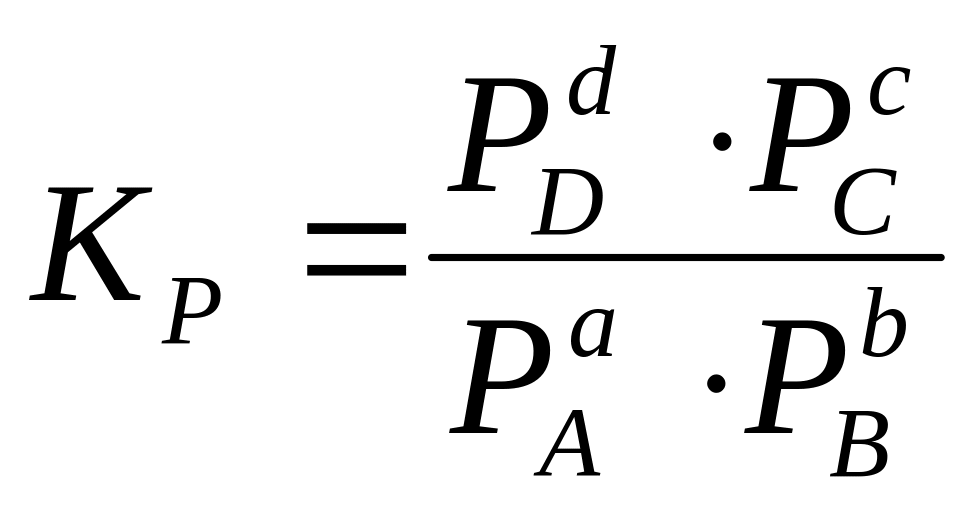
М:
![]()
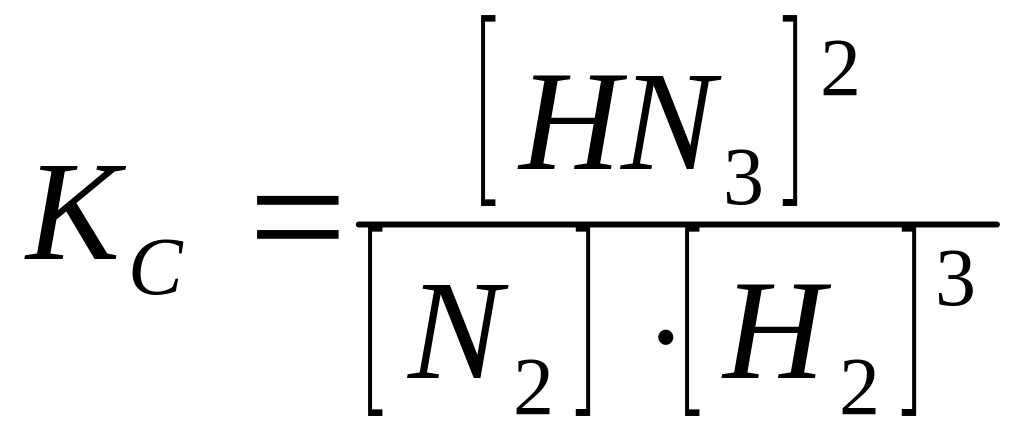

![]()
![]()
![]()
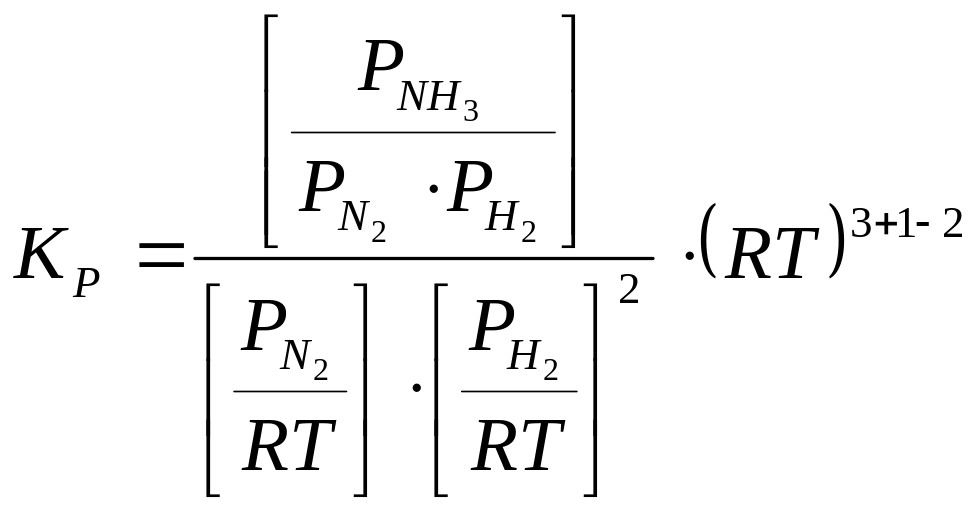
Гетерогендік реакцияның тепе-теңдік const-сы
Гетерогендік
CaCO![]() →CaO
+ CO
→CaO
+ CO
![]()
![]()
![]() - беттік аудан
- беттік аудан
![]()
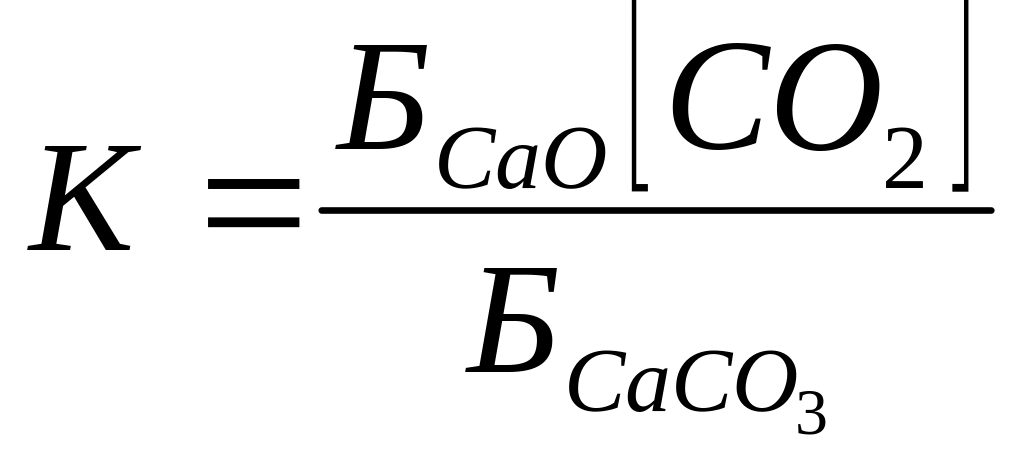 ;
;
![]()
Қысым және температураның тепе-теңдік әсері:
Изобар, изотермиялық потенциал немесе Гиббс энергиясы белгілі қоспасы бар қайтымды реакция үшін келесідей жазылады:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Вант-Гофф теңдеуі
![]() (изобара)
(изобара)
![]() (изохора)
(изохора)
![]() кері
кері
![]() - температураның өсуімен төмендейді.
- температураның өсуімен төмендейді.
Химиялық реакцияның изотермиясын Вант-Гофф изотермиясы деп атайды.
![]()
V және T=const
![]()
![]() - реагенттердің молярлық
концепциясы (массасы).
- реагенттердің молярлық
концепциясы (массасы).
Қысымың тепе-теңдікке әсері.
Егер реагенттер газ болса, онда химиялық реакцияның жылдамдығына температура тәуелді, бірақ қысым көлем өгеретін болғандықтан реакцияның тепе-теңдігі де өзгереді.
![]()
Егер қысымды (температураны) жоғарылатсақ, тепе-теңдік моль саны аз жаққа ығысады. Қысымды төмендетсек, моль саны көп жаққа ығысады.
![]()
![]()
![]()
![]()
Әр түлі жағдайлардың тепе-теңдікке әсерін Ле-Шателье анықтаған, яғни тепе-теңдік күйдегі жүйеге сырттан әсер етсе, тепе-теңдік сол әсерді баяулататын жаққа ығысады.
Егер алғашқы заттың концентрациясын арттырса, тепе-теңдік оң жаққа, өнім жағына ығысады.
Егер пайда болған зат концетрациясын арттырса тепе-теңдік әрекеттесуші заттар жаққа қарай ығысады.
Температураны жоғарылатсақ эндотермиялық реакция жаққа қарай ығысады, ал төмендетсек экзотермиялық реакция жаққа ығысады.
Негізгі әдебиеттер тізімі
Киреев В.А. Краткий курс физической химии. Москва. Химия, 1978,-624с
Жуховицский А.А, Шварцман Л.А. Физическая химия. Москва: Металлургия, 1986г
Воюцский С.С. Курс коллоидной химии.Москва: Химия,1976г.
Крестовников А.Н., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Москва: Высая школа, 1976,-37с.
Семиохин И.А. Физическая химия. Учеб-изд.-МГУ, 2001,-272с
Қосымша әдебиеттер тізімі
6. Голиков Г.А. Руководство по физической химии. Москва: Высшая школа, 1988,-383с.
7. Кондратьев С.Н. Краткий курс физической химии. Москва: Высшая школа, 1978,-310с.
8. Фролов Ю.Г. Курс коллоидной химии. Москва: Химия,-1982.
9. Фридрихсберг Д.А. Курс коллоидной химии. Ленинград: Химия, 1984,-324
10. Зимон А.Д. Занимательная коллойдная химия.-4ое изд. Доп и переработанное,- Москва: Агар.-2002.-168с.
СӨЖ-на арналған бақылау жұмыстары ( тақырып 3) [1,2,3] 4.
1.Химиялық реакциялардың жылдамдығы және оның әртүрлі факторларға тәуелділігі.
2. .Химиялық реакциялардың молекулалығы.
3.Химиялық реакциялардың реттілігіне әртүрлі факторлардың әсері.
4.Химиялық реакциялардың ретін анықтау тәсілдері.
5.1,2,3 ретті рекциялардың жылдамдық константасын есептеу
формулалары
6.Аррениус теңсіздігі. Активация энергиясы.
3-ші бөлім Фазалық айналым.(4)
Тақырып 3 Көп компонентті жүйенің фазалық тепе-теңдігі.
Дәріс жоспары:
1.Химиялық тепе-теңдік.Химиялық реакцияның изобара және изотерма теңдеуі.
2.Негізгі түсініктемелер: фаза, компонент.Фазалық айналым.
3.Жүйенің классификациясы.
4.Екі және үш компонентті жүйе диаграммалары туралы түсінік.
Гомогендік химиялық реакция үшін газ ортасында тепе-теңдік тууының жағдайындағы барлық химиялық компоненттердің потенциалдық қосындысының 0-ге теңдігі
1867ж А.Гульдберг, П.Вааге химиялық реакция жылдамдығының әрекеттесуші заттың концентрациясына тәуелсіздігін тұжырымдаған
аА + bB = cC +dD
Химиялық реакцияның әрекеттесуші заттардың концентрациясына тура пропорционал, ал олардың стехиометриялық коэффициенті дәреже ретінде жазылады
K=const немесе пропорционалдық коэффициент const әрекеттесуші заттар табиғатына, температураға, катализатор қатысуына байланысты, бірақ әрекеттесуші зат концентрациясына тәуелсіз.
Шынайы химиялық теңдеу келесі қасиеттерге сәйкес:
Тура және кері реакциялары тең
Сыртқы жағдай өзгермеген кездегі концентрация тұрақтылығы
Тепе-теңдігі жылжымалы, біраз өзгерістен кейін қайтадан өзгермей тепе-теңдік күйге келеді
Газ ортасындағы тепе-теңдік.
Бұл жағдайда потенциал қысымын аламыз
М:
Гетерогендік реакцияның тепе-теңдік const-сы
Гетерогендік
CaCO →CaO + CO
- беттік аудан
;
Қысым және температураның тепе-теңдік әсері:
Изобар, изотермиялық потенциал немесе Гиббс энергиясы белгілі қоспасы бар қайтымды реакция үшін келесідей жазылады:
Вант-Гофф теңдеуі
(изобара)
(изохора)
кері - температураның өсуімен төмендейді.
Химиялық реакцияның изотермиясын Вант-Гофф изотермиясы деп атайды.
V және T=const
- реагенттердің молярлық концепциясы (массасы).
Қысымың тепе-теңдікке әсері.
Егер реагенттер газ болса, онда химиялық реакцияның жылдамдығына температура тәуелді, бірақ қысым көлем өгеретін болғандықтан реакцияның тепе-теңдігі де өзгереді.
Егер қысымды (температураны) жоғарылатсақ, тепе-теңдік моль саны аз жаққа ығысады. Қысымды төмендетсек, моль саны көп жаққа ығысады.
Әр түлі жағдайлардың тепе-теңдікке әсерін Ле-Шателье анықтаған, яғни тепе-теңдік күйдегі жүйеге сырттан әсер етсе, тепе-теңдік сол әсерді баяулататын жаққа ығысады.
Егер алғашқы заттың концентрациясын арттырса, тепе-теңдік оң жаққа, өнім жағына ығысады.
Егер пайда болған зат концетрациясын арттырса тепе-теңдік әрекеттесуші заттар жаққа қарай ығысады.
Температураны жоғарылатсақ эндотермиялық реакция жаққа қарай ығысады, ал төмендетсек экзотермиялық реакция жаққа ығысады.
Негізгі әдебиеттер тізімі
Киреев В.А. Краткий курс физической химии. Москва. Химия, 1978,-624с
Жуховицский А.А, Шварцман Л.А. Физическая химия. Москва: Металлургия, 1986г
Воюцский С.С. Курс коллоидной химии.Москва: Химия,1976г.
Крестовников А.Н., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Москва: Высая школа, 1976,-37с.
Семиохин И.А. Физическая химия. Учеб-изд.-МГУ, 2001,-272с
Қосымша әдебиеттер тізімі
6. Голиков Г.А. Руководство по физической химии. Москва: Высшая школа, 1988,-383с.
7. Кондратьев С.Н. Краткий курс физической химии. Москва: Высшая школа, 1978,-310с.
8. Фролов Ю.Г. Курс коллоидной химии. Москва: Химия,-1982.
9. Фридрихсберг Д.А. Курс коллойдной химии. Ленинград: Химия, 1984,-324
10. Зимон А.Д. Занимательная коллойдная химия.-4ое изд. Доп и переработанное,- Москва: Агар.-2002.-168с.
СӨЖ-ға арналған бақылау жұмыстары ( тақырып 2) [1,2,3]
1. фаза ережелерінің қорытындысы.
2.Суыту қисықтары көмегімен қос құрамдас бөлікті жүйелердің күй диаграммасын тұрғызу.
3.Үш құрамдас жүйелердің күй диаграммасы туралы түсінік.
4-ші бөлім Беттік құбылыстар және адсорбция (4)
Тақырып 4 Беттік құбылыстар және адсорбция.
Дәріс жоспары:
1Коллоидты химия және оның анықтамасы. Дисперс фаза және дисперс орта туралы түсінік. Дисперс жүйелер классификациясы.
2.Беттік бөліну фазасының бос энергиясы. Беттік қабат.Беттік керілуді анықтау тәсілдері.
3.Үш фазаның бөліну шегі.Тамшы пішіні.Дымқылдану және дымқылданбау
құбылыстары.Шеткі бұрыш.Адгезия және когезия жұмысы.
4.Ерітінді-газ шекарасындағы адсорбция.Гиббстың адсорбция изотермасы.
Мицелла түзілуінің шекті концентрациясы және оны анықтау.Инертті, инактивті,беттік- активті заттар. Дюкло –Траубе ережесі.БАЗ ерітінділеріндегі мицелла түзілуі.
5.Қатты денелер бетіндегі адсорбция.Фрейндлих адсорбция изотермасы. Ленгмюрдың молекулалық адсорбциясы.БЭТ адсорбция теңдеуі. Иондық адсорбция.Алмасу адсорбциясы.
Беттік фазааралық шекарада заттар концентрациясының өзгеруін адсорбция деп атайды. Бетінде адсорбция жүретін затты адсорбент деп атайды, ал сол бетке сіңірілетін затты адсорбтив дейді. Адсорбция қайтымды үрдіс. Адсорбция құбылысының болуы, адсорбент бетінде артық энергияның болуында. Адсорбцияға қарсы үрдісті десорбция деп атайды. Адсорбент бетінің қанығуына байланысты адсорбция жылдамдығы төмендейді, ал десорбция жылдамдығы артады. Біраз уақыттан кейін адсорбциялық тепе-теңдік орналады, яғни екі үрдіс жылдамдығы бір-бірімен теңеседі.
![]()
Адсорбтив концентрацияның тепе-теңдік күйге сәйкес келетін концентрациясының тепе-теңдігі деп аталады. Адсорбция үрдісі – экзотермиялық, сондықтан температураны жоғарылату, адсорбталған зат мөлшерінің азаюына әкеледі.
Адсорбция мөлшері әр түрлі факторларға тәуелді
Адсорбтив және адсорбант табиғатына байланысты;
Адсорбтив концентрациясына;
Температураға байланысты.
Адсорбталған зат мөлшерінің оның көлемдегі концентрациясына тәуелділігін адсорбция изотермасы графигі бойынша көрсетуге болады.
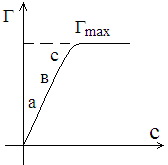
Ленгмюр
а – төменгі концентрация ауданы, адсорбция концентрация өсуіне тура пропорционал.
в – орташа концентрация ауданы, концентрация өзгеруіне қарай адсорбция аз мөлшерде өзгереді.
с – үлкен (жоғарғы) концентрация ауданы, яғни адсорбция максимум мәніне жетеді
![]()
![]()
![]()
Концентрацияның әрі қарай өзгеруі адсорбцияға әсер етпейді. Адсорбция әр түрлі шкеарада өтеді, соған байланысты адсорбция мәні Гиббс-Ленгмюр және Фрейндлих теңдеуімен есептеледі.
Концентрацияның аз мөлшерінде С мәнін ескермеуге болады.
Адсорбцияның бірлік массада алынған адсорбцияның мольдік мәні.
![]() адсорбцияның
max мәні.
адсорбцияның
max мәні.
![]() заттың
тепе-теңдік концентрациясы.
заттың
тепе-теңдік концентрациясы.
А – тұрақты шама.
яғни концентрацияның үлкен мәндерінде адсорбция.
Қатты дене ерітінділердің шекарасындағы адсорбция.
Бұл Фрейндлих теңдеуімен есептелінеді
![]()
х – адсорбцияланған заттың мольдік мөлшері.
n – адсорбент шамасы, кг.
![]() –
адсорбциялық тепе-теңдік
орныққаннан кейінгі заттардың ерігіштігі
концентрациясы.
–
адсорбциялық тепе-теңдік
орныққаннан кейінгі заттардың ерігіштігі
концентрациясы.
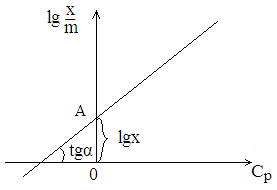
К және
![]() мәндерін есептеу үшін Фрейндлих теңдеуін
логарифмдейміз.
мәндерін есептеу үшін Фрейндлих теңдеуін
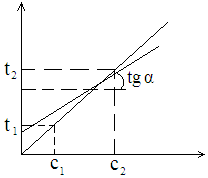
логарифмдейміз.
![]()
Абсцисса өсіне түзудің көлбеу бұрышын tgα деп белгілейміз. Көлбеу бұрыштың tg-сі мәнін береді. Түзудің ордината өсіндегі қию кесіндісі АО lgK-ға тең болады. АО·lgx
Фрейндлих теңдеуі диссоциацияланған немесе аз диссоциацияланған зат адсорбциясына қолданылады.
Сұйық және газ шекарасындағы адсорбция.
Бұл адсорбцияны есептеу үшін сұйықтың беттік керілуін есептеу тиімді.
Тұрақты температурада таза сұйықтың беттік керілуі тұрақты шама әр түрлі заттар бір-бірінде ерігенде беттік керілу болады. Беттік керілуді төмендететін заттарды беттік активті заттар деп атайды. Органикалық қышқылдар, олардың тұздары, спирттер, аминдер беттік активті заттарға жатады. Ал беттік керілуді өзгертпейтін заттарды беттік активсіз заттар деп атайды. Оларға бейорганикалық тұздар, металдардың гидроксидтері жатады.
Адсорбцияланған заттың беттік концентрациясы мен беттік керілу арасындағы байланыс Гиббс теңдеуімен сипатталады.
![]()
Қатты дене ерітінді шекарасындағы адсорбция.
Бұл жағдайда Фрейндлих теңдеуін қолданамыз. Ол теңдеу келесідей өрнектеледі.
![]()
мұндағы х – адсорбцияланған заттың молдік шамасы.
m – адсорбент шамасы, (кг).
![]() –
адсорбциялық тепе-теңдік
орныққаннан кейінгі заттың ерігіштік
концентрациясы.
–
адсорбциялық тепе-теңдік
орныққаннан кейінгі заттың ерігіштік
концентрациясы.
К,
![]() – тұрақты константалар.
– тұрақты константалар.
Негізгі әдебиеттер тізімі
Киреев В.А. Краткий курс физической химии. Москва. Химия, 1978,-624с
Жуховицский А.А, Шварцман Л.А. Физическая химия. Москва: Металлургия, 1986г
Воюцский С.С. Курс коллоидной химии.Москва: Химия,1976г.
Крестовников А.Н., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Москва: Высая школа, 1976,-37с.
Семиохин И.А. Физическая химия. Учеб-изд.-МГУ, 2001,-272с
Қосымша әдебиеттер тізімі
6. Голиков Г.А. Руководство по физической химии. Москва: Высшая школа, 1988,-383с.
7. Кондратьев С.Н. Краткий курс физической химии. Москва: Высшая школа, 1978,-310с.
8. Фролов Ю.Г. Курс коллоидной химии. Москва: Химия,-1982.
9. Фридрихсберг Д.А. Курс коллоидной химии. Ленинград: Химия, 1984,-324
10. Зимон А.Д. Занимательная коллоидная химия.-4ое изд. Доп и переработанное,- Москва: Агар.-2002.-168с.
СӨЖ-на арналған бақылау жұмыстары ( тақырып 3) [1,2,3] 4.
1.Адсорбциялық күштер табиғаты.
2.Қатты дене-газ шекарасындағы адсорбция,Поляни моно адсорбция теориясы,капиллярлық конденсация.
3.Адсорбцияға әртүрлі факторлар әсері.
4.Беттік керілу.Беттік активті заттар туралы түсінік(БАЗ),Гиббс теңдеуі.
5.Қатты дене-ерітінді шекарасындағы адсорбция, ерітіндіден молекулалық адсорбция.
5-ші бөлім Дисперсті жүйелер (3)
Тақырып 5 Дисперсті жүйелер.
Дәріс тақырыбы:
1..Дисперс жүйелерді алу: дисперстеу және конденсациялау әдісі.Дисперс жүйелерді тазарту.
2.Дисперс жүйелердің оптикалық қасиеттері.Жарықты шашырату және сіңіру.Ультромикроскопия және нефелометрия.
3.Дисперс жүйелердің электрлік қасиеттері.Электрофорез, электроосмос,Тұну және ағу потенциалы.
4.Электрлік қос қабат.Гельмгольц, Штерн теориясы.
5.Дисперстеу өлшемі.
6.Дисперс жүйелердің классификациясы.
Коллоидты химия ғылым ретінде 19-ғасырдың ортасында дамыды. Бірақ ең алғаш зерттеуді 1865 жылы Ф.Семми жүргізді. Ол ерітінділердің анамальді қасиеттеріне көңіл аударды. Коллоидты химияның негізін салушылардың бірі Томас Трэм 1861 жылы коллоидты химияның ғылым ретінде туғанын растады. Әртүрлі заттардың диффузия құбылысын зерттей отырып,бір заттардың жақсы диффузияланатынын , кристалданатынын, ал екінші бір заттардың өтпейтінін, кристалданатынын байқаған.Сондықтан ол біріншісін кристаллоид деп, ал екіншісін коллоид ( клей тәріздес, грек тілінен ) д.а. Бірақ кейін Борщов және Веймарын 1869 жылы коллоидтың негізгі түрі болмайды деген, яғни жағдайға байланысты бір зат әрі коллоид, әрі кристаллоид бола алады екен деген. Коллоидты химия заттардың физикалық-химиялық құрылымын зерттейді. Коллоидты химияның келешектегі маңызын Менделлев көрсетті.Дисперс жүйелердің болуының нәтижесінде беттік құбылыстардың негізгі теориясы п.б.
D=A
Коллоид ерітінділерінің ерекшелігі:
Жарықты шашырау қабілеті. Жарық түскенде, сүт түстес жарқырау конусты көруге болады.
Диффузиялау қабілеті, яғни коллоидты ерітінділердің диффузиясы өте баяу өтеді.
Осмостық қысым өте аз, кейде байұалмайды. Еріткіштің ерітіндіге бір жақты диффузиялануын осмос д.а. , ал осы осмосты тудыратын күштің жартылай өткізгіш мембрананың беттік бірлігіне қатынасын осмостық қысым д.а.
Коллоидтық ерітінділердің диализ-дық қасиеттері бар, яғни жартылай өткізгіш мембранасы арқылы еріген аз молекуланы заттан бөліп алуға болады.
Коллоид ерітінділер агрегативсіз тұрақсыз. Бұл бұл тұрақсыз конц-ң өсуімен артады.
Коллоид ерітінділерге электрофорез құбылысы тән.Осы 1808ж. Рейсс ашқан.Оның мәні электр өрісінде бөлшектерді электродқа тасу.
Гетерогендік диссперсия.
Гетерогендік н/е көп фазалық аралық беттің болу белгісі.Диссперстік таралу, бөлшектенуі кез келген заттың диссперс жүйедегі бөлшектерінің өлшемі көлденең өлшем.Куб үшін қабырға өлшемі н/е оған кері өлшем дисперстік D=1/A н/е меншікті беттік аудан д.а. Егер бөлшекпенен басқа заттың толық массаларда біркелкі таралса, дисперс жүйесі пайда болады.Бөлшектенген дисперс жүйе фаза д.а.
Дисперс жүйелерді, олардың дисперс дәрежесі бойынша классификациялау.
Ірі дисперсті жүйелер.Бөлшектердің дисперс фаза мөлшері 10-5 -10-3 см.Бұған жататындар: ұнтақтар, суспензия. Сипаттамасы диспер фаза бөлшектері тұнады ж/е қалқып шығады, қағаз фильтр арқылы өтпейді, жай микроскоптан көрінеді;
Жоғары дисперсті микрогетерогенді жүйе дисперс фаза бөлшектерінің мөлшері 10-5 -10-3 см дейін.Сипаттамасы: , қағаз фильтр арқылы өтеді , бірақ ультрафильтр арқылы өтпейді, тұнбайды ж/е көзге көрінбейді.
Коллоидты дисперсті ультрамикрогетерогенді жүйе 10-7 -10-5 см-ге дейін.
Нақты ерітінділер 10-7 кіші.
Дисперс жүйені агрегаттық күйі бойынша
классификациялау.![]()
№ |
Дисперс фаза |
Дисперс орта |
белгісі |
Жүйе типі |
Мысал |
1 |
қатты |
сұйық |
қисық |
суспензиялар, зольдер |
Табиғи судағы қалқымалар, ластану |
2 |
сұйық |
сұйық |
с/с |
Эмульсия |
Сүт, табиғи мұнай шикізаттары |
3 |
газ |
сұйық |
г/с |
Көбік |
Сабын көбігі |
4 |
қатты |
қатты |
қ/қ |
балқымалар |
Қатты зольдер, минералметалл балқымалары, шойын |
5 |
сұйық |
қатты |
с/қ |
Қатты эмульсиялар |
Кейбір минералдар, почва |
6 |
газ |
қатты |
г/қ |
Қатты көбік ж/е кепті денелер |
Пенза активтенд. Көмір, селикогель |
7 |
қатты |
газ |
қ/г |
аэрозоль |
Шаң, темекі түтіні, космос шаңы |
8 |
қатты |
газ |
с/г |
аэрозоль |
Тұман, бұлттар |
9 |
газ |
газ |
г/г |
Болмайды |
|
Дисперс фаза мен дисперс ортаның әрекеттесуі бойынша классификациялау.
Бұл классификациялау сұйық дисперс ортасы бар жүйеге тән. Дисперс фаза ж/е дисперс орта арасында молекулааралық әрекеттесу болып жатады. Осыған байланысты көрінісі әртүрлі болады:
1.Лиофильді (гр.«лиос»-ерітемін, «фило» - сүйемін) деген сөзінен шыққан. Дисперс фаза мен орта өте күшті әрекеттеседі.
2.Лиофовты (гр.«фобос»- қорқыныш) деген сөзінен шыққан. Әлсіз молекулааралық әрекеттесу болады.Оның нәтижесінде сольваттық қабықшалар түзіледі ( мысалы: сабын ж/е сулы батпақ).
Коллоид жүйелердің бөлшектері арасында әрекеттесуі бойынша классификациялануы екіге бөлінеді:
Еркін дисперсті – дисперс фаза бөлшектері өзара байланыспаған және еркін қозғалыста болады (суспензиялар,эмульсия).
Байланысты дисперсті фазаның біреуі еркін қозғалмайды. Себебі структуралық берік байланысқан (гель, көбік).
Маңызы: жұлдызаралық материя, газдан және шаңнан тұрады. Күн жүйесі коллоид бөлшектерінен құралған.
Коллоидты химияның маңызы зор, әртүрлі балқымада, металлургияда, метрологияда, құрылыс материалдарын жасауда, қағаз өндіруде материалдар бояу өндірісінде т.б. өндірісте маңызы зор.
1828ж. Ағылшын ботанигі Роберт Броун микроскоп арқылы гүл тозаңын қарастырғанда олардың ретсіз, үзіліссіз қозғалыста болатындығын және уақытқа байланысты өшпейтінін анықтаған.Бұл құбылысқа көп уақыт көңіл аударылмаған.Х1Х ғ. Орта шеніндегі зерттеулер бұл қозғалыстың әр уақытта бірдей екендігін және уақытқа байланысты өзгермейтінін, мәңгілік екендігін дәлелдеген. Үлкен бөлшек аздап орын ауыстырды, ал кіші бөлшек қозғалыс бағыты бойынша ретсіз үдемелі екенін байқаған. Кейінірек 1880 жылы Броун ашқан және өзінің атымен атаған. Сонымен Броун қозғалысы молекулааралық бөлшектердің соқтығысынан пайда болады. Броун қозғалысының ғылымда үлкен маңызы бар.. Атомдар молекулалар қозғалысын байланыстыра келіп, атом мен молекула бар екендігін анықтаған.
Диффузия – жүйедегі өздігінен жүретін үрдіс (молекулалар, иондар және коллоид бөлшектердің концентрациясын теңестіру, олардың жылулық қозғалыс әсерінен)
Диффузия жылу және электр заңдарымен жылу өткізгіштік және электр өткізгіштік заңымен байланысты.
1855 жылы диффузияның І заңы тұжырымдалды:
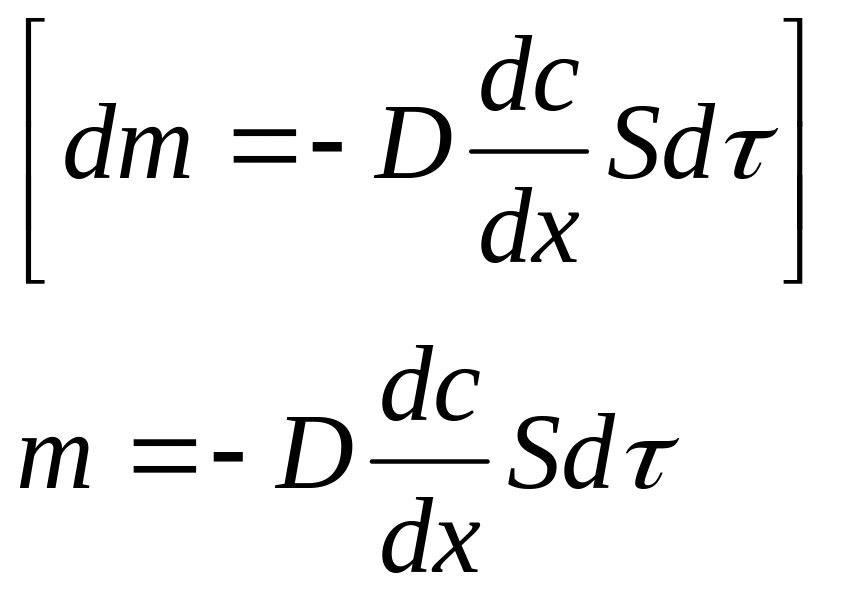
Мұндағы:
![]() -
диффузияланған зат мөлшері
-
диффузияланған зат мөлшері
D – диффузия коэффициенті
![]() - диффузия өтетін аудан
- диффузия өтетін аудан
![]() - концентрация градиенті
- концентрация градиенті
![]() - диффузияның өту уақыты
- диффузияның өту уақыты
Теңдеудің алдындағы «-» таңба қатынасы теріс мәнге ие болады. Х өскен сайын С азаяды. Егер =const, диффузия ағынды өзгертпесек, онда жүйеде стационарлық диффузиялық үрдіс орнығады:
=1, =1, =1 онда D= яғни D-ның сандық мөлшері бірлік аудан арқылы бірлік уақытта және концентрация градиенті 1-ге тең болғанда, диффузияланытан зат мөлшеріне тең:
D=(см2/с)
1908 жылы Эйнштейн диффузиялық коэффициентті абстрактылы температурамен жүйедегі дисперс фаза бөлшектерінің радиус бағытымен және ортаның тұтқырлығымен байланысты теңдеу тұжырымдады:
![]() Стокс теңдеуі
Стокс теңдеуі
Мұндағы η – динамикалық тұтқырлық, r – бөлшек радиусы

Эйнштейн формуласы.
Сфералық бөлшек үшін:
![]() Эйнштейн – Смолуховский
формуласы
Эйнштейн – Смолуховский
формуласы
Себебі
коллоид бөлшектерінің мөлшері кәдімгі
бөлшектерден үлкен, ал диффузиялық
коэффициент колоид жүйелерінде аз
болады. Нақты ерітінділердегі диффузия
жылулық қозғалысқа байланысты.Ал
коллоидты ертінділердегі диффузияның
болуы Броун қозғалысының болуына
байлынысты.Егер Броун қозғалысы мен
диффузия арасындағы байланыс болмаса,
онда бөлшектердің орташа квадраттық
ығысуымен
![]() диффузия коэффициенті D
арасындағы байланысты.
1905 жылы Эйнштейн, 1906 жылы Смолуховский
зерттеген сфералық бөлшек үшін Эйнштейн
теңдеуін қолдана отырып
диффузия коэффициенті D
арасындағы байланысты.
1905 жылы Эйнштейн, 1906 жылы Смолуховский
зерттеген сфералық бөлшек үшін Эйнштейн
теңдеуін қолдана отырып
![]() біле отырып
біле отырып
![]() есептеуге болады.Бұл жұмысты Перрен
жасады. Тұтқырлық төмендеген, температура
жоғарылаған сайын диффузия жылдамдығы
артады.
есептеуге болады.Бұл жұмысты Перрен
жасады. Тұтқырлық төмендеген, температура
жоғарылаған сайын диффузия жылдамдығы
артады.
Осмостық қысым
Осмостық қысым коллоид ерітіндінің бірлік көлеміндегі коллоид бөлшек санына немесе нақты ерітіндінің бірлік көлемде болатын молекулалар немесе иондық санына тура пропорционал болады, сонымен қоса температураға да тура пропорционал. Бұл тәуелділік Вант-Гофф теңдігімен сипатталады:
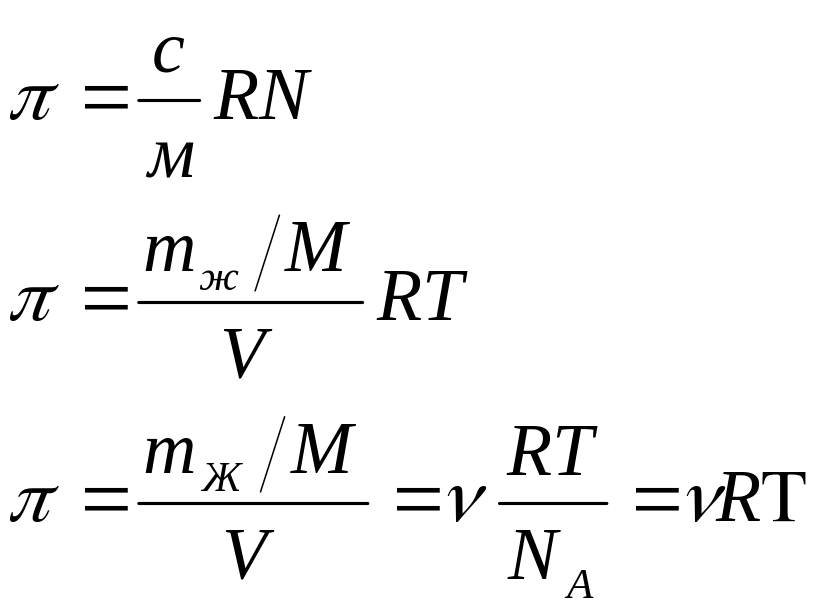
М – еріген заттың 1 молінің массасы
С- Массаның концентрациясы
mЖ – алған заттың жалпы массасы
V – еріген көлем
Бұл теңдеуді коллоидты ерітінділерге қолдануға болады. Бірақ зат массасының молі бөлшек массасымен ауыстырады.
ν- сандық концентрация.
Осмостық қысымның ерекшелігі, оның мәнәнің аздығы және тұрақсыздығы. Сонымен дисперс жүйенің осмостық қысымы тек қана сандық концентрациямен анықталады жәнеде бөлшек табиғатына, мөлшеріне байланысты:
![]()
Осмостық қысым тұрақсыздығы оның бөлшектерінің агрегаттық тұрақсыздығына байланысты.
Екі жүйені қарастырайық: дисперс фазалары табиғаты бірдей және концентрациясы да бірдей, бірақ бөлшектердің мөлшері әртүрлі:
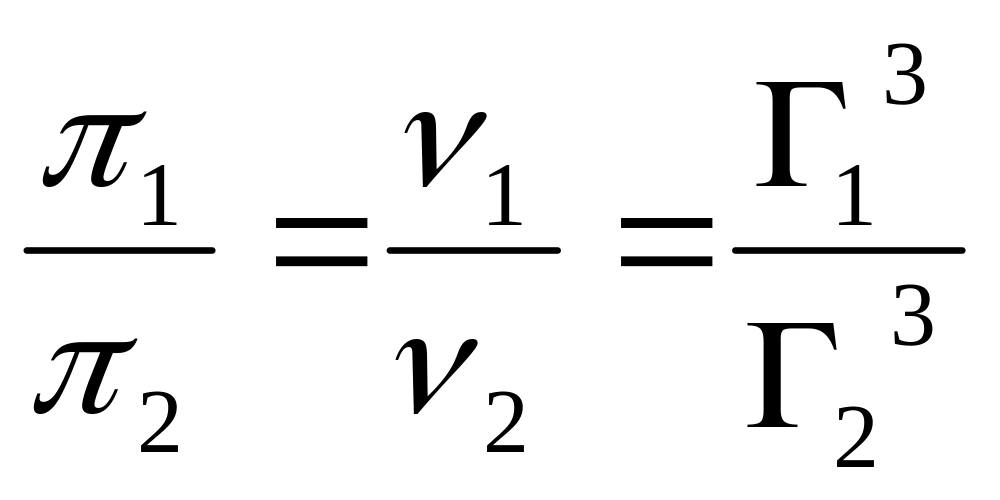
Яғни екі жүйенің осмостық қысымының қатынасы бөлшектердің радиусының кубының бір-біріне қатынасына кері пропорция.
Дисперс жүйелердегі седиментация.
Седиментация дегеніміз - ауырлық күшінің әсерінен гравитациялық өрісте бөлшектердің тұну қабілеті.
Бөлшектердің тұну қабілеті – олардың мөлшеріне, бөлшек тығыздығына орта әсеріне, сұйықтың тұтқырлығына және ауырлық күшінің үдеуіне байланысты жүйенің барлық көлеміне бөлшектердің біркелкі таралуының сақталуын седиментациялық тұрақтылық деп атайды. Бөлшектердің мөлшерін осы ортада анықтауды седиментациялық талдау деп атайды. Сфералық бөлшектерге арналған Стокс заңы бойынша бөлшек тұтқыр ортада кері әсер ететін күшті сезеді.
Ғ![]() u
u
η- орта тұтқырлығы
u-тұну жылдамдығы
r- бөлшек радиусы
Басқа жақтан бөлшектерге мына күш әсер етеді:
![]()
![]() дисперс ортадағы бөлшектер
тығыздығының айырымы
дисперс ортадағы бөлшектер
тығыздығының айырымы
![]()
q- ауырлық күшінің үдеуі. Егер F-F’ болса және температура const болғанда тұну жылдамдығы тұрақты болады.
F-седиментация тең болады.
Ғсед=Ғүйк-Ғау.күш
=
![]()
Ғүйк.=Вu
Ғау.күш = Ғсед - Ғүйк
![]() =Вu
=Вu
Ғүйк.-үйкеліс күші
V - үйкеліс коэфициенті
u- тұну жылдамдығы
Бөлшектер алғашқы жылжыған кезде олардың жылдамдығы өте аз, сондықтан олар седиментация күші арқылы жылжиды.Жылдамдық ұлғаюына байланысты және жеткілікті мөлшерде үйкеліс коэффициенті кезде үйкеліс күші седиментацияны туған күшке тең болады, яғни қозғалыс күші нолге тең болады, бөлшек қозғалысы жылдамдығы тұрақты болады.Стационарлық теңдік кезінде мына шарт орындалуы керек:
Бұл теңдеу бөлшек мөлшері 0,1-100 микрон болатын бөлшек үшін қолданылады.Суспензия бөлшектердің радиусын есептеу оңай, ол үшін тұнбаның жиналу әдісі қолданылады.Тұну жылдамдығы олардың радиусының квадратына тура пропорционал және дисперсияланған зат пен еріткіш тығыздығы айырымына тура пропорционал және еріткіштің тұтқырлығына кері пропорционал.
=Вu
![]()
![]()
![]() u
u
u
![]()

[u
![]() ]
]![]()
r=
B=![]() немесе B=
немесе B=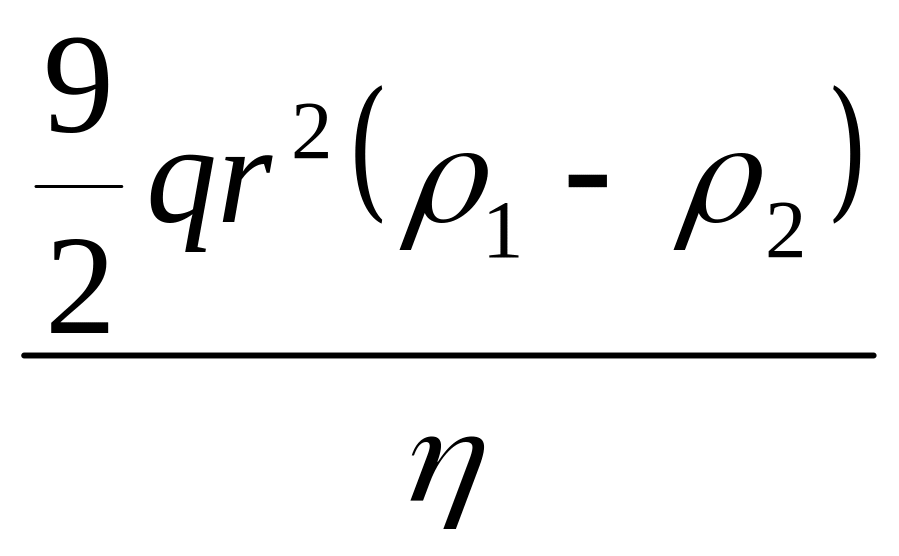
![]() бөлшек пен
бөлшек пен
![]() ортаның тығыздығы
ортаның тығыздығы
Коллоид жүйелерді алу және тазарту.
Коллоид ерітінділер ірі дисперсті және молекулалы жүйе арасында аралық орын алады, сондықтан коллоид жүйеолердегі жолмен алуға болады.Ірі бөлшектерді керекті мөлшерге дейін ұнтақтау арқылы не молекулаларды, ионды, колоид мөлшерлі агрегатқа біріктіру, зольді дисперстеу және конденсация әдісімен алады:
Дисперстеу әдсі (ұнтақтау)лофиль ерітінді көбінесе жоғарғы молекулалы ерітіндіні өзіне сәйкес еріткіште еріту арқылы алады. Үрдіс бос энергия азаюымен молекулааралық әрекеттесу арқылы (сольватация) және энтропияның ұлғаюымен жүреді (араласу).
а) Молекулалық ұнтақталу. Бұл тәсіл бойынша дисперсиялық фаза бөлшектерін ұзақ уақыт үйкелеу, ұсату, тозаңдандыру, ұнтақтау, ыдырату және оларды дисперс фаза ортамен араластыру, зольдің тұрақты болуы үшін стабилизатор қосады. Стабилизатор – химиялық реакция нәтижесінде еритін заттар. Бұл өнеркәсіптік, зертханалық қондырғыға ғана тән емес, сонымен қатар табиғи үрдістер де қолданылады.Өнеркәсіптік, зертханалық жағдайларда бұл үрдістерді ұнтақтағыштарда, диірмендерде қолданады. Диірмендер әртүрлі болады: жел, плнетарлық диірмендер және т.б. ағылмалы диірмендер.
б) Электрлі ұнтақтау (Брединг 1888ж.) бұл әдіс золін алуға қажетті екі металл электродты сұйыққа батырады. Екі металл электрод арасында вольт доғасының түзілуіне негізделген. Металл электродтың тозаңдануы (Ме) буының конденсациялануы жоғарғы температурада өтеді.Бұл тәсілмен электрлік тозаңдату арқылы зольді алады.Осы тәсілмен гидролизді жоғары бағалы металл алады. Ag, Au, Pt зольдері.Профессор Григориев осы тәсіл арқылы темір гидрооксиді золін алды. Ол өзен зольдерін тазарту үшін қолданалады.
в) Ультрадыбыс әдісі.Кейінгі кезде заттарды дисперстеу үшін ультрадыбыс әдісі жиі қолданды. Бұл тәсілмен ультрадыбыс тербелістер арқылы секундына жиілігі 20000 Гц тербеліспен ұнтақтайды. Бұл адам құлағына естілмейді, тұрақтылығы аз заттарға тән. Бұл заттарға: Смолалар, күкірт, графит, бояулар, металдар, крахмал, каучук, желатин. Ұнтақталу дыбыс толқыны әсерінен болады.
2. Конденсация әдісі. Дисперстік ұнтақталу әдісімен өте жоғарғы ұнтақ заттарды ұнтақтау мүмкін емес, яғни мөлшері 10-5, кейде 10-6 см Бұл тәсіл сырттан әсер ететін күшті қажет етпейді.
а) Физикалық конденсация (еріткішті ауыстыру әдісі). Айқын, мысалы, су конденсациясы мен тұманның түзілуі.Осы жолмен параметрлерді өзгерте отырып, мысалы, температураны бұлттар конденсациясы; найзағай мен табиғаттың әртүрлі құбылысымен күресу үшін, аэрозольдерді қолдану.
б) химиялық конденсация. Ерімейтін заттар молекулаларының химиялық реакция нәтижесінде түзілуі. Олар әрі қарай , коллоид бөлшектерінің мөлшеріне дейін жетеді. Коллоидтарды бұл әдіспен алу, конденсация ретіне және температурасына тәуелді. Мысалы:
1) NаC1 + AgNO3 →NаNO3 + AgC1 ↓- алмасу реакциясы
2Н2S + O → 2Н2O + 2S ↓ - тотығу, тотықсыздану реакциясы
FeC13 + Н2O → Fe(OН)3 ↓ + 3НC1 - гидролиз
Химиялық синтездің, мысал ретінде, сынап золін алып көрсетуге болады. Бұл үшін сынап буын су қабаты арқылы өткізген, соның нәтижесінде жоғары дисперсті сынаптың судағы эмульсиясын алған.
3.Зольдерді пептизация әдісімен алу.
Пептизация жаңа алынған алынған тұнбаларды коллоид ерітінділерге айналдыру.Ол коагуляция кезінде түзілген, ол ұю деген сөз. Тұнбаны жуу пептизация, тұнбаны электропептизациялау беттік заттармен пептизациялау, химиялық пептизациялау. Темір гидрооксидінің золі табиғи суға қызыл – қоңыр түс береді және тотыққан бурыл қатпарлардың көзі болады.
Папед – Фаянс – Липатов ережесі.
Папед кейбір суда ерімейтін тұздар кристалдары сыртқы орта ерітінділерінен иондарды ерекше адсорбциялайтындығын көрсетті. Қарсы заттардан кристал бетінің ионмен аз еритін тұз түзілгенде гидротация энергиясы кристалдық тор энергиясынан әрқашанда аз. Бұл концепцияны Фаянс әрі қарай жалғады. Ол коллоид бөлшектерді ультромикроскоптық кристаллдар деп қарастырған. Мысал ретінде, Ag NO3 коллоид ерітіндісінің түзілуі, калий артығымен алынып өсуге тенденциясы бар. Осы алынған дисперс жүйелерді молекулар және иондар қоспасынан тазартады.
Грэм тапқан әдіс – диализ әдісі.
Ультрофильтрация әдісі – жоғарғы температурадағы диализ жартылай өткізгіш мембранасында коллоид ерітінділерді төменгі молекулалардың қоспаларнан тазарту үшін ғана емес, сонымен бірге коллоид жүиелерді фазаларға бөлу үшін де қолданылады – фильтрация.
Гиперфильтрация әдісі немесе кері осмос. Ол табиғи және технологиялық суларды тазарту үшін қолданылады.
Электродиализ әдісі.
Кейінгі кезде дисперс фазаны тазарту үшін центрифуга немесе ультроцентрифугалар қолданылады.
Коллоид жүйелердің оптикалық қасиеттері
Өзінің қасиеті бойынша коллоид ерітінділердің нақты ерітінділерден айырмашылығы бар. Дисперс жүйелердің оптикалық қасиетін оқи отырып, жай микроскоп арқылы көрінбейтін бөлшектердің мөлшерін, пішінін, құрылымын есептеуге болады. Гипотеза түрінде болған негізгі микроскопиялық көзқарасты ультромикроскоп арқылы байқауға болады. Түскен жарық сәулелері, жалпы мөлдір коллоид ерітінділері арқылы өтеді. Алтын ерітіндісі көзге көрінетін кезі, егер оны бүйірінен қараңғы жерде қараса.Жарықтың шашырауын алғаш рет 1857 жылы Фарадей одан кейін 1869 жылы Тиндаль зерттеген. Жарық толқындарының ұзындығы фаза бөлшегінің ұзындығынан үлкен болды..
Фаза аралық қабатта болатын моллекулалармен, көлемде болатын моллекулалар айырмашылығы бар, энергетикалық күй бойынша. Шардың ассиметриясы және күш өрісінің болуында. Беттік қабатта болатын , яғни фаза аралық шекарада, Мыс.: су, су буы 2 фазаға да жатады және де молекула аралық күшті сезінеді. Бірақ бұл жағдай бірдей болмайды. Себебі, газ арасында молекулалар бір – бірінен едәуір қашықтықта өте аз, ал сұйық қабатта молекула тартылыс күші үлкен дәрежеде болады. Сондықтан, беттік қабатта болатын молекула тек қана беттің тартылыс күшін сезінеді. 1см. 3 бірлік бетіне қатысты күш ішкі немесе молекулалық күш деп аталады. Термодинамикалық негізден қарағанда сұйық бетінің өздігінен тартылуы, онда беттің бос энергиясының барлығын дәлелдейді. Ол сұйық бетін ұлғайтуға кететін сырттан берілген бос энергияны меншікті беттік керілу немесе беттік энергия деп атайды немесе беттік керілу деп аталады.
dw
=![]()
![]()
![]() эрг/сек2
эрг/сек2
![]()
2. Антонов ережесі.
Беттік бос энергия тең болады, күштің ұзындығы бірлігінде қатынасына тең шама. Екі сұйық аралық шектің беттік кернеуінің мәні шекаралық және фазаралық керілу деп аталады және аралардың қарқынының айырмасымен сипатталады.
![]() сұйық
=
сұйық
=![]() c.га-
c.га-![]() с.газ
с.газ
Мыс: су және бензол шекарасы үшін с.газ бензолдың судағы қаныққан ерітінділеріне қатынасы.
бензолға қаныққан су ерітіндісіне қатысты.
Поляризатордың
айырымының айырымына байланысты сұйықтың
өзара ерігіштігі артады. Фазалардың
бір-бірімен бірігетін құрылысы әліде
зерттелуде.
![]() с.газ
және
с.г
өзара мәндері жақын
болады. Оның шегі 0-ге дейін жетіп фаза
аралық шекара жойылады.
с.газ
және
с.г
өзара мәндері жақын
болады. Оның шегі 0-ге дейін жетіп фаза
аралық шекара жойылады.
Бұл қатты дене сұйық шекарада шексіз ерігіштік нәтижеде түзіледі. Бұл жағдайда да беттік арттық бос энергия болады.
Үш фазалы жүйенің үлкен мәні бар. Мыс,: сұйық беттегі сұйық тамшысы үш фаза шекарасында болатын құбылыс. Осылардың ішінде жиі кездесетін құбылыстар дымқылдану және ағу (растекание). Қатты денені сұйықпен дымқылдандыру сұйықтың өту, сіңу процессінде маңызы зор. Мыс,: судың каппиляр жүйесінде.
Су мен шыны беті жанасқан кезде дымқылдану болды. Яғни тамшы шыны бетіне жайылады, ал сынап тамшысы мен шыны арасында дымқылдану болмайды. (тамшыны аздап сығады)
Тамшы ептеп сығылады, тек ауырлық күшінің әсерінен. Үш фаза жанасады. Үш фаза арасында үш фазааралық шекара болады және үш
фазаның жанасуынан болады.
Сонымен
дымқылдандыру
![]() мөлшері фазаралық беттік керілу
мәндерімен сипатталады. Дымқылдандыру
дегеніміз-бұл беттік құбылыс, яғни
сұйықтың қатты немесе басқа денелермен
бір уақытта өзара әрекеттеспейтін
фазаның болуы. үш фазаның біреуі газ
болады. Дымқылдың сандық сипаттамасы
шекті бұрыштың cos
=
мөлшері фазаралық беттік керілу
мәндерімен сипатталады. Дымқылдандыру
дегеніміз-бұл беттік құбылыс, яғни
сұйықтың қатты немесе басқа денелермен
бір уақытта өзара әрекеттеспейтін
фазаның болуы. үш фазаның біреуі газ
болады. Дымқылдың сандық сипаттамасы
шекті бұрыштың cos
=![]() - Юнга теңдеуі.
- Юнга теңдеуі.
Юнга теңдеуі дымқылдандыру шартын қарастырады. Шекті бұрыштың мәніне қарастырады. Шекті бұрыштың мәніне байланысты келесі шарттар орындалады:
1. Gқ.т >0 , бірақ Ө < 900 , бұл жағдайда беттің сұйықпен дымқылдану туралы сөз болады.
2. Gқ. ерітінді <Gқ. сұйық cos Ө=О Ө=900 бұл жағдайда дымқылдану болмайды.
3. Gқ.г =Gқ.с
Cos Ө=О Ө =900 Бұл жағдай (дымқылдану және дымқылданбау арасында).
6.Толық дымқылдану немесе жайылу.
Gқ.г>Gқ.с+Gс.г
Cos Ө=1 Ө =0
Адгезия және когезия жұмыстары.
Негізгі әдебиеттер тізімі
Киреев В.А. Краткий курс физической химии. Москва. Химия, 1978,-624с
Жуховицский А.А, Шварцман Л.А. Физическая химия. Москва: Металлургия, 1986г
Воюцский С.С. Курс коллойдной химии.Москва: Химия,1976г.
Крестовников А.Н., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Москва: Высая школа, 1976,-37с.
Семиохин И.А. Физическая химия. Учеб-изд.-МГУ, 2001,-272с
Қосымша әдебиеттер тізімі
6. Голиков Г.А. Руководство по физической химии. Москва: Высшая школа, 1988,-383с.
7. Кондратьев С.Н. Краткий курс физической химии. Москва: Высшая школа, 1978,-310с.
8. Фролов Ю.Г. Курс коллойдной химии. Москва: Химия,-1982.
9. Фридрихсберг Д.А. Курс коллойдной химии. Ленинград: Химия, 1984,-324
10. Зимон А.Д. Занимательная коллойдная химия.-4ое изд. Доп и переработанное,- Москва: Агар.-2002.-168с.
4 СӨЖ-ға арналған бақылау жұмыстары ( тақырып 1) [1,2,3]
Изобаралық, изотермиялық және адиабаталық ұрдістердегі жұмысты есептеу.
Тепе-теңдікті стандартты термодинамикалық өлшемдер көмегімен есептеу.
Жүйенің жылу сыйымдылығы.Жылу сыйымдылық түрлері мен араларындағы байланыс.
СӨЖ-ға арналған бақылау жұмыстары ( тақырып 2) [1,2,3]
фаза ережелерінің қорытындысы.
Суыту қисықтары көмегімен қос құрамдас бөлікті жүйелердің күй диаграммасын тұрғызу.
Үш құрамдас жүйелердің күй диаграммасы туралы түсінік.
СӨЖ-ға арналған бақылау жұмыстары ( тақырып 3) [1,2,3].
Химиялық реакциялардың реттілігіне әртүрлі факторлардың әсері.
Химиялық реакциялардың ретін анықтау тәсілдері.
3 ретті рекциялардың жылдамдық константасын есептеу формулалары
Аррениус теңсіздігі. Активация энергиясы.
СӨЖ-ға арналған бақылау жұмыстары ( тақырып 4) [1,2,3]
Қатты дене- газ шекарасындағы адсорбция: Полянидің моно- адсорбция теориясы, капиллярлық конденсация. Адсорбцияға түрлі факторлардың әсері.
Ерітінді- газ шекарасындағы адсорбция: беттік керілу, беттік шапшаң заттар туралы ұғым, Гиббс теңдеуі.
Қатты дене- ерітінді шекарасындағы адсорбция: ерітіндінің молекулалық адсорбциясы. Ылғалдандыру құбылысы.
СӨЖ-на арналған бақылау жұмыстары(5 тақырып)
1.Дисперс жүйелердің классификациясы.
2.Коллоид жүйелерді алу әдістері.
3. Коллоид бөлшектердің құрылысы.
4.Папет-Фаянс-Липатов ережесі.
5.Сұйық бетіндегі кинетика, ылғалдандыру..Адгезия және когезия құбылыстары.
6.Коллоидтарды электролиттермен коагуляциялау мәні.Коагуляция табалдырығының коагуляциялаушы ион зарядына тәуелділігі
Зертханалық жұмыстарды орындауға арналған әдістемелік нұсқаулар.
Зертханалық жұмыс № 1
Тұздың суда еру жылуын анықтау.
Жұмысты орындау реті:
1. Анықтау әдісімен танысу.
2. Аспапты жинау.
3. Эксперимент жүргізу.
4. Эксперимент нәтижелерімен жұмысқа есептеме жасау, сызбасын(диаграммасын) тұрғызу.
Бақылау сұрақтары:
1. Термодинамиканың бірінші бастамасына математикалық сыипаттама және анықтама беру.
2. Изобаралық, изотермиялық және адиабаттық үрдістердегі жұмысты есептеу.
3. Гесс заңының негізі және одан шығатын салдар.
4. Жылу сыйымдылық. Жылу сыйымдылықтар және араларындағы байланыстар түрлері.
5. Температураға жылу сыйымдылықтың және жылу эффектісінің тәуелділігі.
6. Еру жылуына, нейтрализация, гидратация, жану жылулымен зат түзілуіне анықтама беру.
7. Термодинамиканың екінші бастамасы.
8. Қайтымды және қайтымсыз үрдістердегі энтропия шамасы.
Ұсынылатын әдебиеттер:
1. Киреев В.А. Краткий курс физической химии. Москва. Химия, 1978,-624с
2.Жуховицский А.А, Шварцман Л.А. Физическая химия. Москва: Металлургия, 1986г
3.Воюцский С.С. Курс коллойдной химии.Москва: Химия,1976г.
4. Крестовников А.Н., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Москва: Высая школа, 1976,-37с.
5. Семиохин И.А. Физическая химия. Учеб-изд.-МГУ, 2001,-272с
Зертханалық жұмыс №2
Химиялық реакцияның тепе- теңдік константасын анықтау
Жұмысты орындау реті:
1. Анықтау әдісімен танысу.
2. Аспапты жинау.
3. Эксперимент жүргізу.
4. Эксперимент нәтижелерімен жұмысқа есептеме жасау, сызбасын(диаграммасын) тұрғызу.
Бақылау сұрақтары:
1.Тепе-теңдік константасына анықтама беру.
2.Кс и Кр арвлығындағы байланыс.
3.Химиялық реакция изотермасын келтіріп ,түсіндіріңіз.
4. Химиялық реакция изохорасын келтіріп, түсіндіріңіз.
5. Химиялық реакция изобарасын келтіріп, түсіндіріңіз.
6.Гетерогендік реакция тепе-теңдік константасын қалай есептейді.
Ұсынылатын әдебиеттер:
1. Киреев В.А. Краткий курс физической химии. Москва. Химия, 1978,-624с
2.Жуховицский А.А, Шварцман Л.А. Физическая химия. Москва: Металлургия, 1986г
3.Воюцский С.С. Курс коллойдной химии.Москва: Химия,1976г.
4. Крестовников А.Н., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Москва: Высая школа, 1976,-37с.
5. Семиохин И.А. Физическая химия. Учеб-изд.-МГУ, 2001,-272с
Зертханалық жұмыс№3
Таралу заңы. Экстракция .
Жұмысты орындау реті:
1. Анықтау әдісімен танысу.
2. Аспапты жинау.
3. Эксперимент жүргізу.
4. Эксперимент нәтижелерімен жұмысқа есептеме жасау, сызбасын(диаграммасын) тұрғыз
Бақылау сүрақтары:
1.Таралу заңының мәні неде?
2.Таралу есептеуінен алшақтау неге байланысты.
3.Экстракциялау үрдісі неге байланысты,оның теориялық негізі неде.
4.Затты толық алу үшін экстракцияны қалай жүргізеді.
Ұсынылатын әдебиеттер:
1. Киреев В.А. Краткий курс физической химии. Москва. Химия, 1978,-624с
2.Жуховицский А.А, Шварцман Л.А. Физическая химия. Москва: Металлургия, 1986г
3.Воюцский С.С. Курс коллоидной химии.Москва: Химия,1976г.
4. Крестовников А.Н., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Москва: Высая школа, 1976,-37с.
5. Семиохин И.А. Физическая химия. Учеб-изд.-МГУ, 2001,-272с
Зертханалық жұмыс№4
Шекті еритін сұйықтар.Диаграмма құрып еру температурасының шегін анықтау.
Жұмысты орындау реті:
1. Анықтау әдісімен танысу.
2. Аспапты жинау.
3. Эксперимент жүргізу.
4. Эксперимент нәтижелерімен жұмысқа есептеме жасау, сызбасын(диаграммасын) тұрғызу.
Бақылау сұрақтары:
1.Сұйықтардың өзара ерігіштігі неге байланысты?
2.Ерудің шекті температурасы деп нені айтады?
3.Жүйеде неше тәуелсіз дәрежелер саны болады,егер берілген құрам нүктесі сызықта, сызықтан тыс, сызық бойында болса.
Ұсынылатын әдебиеттер:
1. Киреев В.А. Краткий курс изической химии. Москва. Химия, 1978,-624с
2.Жуховицский А.А, Шварцман Л.А. Физическая химия. Москва: Металлургия, 1986г
3.Воюцский С.С. Курс коллоидной химии.Москва: Химия,1976г.
4. Крестовников А.Н., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Москва: Высая школа, 1976,-37с.
5. Семиохин И.А. Физическая химия. Учеб-изд.-МГУ, 2001,-272с
Зертханалық жұмыс№5
Суыту қисықтары бойынша бинарлы жүйенің балқығыштық диаграммасын құрастыру.
Жұмысты орындау реті:
1. Анықтау әдісімен танысу.
2. Аспапты жинау.
3. Эксперимент жүргізу.
4. Эксперимент нәтижелерімен жұмысқа есептеме жасау, сызбасын(диаграммасын) тұрғызу.
Бақылау сұрақтары
1.Фаза, компонент, тәуелсіздік дәрежесі деген сөздерге түсініктеме.
2.Гиббстың фпзалар ережесінің анықтамасы.
3.Қандай жүйе вариансыз, біржәне екі вариантты деп аталады.
4.Жай эвтектикалы екі құрамдас бөлікті жүйе диаграммасы
5.Ликвидус, солидус қисықтары дегеніміз не? Эвтектикалық деп қандай қоспаны айтады.
Ұсынылатын әдебиеттер:
1.Киреев В.А. Краткий курс физической химии. Москва. Химия, 1978,-624с
2.Жуховицский А.А, Шварцман Л.А. Физическая химия. Москва: Металлургия, 1986г
3.Воюцский С.С. Курс коллоидной химии.Москва: Химия,1976г.
4. Крестовников А.Н., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Москва: Высая школа, 1976,-37с.
5. Семиохин И.А. Физическая химия. Учеб-изд.-МГУ, 2001,-272с
Зертханалық жұмыс №6
Беттік активті және беттік активті емес заттардың ерітінділерінің беттік керілуін анықтау.
Жұмысты орындау реті:
1. Анықтау әдісімен танысу.
2. Аспапты жинау.
3. Эксперимент жүргізу.
4. Эксперимент нәтижелерімен жұмысқа есептеме жасау, сызбасын(диаграммасын) тұрғызу.
Бақылау сұрақтары
1.Беттік керілу дегеніміз не?
2.Беттік активті заттар дегеніміз не?
3.Сұйықтардың беттік керілуі мен тығыздығы арасындағы байланыс.Бачинский теңдеуі.
4.Неліктен сұйық тамшысы шар пішінін алуға ұмтылады.
Ұсынылатын әдебиеттер:
1. Киреев В.А. Краткий курс изической химии. Москва. Химия, 1978,-624с
2.Жуховицский А.А, Шварцман Л.А. Физическая химия. Москва: Металлургия, 1986г
3.Воюцский С.С. Курс коллоидной химии.Москва: Химия,1976г.
4. Крестовников А.Н., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Москва: Высая школа, 1976,-37с.
5. Семиохин И.А. Физическая химия. Учеб-изд.-МГУ, 2001,-272с
Зертханалық жұмыс№7
Коллоид ерітінділерді алу. Электрофорез.
Жұмысты орындау реті:
1. Анықтау әдісімен танысу.
2. Аспапты жинау.
3. Эксперимент жүргізу.
4. Эксперимент нәтижелерімен жұмысқа есептеме жасау, сызбасын(диаграммасын) тұрғызу.
Бақылау сұрақтары
1.Дисперс жүйелердің классификациясы.
2.Коллоид жүйелерді алу әдістері.
3. Коллоид бөлшектердің құрылысы.
4.Папет-Фаянс-липатов ережесі.
Ұсынылатын әдебиеттер.
1. Киреев В.А. Краткий курс изической химии. Москва. Химия, 1978,-624с
2.Жуховицский А.А, Шварцман Л.А. Физическая химия. Москва: Металлургия, 1986г
3.Воюцский С.С. Курс коллоидной химии.Москва: Химия,1976г.
4. Крестовников А.Н., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Москва: Высая школа, 1976,-37с.
5. Семиохин И.А. Физическая химия. Учеб-изд.-МГУ, 2001,-272с
Зертханалық жұмыс№8
Коллоид ерітінділердің коагуляциясы
Әртүрлі концентрациялы электролиттермен зольдің коагуляция табалдырығын анықтау.
Жұмысты орындау реті:
1. Анықтау әдісімен танысу.
2. Аспапты жинау.
3. Эксперимент жүргізу.
4. Эксперимент нәтижелерімен жұмысқа есептеме жасау, сызбасын(диаграммасын) тұрғызу
Бақылау сұрақтары:
1.Қандай жүйелер коллоид деп аталады.
2.Электрофорез дегеніміз не?
3.Коагуляция анықтамасын келтіріңіз.
4.Дзета потенциал деген не?
5.Қандай жолдармен коагуляцияны орындауға болады.
Ұсынылатын әдебиеттер.
1. Киреев В.А. Краткий курс изической химии. Москва. Химия, 1978,-624с
2.Жуховицский А.А, Шварцман Л.А. Физическая химия. Москва: Металлургия, 1986г
3.Воюцский С.С. Курс коллоидной химии.Москва: Химия,1976г.
4. Крестовников А.Н., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Москва: Высая школа, 1976,-37с.
5. Семиохин И.А. Физическая химия. Учеб-изд.-МГУ, 2001,-272с
