
- •6.1.1.2. Поняття про кванти. Квантова гіпотеза Планка
- •6.1.1.3. Гіпотеза Ейнштейна. Фотони. Фотоефект
- •6.1.1.4. Корпускулярно – хвильовий дуалізм
- •6.1.1.5. Хвильові властивості мікрочастинок. Хвилі де Бройля
- •6.1.1.6. Елементи релятивістської динаміки
- •6.1.1.7. Квантові постулати Бора
- •6.1.1.8. Теорія атома за Бором. Спектр атома водню. Природа спектральних ліній
- •6.1.1.9. Спонтанне та вимушене випромінювання. Підсилення світла. Лазер
- •6.1.2. Елементи фізики твердого тіла
- •6.1.2.1. Основні фізичні властивості і характеристики напівпровідників.
6.1.1.8. Теорія атома за Бором. Спектр атома водню. Природа спектральних ліній
1. Відомо, що спектри випромінювання газів – лінійчасті. Вимірювання частот спектральних ліній показало, що вони розміщуються групами (серіями) і підпорядковуються певним закономірностям; їх було встановлено емпірично. Самий простий спектр належить самому простому хімічному елементу – водню. Частота будь-якої лінії спектра водню описується формулою:
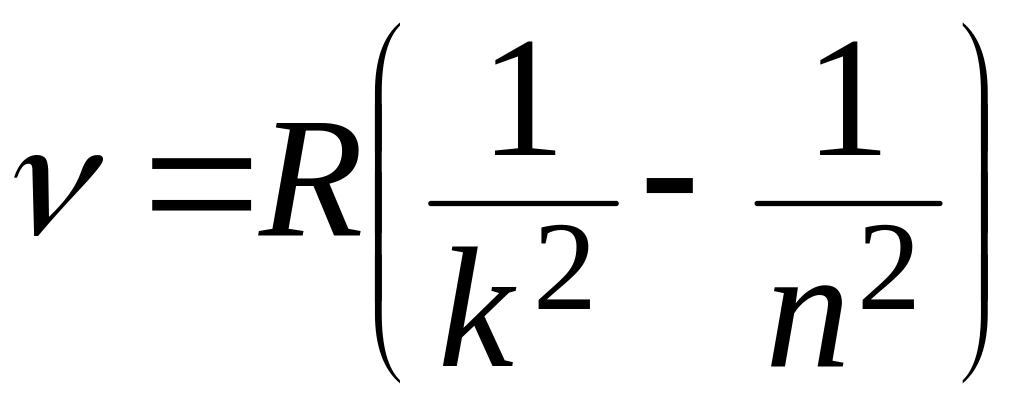 ,
(6.1.25)
,
(6.1.25)
де
R
= 3,29![]() –
константа, що
називається сталою Рідберга, а k
та n
– додатні
цілі числа, причому n>k.
–
константа, що
називається сталою Рідберга, а k
та n
– додатні
цілі числа, причому n>k.
Група ліній, що відповідає k=1 і n = 2,3,4..., розміщується в ультрафіолетовій частині спектра – це серія Лаймана. Групу ліній, для якої k=2 i n = 3,4,5,.., названо серією Бальмера. чотири її лінії знаходяться у видимій області спектра, інші – в ультрафіолетовій. При k=3,4,5,… отримуємо відповідно серії Пашена, Брекета, Пфундта і т.д.; вони знаходяться в інфрачервоній області.
2. Оскільки частоти ліній визначаються різницями енергій стаціонарних станів атома,
![]()
![]() (6.1.26)
(6.1.26)
то знаючи лінійчастий спектр, можна визначити енергії стаціонарних станів. Для подальшого зручно, помноживши співвідношення (6.1.28) на h, представити його у вигляді, подібному до (1.5.29):
![]() ;
або
;
або
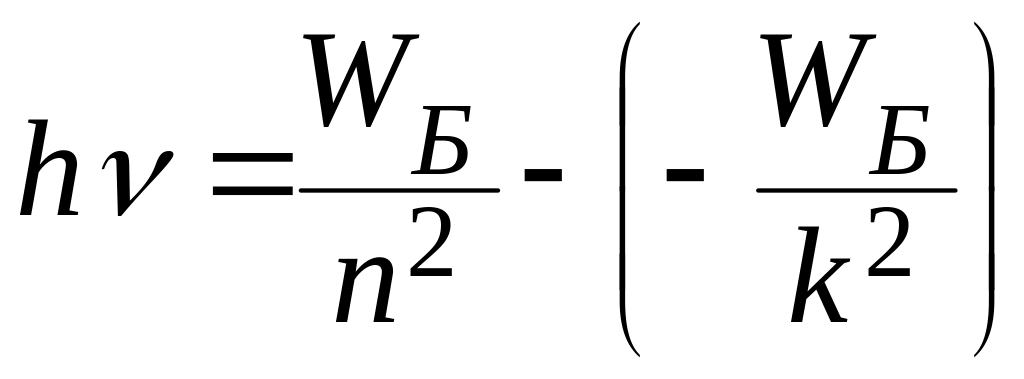 ,
(6.1.27)
,
(6.1.27)
де
WБ
=
![]() =13,55
еВ –
константа, що
називається борівською енергією.
=13,55
еВ –
константа, що
називається борівською енергією.
Згідно
з планетарною моделлю атома, запропонованою
Резерфордом, електрон обертається
навколо ядра атома водню по коловій
орбіті. При цьому сила кулонівського
притягання електрона та ядра Fкул
відіграє роль доцентрової сили,
Fдоц=![]() (тут
r
– радіус орбіти,
–
швидкість електрона, що рухається по
цій орбіті):
(тут
r
– радіус орбіти,
–
швидкість електрона, що рухається по
цій орбіті):
Fкул = Fдоц . (6.1.28)
Кулонівська сила визначається за виразом
![]() ,
(6.1.29)
,
(6.1.29)
де
![]() –
електрична
стала. Підставляючи у це співвідношення
значення обох сил, одержуємо:
–
електрична
стала. Підставляючи у це співвідношення
значення обох сил, одержуємо:
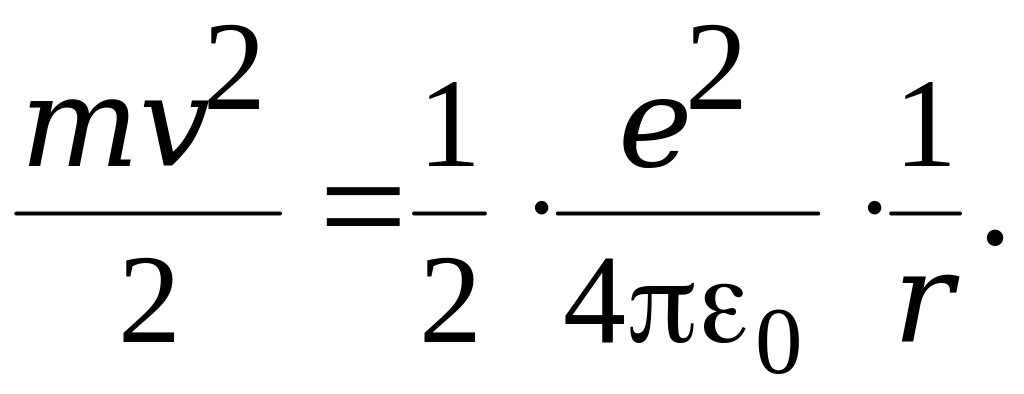 (6.1.30)
(6.1.30)
Повна
енергія атома водню W
складається з кінетичної енергії
електрона
![]() і взаємної потенціальної енергії
електрона та ядра:
і взаємної потенціальної енергії
електрона та ядра:
![]() .
(6.1.31)
.
(6.1.31)
Таким чином, повна енергія атома буде дорівнювати:
![]() .
(6.1.32)
.
(6.1.32)
Підставляючи в формулу (6.1.32) значення кінетичної і потенціальної енергій, знаходимо, що повна енергія атома є від’ємною:
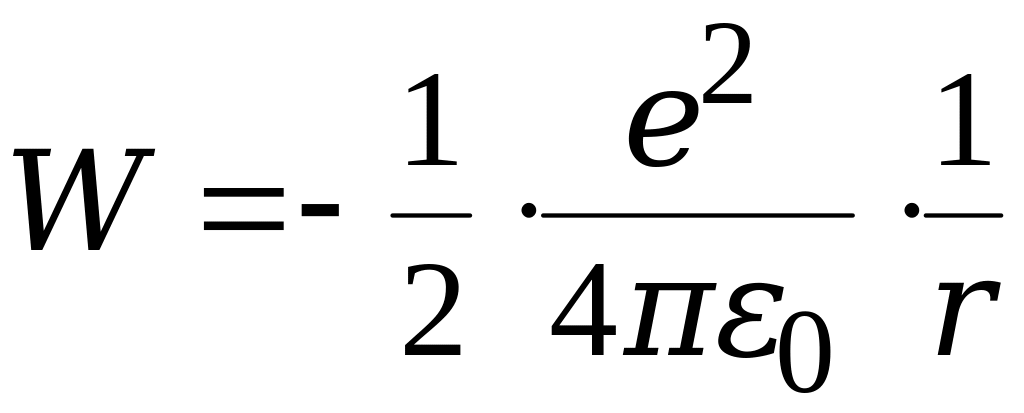 .
(6.1.33)
.
(6.1.33)
Тепер, порівнюючи з (1.1.27), знаходимо енергію стаціонарних станів атома:
![]() (6.1.34)
(6.1.34)
Число
n
у формулі (6.1.34) може приймати будь–які
цілі значення від 1 до
![]() ,
його називають головним квантовим
числом, воно визначає номер стаціонарного
стану. Як бачимо, зі збільшенням n
енергія стаціонарного стану зростає
(бо W
< 0).
Стан n=1
є основним, йому відповідає найменша
енергія атома водню, W1=
-WБ =13,55
еВ; усі інші стани – збуджені.
,
його називають головним квантовим
числом, воно визначає номер стаціонарного
стану. Як бачимо, зі збільшенням n
енергія стаціонарного стану зростає
(бо W
< 0).
Стан n=1
є основним, йому відповідає найменша
енергія атома водню, W1=
-WБ =13,55
еВ; усі інші стани – збуджені.
3. Співвідношення (6.1.33) отримано для будь-якої колової орбіти електрона. Згідно з цим співвідношенням енергія атома визначається радіусом орбіти електрона. Оскільки енергія атома може приймати тільки суворо визначені дискретні значення, то і електронні орбіти можуть бути не будь-якими, а тільки суворо визначеними – стаціонарним станам відповідають стаціонарні орбіти. Радіуси стаціонарних орбіт r = rn знаходимо, прирівнюючи праві частини виразів (6.1.33) і (6.1.34):
![]() ,
(6.1.35)
,
(6.1.35)
де
![]() .
(6.1.36)
.
(6.1.36)
Константа
rБ
– називається борівським радіусом.
Відповідно до (6.1.35) радіус стаціонарної
орбіти пропорційний квадрату головного
квантового числа. Із співвідношення
rn=![]() випливає, що значення
випливає, що значення
![]() відповідає нескінченно великій відстані
електрона від ядра. Це означає, що атом
водню іонізовано (електрон відірвано
від атома). Разом з тим, відповідно до
(6.1.34) при
відповідає нескінченно великій відстані
електрона від ядра. Це означає, що атом
водню іонізовано (електрон відірвано
від атома). Разом з тим, відповідно до
(6.1.34) при
![]() прямує до нуля повна енергія W
атома. Отже, для іонізації атома водню,
що знаходиться в основному стані (тобто
такому, що має енергію:
W=W1=-WБ)
йому необхідно надати енергію, що
дорівнює WБ.
Таким
чином, борівська енергія має зміст
енергії іонізації атома водню.
прямує до нуля повна енергія W
атома. Отже, для іонізації атома водню,
що знаходиться в основному стані (тобто
такому, що має енергію:
W=W1=-WБ)
йому необхідно надати енергію, що
дорівнює WБ.
Таким
чином, борівська енергія має зміст
енергії іонізації атома водню.
4.
Електрон, що обертається по коловій
орбіті, характеризується моментом
імпульсу L,
який дорівнює
m
r
(див. рис. 6.1.5). Момент
імпульсу електрона, який рухається по
n
- й стаціонарній
орбіті дорівнює mVnrn
(тут
![]() –
швидкість електрона при русі по n-й
орбіті), тобто пропорційний n:
–
швидкість електрона при русі по n-й
орбіті), тобто пропорційний n:
![]() ,
(6.1.37)
,
(6.1.37)
д е
е
![]()
![]() =1,054·10-34
Джс
(константу
=1,054·10-34
Джс
(константу
![]() як і h,
називають сталою Планка).
як і h,
називають сталою Планка).
Таким чином, стаціонарними є такі орбіти, для яких момент імпульсу електрона є кратним величині . Це твердження отримало назву правила квантування орбіт. Його вперше сформулював Бор (1913 р.).
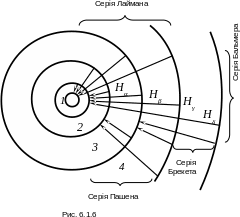
5.
Перехід атома водню з одного стаціонарного
стану n
(з енергією
![]() )
до іншого k<n
(з меншою енергією
)
до іншого k<n
(з меншою енергією
![]() )
означає перехід електрона із стаціонарної
орбіти номер n
на орбіту номер k,
яка ближче розташована до ядра. Рис.
6.1.6 ілюструє борівську інтерпретацію
водневих ліній. Ультрафіолетова серія
Лаймана (k=1),
серія Бальмера у видимій області спектра
(k=2),
інфрачервона серія Пашена (k=3)
і ще більш зсунута в інфрачервону область
серія Брекета (k=4)
показані стрілками
відповідних електронних переходів.
)
означає перехід електрона із стаціонарної
орбіти номер n
на орбіту номер k,
яка ближче розташована до ядра. Рис.
6.1.6 ілюструє борівську інтерпретацію
водневих ліній. Ультрафіолетова серія
Лаймана (k=1),
серія Бальмера у видимій області спектра
(k=2),
інфрачервона серія Пашена (k=3)
і ще більш зсунута в інфрачервону область
серія Брекета (k=4)
показані стрілками
відповідних електронних переходів.
Для
градуювання спектроскопа, тобто
найпростішого приладу для спостереження
спектрів випромінювання, використовують
чотири видимі лінії серії Бальмера, що
отримали назви
![]() (червона,
(червона,
![]() = 656,3 нм),
= 656,3 нм),
![]() (зелена,
=486,7
нм),
(зелена,
=486,7
нм),
![]() (синя,
=434,0
нм) і
(синя,
=434,0
нм) і
![]() (фіолетова,
=410,2
нм).
(фіолетова,
=410,2
нм).
