- •Промышленный органический синтез
- •1. Сырье промышленности органического синтеза
- •2. Процессы органического синтеза
- •3. Синтез метилового спирта
- •4. Производство этилового спирта
- •5. Производство ацетилена и его переработка
- •6. Производство капролактама
- •6.1. Структурная схема производства капролактама из бензола
- •6.2. Физико-химические основы и технологическая схема
- •7. Производство стирола
- •Производство формальдегида окислительным дегидрированием метанола
- •Производство формальдегида окислением метанола
5. Производство ацетилена и его переработка
Среди многочисленных газообразных углеводородов ацетилену принадлежит особое место. Практическое применение и использование ацетилена исключительно велико и многообразно. Так как ацетилен - соединение ненасыщенное, то его молекулы легко вступают в самые различные химические реакции и получаемые многочисленные производные дают начало большому
количеству важных для народного хозяйства веществ. В настоящее время ацетилен получают из карбида кальция и углеводородного сырья.
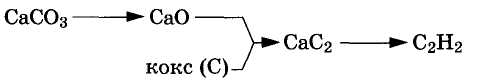
Производство ацетилена разложением карбида кальция осуществляется в ацетиленовых генераторах мокрым и сухим способами по уравнению реакции:
СаС2 + Н2О = С2Н2 + Са(ОН)2+ 127 кДж
При мокром способе в генераторах, работающих по принципу «карбид в воду», дробленый карбид кальция равномерно подается в генератор, содержащий большое количество воды, за счет нагревания которой и отводится выделяющиеся в ходе процесса тепло. Воды берется десятикратное количество по отношению к весу карбида. Применяемая по этой схеме аппаратура и особенно коммуникации для удаления образующегося шлама и циркуляция воды очень громоздки. Кроме того, большие затруднения вызывают транспортировка, хранение и использование жидкого известкового молока, содержащего до 70% воды.
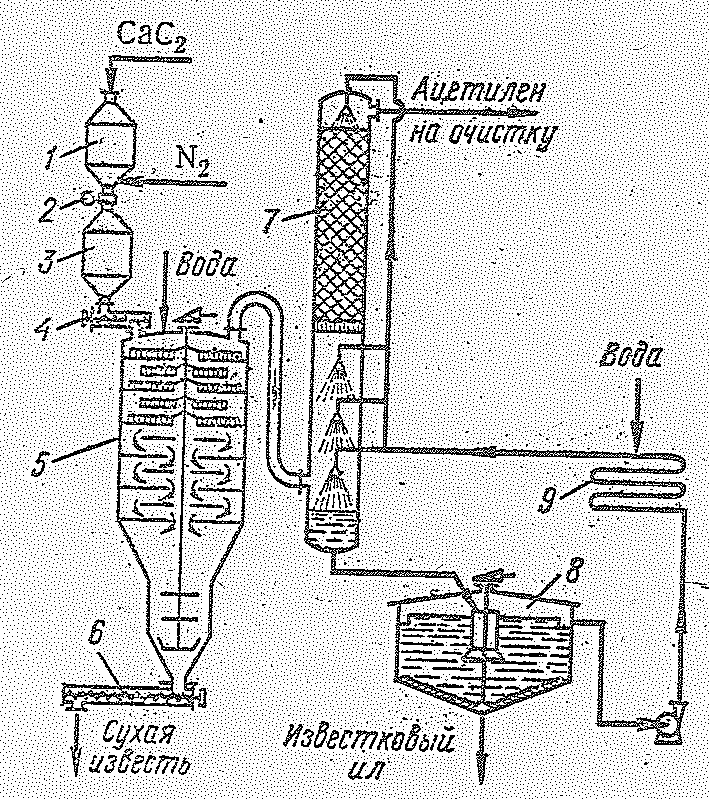
При сухом способе в генераторах, работающих по принципу «вода на карбид», воду добавляют только в таком количестве, чтобы обеспечить протекание реакции и отвод тепла за счет испарения избытка воды. В этом способе карбид кальция из бункера со шлюзовым затвором шнеком подается на верхнюю полку генератора (диаметр 3—5, высота7,5 м; 11 полок), устройство которого подобно механическим полочным печам. Необходимое количество воды подается разбрызгивающим устройством на верхнюю полку и обильно смоченный карбид кальция перемещается гребками по спирали сверху вниз через отверстия, устроенные в полках попеременно: в центре и на периферии (рис. 14.6).
|
Рис. 14.6. Схема производства ацетилена из карбида кальция: 1 - приемный бункер; 2 - автоматический затвор; 3 - буферный бункер; 4 - шнек; 5 - ацетиленовый генератор; 6 - шнек для удаления извести; 7 - скруббер; 8 – отстойник. |
Передвигаясь с полки на полку, карбид одновременно перемешивается и практически полностью (на 98%) превращается в ацетилен и Са(ОН)2. Гидрооксид кальция в виде сухого порошка (пушонка) через конусную часть генератора с мешалкой удаляется шнеком. Выделившийся в результате реакции ацетилен вместе с водяными парами и увлеченной известковой пылью при 100 °С направляется в скруббер, орошаемый водой. Здесь газ охлаждается до 20-30 оС и освобожденный от пыли поступает на очистку от фосфористого водорода (300—600 мг/м3) сероводорода (200—400 г/м3) и аммиака. Образовавшееся известковое молоко из нижней части скруббера непрерывно выводится в отстойник. Шлам из нижней части отстойника откачивается в канализацию, а осветленная вода насосом через холодильник снова направляется в скруббер. Очистка газа от примесей обеспечивается промывкой водным раствором гипохлорита с добавкой активного хлора или раствором бихромата натрия в разбавленной серной кислоте. Затем газ сушится и направляется на химическую переработку.
Карбидный метод несмотря на сравнительную простоту имеет ряд крупных недостатков, из которых в первую очередь необходимо отметить громоздкость оборудования, высокий расход электроэнергии на производство карбида (10—11 кВт-ч на 1 кг ацетилена) и затруднения с использованием отходов, получающихся в большом количестве. В последние годы разработаны эффективные промышленные способы получения ацетилена на основе углеводородного сырья. Процесс образования ацетилена из метана и его гомологов (например этана) при нагревании без доступа воздуха может быть представлен следующими реакциями крекинга:
2СН4 СНСН + 3Н2 – 376 кДж С2Н6 СНСН + Н2 – 330 кДж и т.д.
Побочная реакция СН4 = С + 2Н2 - 88 кДж. Повышение температуры и уменьшение давления позволяют сместить процесс в сторону конечных продуктов. Но при 1400—1500 °С ацетилен и углеводороды термодинамически неустойчивы и разлагаются на сажу и водород:
С2Н2 2С + Н2 + 229 кДж
или ацетилен взаимодействует с другими газами или парами воды по реакциям:
С2Н2 + 2Н2О 2СО + 3Н2 С2Н2 + 2СО2 4СО + Н2
Реакция превращения метана в ацетилен при 1400—1500 °С идет быстрее реакции распада ацетилена на элементы. Это вместе с закалкой и обеспечивает возможность получения ацетилена. Равновесные выходы ацетилена из метана при атмосферном давлении возрастают с повышением температуры.
В то же время при более низких температурах скорость основных реакций очень мала. Поэтому для достижения максимальных выходов ацетилена и уменьшения различных побочных реакций необходимо применять высокие объемные скорости газа, при которых сырьё должно находиться в реакционной зоне только тысячные доли секунды при температурах выше 1400 °С. Затем быстро охлаждают образующиеся продукты («закалка»), что позволяет предупредить разложение ацетилена.
Способы производства ацетилена из природного и других углеводородных газов: 1) электрокрекинг газообразных углеводородов или жидких продуктов (смол и тяжелых нефтяных остатков); 2) термический крекинг и 3) термоокислительный пиролиз.
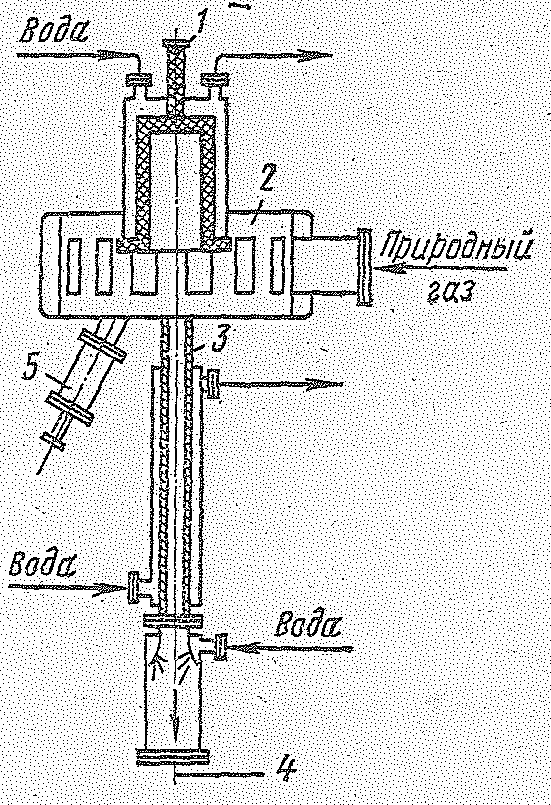
Электрокрекинг проводится в реакторе (рис. 14.7), дуга в котором создается постоянным током между электродами. Исходная газовая смесь с большой скоростью (более 100 м/с) под избыточным давлением 0,5∙105 Н/м2 входит по касательной в верхнюю расширенную часть реактора, выполненную в виде стального пустотелого цилиндра, проходит зону действия электрической дуги (1600 °С) и выходит из нее по охлаждаемой водой узкой трубе, являющейся анодом. Газы, пропускаемые здесь с большой скоростью (600-1000 м/с), в конце трубы имеют температуру 600 °С; непосредственным впрыскиванием воды обеспечивается их быстрое охлаждение до 150 °С («закалка»). Образовавшийся при этом в результате испарения воды перегретый водяной пар уходит вместе с реакционными газами. Для выделения ацетилена используют растворители: воду, ацетон, диметилформамид и др. Для «зажигания» дуги при пуске реактора применяют пусковой электрод. Расход электроэнергии на 1 кг концентрированного ацетилена составляет примерно 10 кВт-ч. Конверсия метана за один пропуск через реактор составляет 40—50%. Содержание ацетилена в газе до 14%. Данным методом можно перерабатывать метан природного газа и пары гомологов метана, что является одним из достоинств этого метода.
|
Рис. 14.7. Реактор для электрокрекинга: 1- катод; 2 -реакционная камера; 3 - заземленный анод; 4 - вывод газов крекинга; 5 - пусковой электрод. |
Термический крекинг осуществляется в регенеративных печах при 1450—1600 °С. Газ соприкасается с поверхностью заранее нагретой насадки. При наличии двух печей, соединенных одной топкой, можно обеспечить непрерывный процесс по циклу: 1 мин - нагрев насадки и 1 мин - крекинг, что способствует максимальному использованию тепла. Осуществлен также крекинг пропана в трубчатых печах при 1100—1200 °С, времени реакции 0,1-0,15 с и остаточном давлении 380 мм рт. ст.
Более широко распространен термоокислительвый крекинг (пиролиз) в котором необходимое тепло получается за счет сжигания части метана:
СН4 + 2О2 СО2 + 2Н2О + 802 кДж
Основные реакции термоокислительного крекинга
СН4 + 1/2О2 СО + 2Н2+ 32,0 кДж, 2СН4 = С2Н2 + 3Н2 - 376 кДж
В печи пиролиза поддерживается температура около 1450 °С. Для окисления применяется кислород, взятый в количестве 60— 65 об. % от метана. Оба газа предварительно раздельно подогреваются до 400—600 °С и затем с большой скоростью подаются в реакпионный канал, где находятся примерно 0,003-0,006 с. Созданная в Советском Союзе конструкция печи отличается от зарубежных своей компактностью, большей производительностью при меньшем расходе кислорода. Применяются одноканальные и многоканальные реакторы. Конверсия метана в ацетилен составляет 30%.
Установлено, что при подаче бензина в зону закалки при окислительном пиролизе метана можно значительно увеличить выход ацетилена; этилена и синтез-газа. Так как метод пиролиза и состав исходного сырья в значительной степени влияют на состав конечного газа, схемы выделения ацетилена могут сильно отличаться друг от друга.
При производстве ацетилена из метана одновременно с основным продуктом получаются большие количества водорода и других газов (табл. 1). Так, на каждую 1 т ацетилена образуется водорода в количестве, достаточном для производства 3-4 т аммиака. При электрокрекинге выделяется еще 50—100 кг сажи. Газы термоокислительного крекинга содержат окись углерода и водород в соотношении, требуемом для синтеза углеводородов или метанола (1 т метана по этому методу дает примерно 1160 кг синтез-газа).
Одним из важнейших промышленных синтезов на основе ацетилена является производство ацетальдегида. Из ацетилена он может быть получен
Таблица 1.

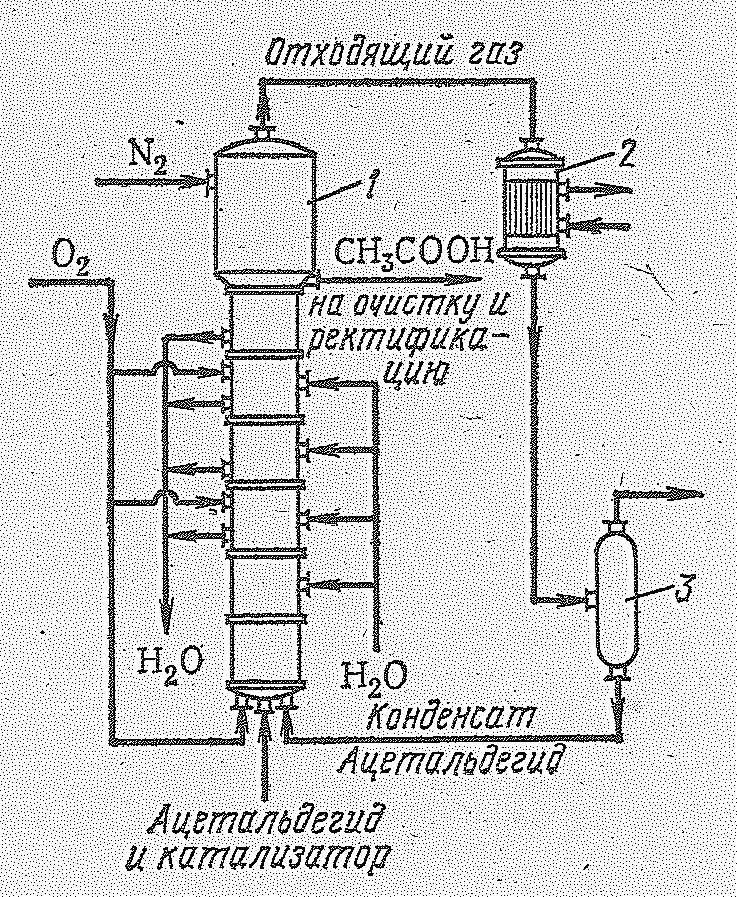
тремя методам: 1) гидратацией ацетилена в жидкой фазе с ртутно-железным катализатором (Способ М.Г. Кучерова, открытый в 1881 г.); 2) гидратацией ацетилена в паровой фазе на твердом катализаторе; 3) гидролизом простых виниловых эфиров. Кроме того, ацетальдегид производят неполным каталитическим окислением этилового спирта и каталитическим окислением этилена (наиболее перспективный метод). Производство ацетальдегида на основе реакции Кучерова осуществляется в промышленности по схеме, приведенной на рис. 14.8. Тщательно очищенный ацетилен, смешанный с циркулирующим

Рис. 14.8. Схема получения ацетальдегида гидратацией ацетилена в жидкой фазе: 1 - барботажный гидрататор; 2 и 3 — трубчатые холодильники; 4 – барботажная колонна; 5 - сборник ацетальдегида.
газом под давлением 1,5∙105 - 2,5∙105 Н/м2, непрерывно барботирует в гидрататоре (высота 15, диаметр узкой части 1,34 м) через контактную жидкость, содержащую раствор сульфата ртути (II) в серной кислоте. Так как ацетальдегид – сильный восстановитель, ходе процесса идет восстановление ртути (II) до ртути (I), а затем до металлической ртути:
2HgSО4 + Н2O + CH3СНО Нg2SО4 + Н2SO4 + СН3СООН (а)
Нg2SО4 + Н2О + CН3СНО 2Нg + Н2SО4 + СН3СООН (б)
Для сохранения необходимого состава катализаторной жидкости вводят металлическую ртуть и окислители, которые в присутствии серной кислоты переводят Hg в сульфат ртути (II), требуемую для процесса гидратации
H2SО4
2Нg + Fе2(SО4)3 ===== Hg2SO4 + 2FеSО4 (в)
Нg2SО4 + Fе2(SО4)3 2НgSО4 + 2FеSО4 (г)
Металлическую ртуть вводят периодически распыляя ее через воронку в верхней части реактора (на каждую тонну ацетальдегида безвозвратно теряется около 0,1 кг ртути). При этом 50-60% ацетилена гидратируется по уравнению реакции
СНСН + Н2О СН3-СНО + 151 кДж
Аппарат в виде колонны с расширением в верхней части, которое служит для улавливания брызг и вместилищем для образующейся пены, изготовляется из ферросилиция или из нержавеющей стали. Каждая полка барботажной гидратационной колонны по степени перемешивания газа и жидкости ближе к режиму смешения, чем к режиму вытеснения. Движение фаз происходит на полке по схеме перекреcтного тока. Однако вследствие значительного количества полок процесс можно рассчитывать по модели вытеснения при противоточном движении фаз. Температура в гидрататоре при помощи острого пара поддерживается в пределах 90-100 оС. Газы, выходящие из верхней части гидрататора и содержащие ацетальдегид, непрореагировавший ацетилен, водяные пары и другие примеси, поступают в холодильники. В первом конденсируются к пары воды, возвращаемые в гидрататор, а во втором — ацетальдегид и вода, направляемые в сборник. Несконденсировавшиеся газы подаются в абсорбер, где альдегид извлекается водой, охлажденной до 10 °С, а непрореагировавший ацетилен возвращается снова в процесс. При этом около 10% газа непрерывно отбирается на очистку от азота и двуокиси углерода, чем и предотвращается их чрезмерное накопление в циркулирующем газе. Ацетальдегид далее подвергается ректификации. Выходящая из гидрататора катализаторная жидкость направляется в отстойник (для улавливания ртути) и затем на регенерацию. Катализаторная жидкость содержит примерно 200 г/л серной кислоты, 0,5-0,6 г/л окиси ртути и 40 г/л окислов железа.
Выход ацетальдегида на прореагировавший ацетилен составляет 90-95%. Для получения 1 т ацетальдегида расходуется 680 кг ацетилена, 0,1 кг ртути, около 3 т водяного пара, а также некоторое количество серной и азотной кислот и железного купороса. В ходе процесса в виде побочных продуктов выделяются уксусная кислота, кротоновый альдегид и паральдегид.
Так как ртуть очень ядовита и ее применение нежелательно, были предложены нертутные катализаторы в виде окислов Zn, Мg, Ni, Fе, Со, Сr и других металлов, а также некоторые соли и кислоты. Такого рода гетерогенный каталитический процесс может быть провёден и во взвешенном слое. Выход ацетальдегида 88—90% на прореагировавший ацетилен. Конверсия ацетилена за проход ≈ 50%.
Производство уксусной кислоты с давних пор осуществляется сухой перегонкой дерева, брожением этилового спирта и с начала ХХ в. синтетически: окислением ацетальдегида или гидратацией кетена. При окислении ацетальдегида кислородом воздуха в присутствии солей марганца сначала образуется надуксусная кислота:
СН3-СНО + О2 СН3-СОООН
которая при взаимодействии со второй молекулой ацетальдегида дает две молекулы уксусной кислоты:
СН3-СОООН + СН3-СНО = 2СН3-СООН
Накопление надуксусной кислоты в реакционном аппарате может вызвать взрыв. Для предотвращения этого разбавляют парогазовую смесь азотом и поддерживают температуру в пределах 60—75 °С. Применяемые в качестве катализатора соли марганца способствуют восстановлению надуксусной кислоты в уксусную. Процесс осуществляется в барботажной окислительной колонне подобно той, которая используется для получения ацетальдегида. Производство состоит из трех стадий: 1) окисление ацетальдегида; 2) абсорбция ацетальдегида из отходящих газов и 3) выделение ацетальдегида из уксусной кислоты. В нижнюю часть колонны (рис. 14.9) вводится раствор
|
Рис. 14.9. Схема получения уксусной кислоты окислением ацетальдегида: 1 - окислительная колонна; 2 - конденсатор; 3 - сепаратор. |
ацетальдегида и катализатор раствор ацетата марганца. Реакционная смесь занимает всю колонну, за исключением верхней части, в которую во избежание взрыва паров подается азот. В разных местах колонны по ее высоте вводится кислород. Окисление ведется при 60-70 °С и давлении 2∙105 Н/м2. Выделяющееся тепло отводится циркуляцией жидкости и охлаждением колонны водяной рубашкой или водяными эмеевиками. Образующаяся уксусная кислота вместе с побочными продуктами реакции (уксусный ангидрид, муравьиная кислота, вода и др.) отводится на очистку и ректификацию. Смесь паров ацетальдегида, уксусной кислоты и других веществ из верхней части колонны направляется в холодильник — конденсатор, а затем в сепаратор, откуда непрореагировавший ацетальдегид направляется снова в реакционную колонну. А отходящий газ после промывки выпускается в атмосферу.