
- •Промышленный органический синтез
- •1. Сырье промышленности органического синтеза
- •2. Процессы органического синтеза
- •3. Синтез метилового спирта
- •4. Производство этилового спирта
- •5. Производство ацетилена и его переработка
- •6. Производство капролактама
- •6.1. Структурная схема производства капролактама из бензола
- •6.2. Физико-химические основы и технологическая схема
- •7. Производство стирола
- •Производство формальдегида окислительным дегидрированием метанола
- •Производство формальдегида окислением метанола
4. Производство этилового спирта
Этилен СН2=СН2, пропилен СН3-СН=СН2, бутилен СН3-СН2-СН=СН2,
бутадиен (дивинил) СН2=СН-СН=СН2 будучи очень реакционноспособными соединениями играют важную роль в промышленности органического синтеза. Из многочисленных реакций в которые вступают олефины наибольшее практическое значение имеют процессы полимеризации (полиэтилен, полипропилен, полиизобутилен и др.), гидратации (спирты), хлорирования (дихлорэтан, хлористый аллил и т.п.), окисления (окись этилена), оксосинтеза и некоторые другие реакции. Широкое распространение получили процессы гидратации олефиновых углеводородов. Таким способом получаются этиловый, изопропиловый и другие спирты. В настоящее время этиловый спирт по объему производства занимает первое место среди всех других органических продуктов. С каждым годом спирт, поучаемый из пищевого сырья, все более и более заменяется синтетическим, гидролизным и сульфитным. 1 т этилена позволяет сэкономить более 4 т зерна. Синтетический спирт из этилена в несколько раз дешевле пищевого и требует меньших затрат труда. Синтетический спирт широко применяется в различных отраслях промышленности для получения синтетического каучука, целлулоида, ацетальдегида, уксусной кислоты, искусственного шелка, лекарственных соединений, душистых веществ, бездымного пороха, в качестве растворителя и т.п.
Гидратация этилена осуществляется двумя методами: при помощи серной кислоты (сернокислотная гидратация) и непосредственным взаимодействием этилена с водяным паром в присутствии твердых катализаторов (парофазная каталитическая гидратация). Сернокислотный способ, открытый А. М. Бутлеровым, получил промышленное осуществление только в послевоенные годы. Он состоит из следующих четырех стадий: 1) абсорбция этилена серной кислотой с образованием сернокислых эфиров; 2) гидролиз эфиров; 3) выделение спирта и его ректификация; 4) концентрирование серной кислоты. Взаимодействие меду этиленом серной кислотой состоит из двух этапов: первый — физическое растворение этилена в серной кислоте и второй — гомогенное взаимодействие обоих, компонентов (Ж-Ж) с образованием алкилсульфатов по уравнениям:
C2H4 + H2SO4 = C2H5OSO3H (а)
C2H5OSO3H + C2H4 = (C2H5O)2SO2 (б)
Диэтилсульфат в условиях процесса может взаимодействовать с серной кислотой, образуя этилсульфат:
(C2H5O)2SO2 + H2SO4 = 2C2H5OSO3H (в)
Этилен поглощается серной кислотой медленнее, чем другие газообразные олефины (например в сотни раз медленнее, чем изобутилен). По мере образования этилсерной кислоты (этилсульфата), в которой этилен растворяется лучше, скорость поглощения этилена увеличивается. Но в связи с тем, что в то же время уменьшается концентрация серной кислоты, общая скорость реакции снижается. Нужная степень насыщения до 0,6 моля С2Н4 на 1 моль Н2SО4 в верхней части абсорбционной колонны достигается для 97,5% -ной кислоты за 1ч 15 мин, т. е. почти вдвое быстрее, чем для 95% -ной кислоты (2ч 15 мин). Следовательно, целесообразно применять 97-98%-ную кислоту. Оптимальная температура процесса 65-75 °С. С дальнейшим повышением температуры уменьшается количество образующейся этилсерной кислоты. С повышением давления возрастают скорость абсорбции и степень насыщения серной кислоты этиленом. Большое значение для процесса имеет интенсивность перемешивая. В производстве применяют барботажные колонны, обеспечивающие более сильное перемешивание, чем насадочные башни. В ходе второй стадии идет гидролиз этил- и диэтилсульфата по уравнениям:
C2H5OSO3H + Н2О = C2H5OН + H2SO4 (г)
(C2H5O)2SO2 + 2Н2О = 2C2H5OН + H2SO4 (д)
Кроме основных реакций (г) и (д) идет образование диэтилового эфира:
(C2H5O)2SO2 + C2H5OН = C2H5OC2H5 + C2H5OSO3H (е)
(C2H5O)2SO2 + Н2О = C2H5OC2H5 + H2SO4 (ж)
ацетальдегида, а также наблюдается полимеризация этилена. Для уменьшения выхода диэтилового эфир гидролиз ведут по возможности быстрее, сразу же отгоняя образующийся спирт с тем, чтобы его концентрация в растворе была небольшой.
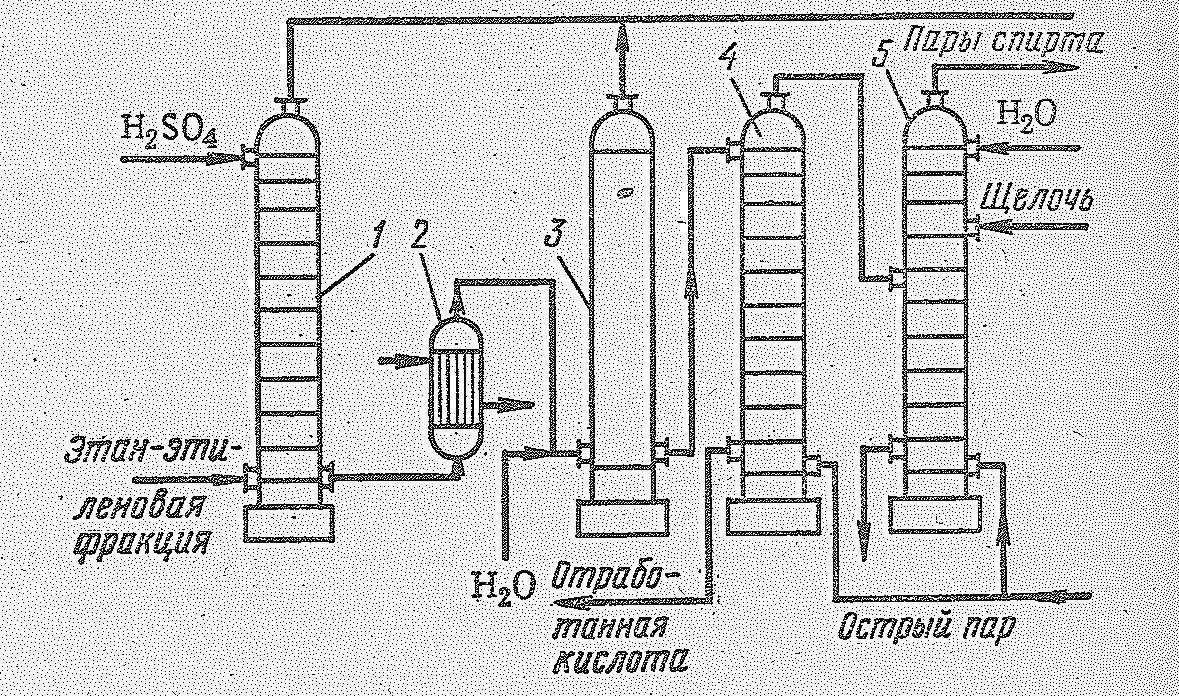
Рис. 14.4. Принципиальная схема производства этилового спирта сернокислотной гидратацией этилена: 1 – абсорбер; 2 – теплообменник; 3 – гидролизер; 4 – отпарная колонна; 5 – нейтрализационная колонна.
Принципиальная технологическая схема производства спирта сернокислотной гидратацей этилена приведена на рис. 14.4. Этиленовая фракция нефтепереработки, содержашая 60-75% этилена, под давлением 20∙105-25∙105 Н/м2 поступает в нижнюю часть тарельчатого абсорбера (около 20 тарелок с колпачками), футерованного кислотоупорными плитками, и барботирует через слой кислоты, имеющейся на каждой тарелке. Концентрированная кислота (97-98%-ная Н2SО4) подается для орошения в верхнюю часть абсорбера. При абсорбции этилена серной кислотой выделяется большое количество тепла (121 кДж на 1 моль этилена), которое непрерывно отводится водяными холодильниками, расположенными над каждой тарелкой таким образом, чтобы температура в абсорбере не превышала 80 °С. Непоглощенные газы, в основном этан и другие примеси, содержащие не более 2-5% этилена, промываются водой и 10%-ным раствором щелочи в специальных скрубберах. Сернокислотный раствор из абсорбера направляется в гидролизер с керамической насадкой, где разбавляется водой (до концентрации 50% Н2SО4). Температура в гидролизере поддерживается, в пределах 100-110 °С и давлении 2∙105-3∙105 Н/м2. Время гидролиза 30 мин. Выделившиеся растворенные газы, содержащие небольшое количество паров диэтилового эфира, выводятся из верхней части гидролизера, промываются и нейтрализуются. В растворе, выходящем из гидролизера, содержатся этиловый спирт, вода, 43-50%-ная серная кислота, диэтиловый эфир, растворенные газы и непрогидролизовавшиеся этилсульфаты. Вся эта смесь поступает в отпарную колонну (1,5∙105 Н/м2, 95-125 °С), где происходит окончаельный гидролиз. Выходящая парогазовая смесь далее направляется на промывку, нейтрализацию и конденсацию. Полученный спирт-сырец поступает затем на ректификацию. Слабая серная кислота отводится на очистку от смолистых примесей и после концентрирования и добавки олеума снова подается в абсорбер.
Для получения 1 т спирта на абсорбцию идет около 2 т концентрированной серной кислоты, а затем приходится упаривать уже 4 т кислоты. Такой кислотооборот осложняет производство в вызывает значительные трудности из-за сильной коррозии и тяжелых условий труда. По сернокислотному методу из 1 т этилена вырабатывается 1,2 т спирта-ректификата и около 100 кг этилового эфира. Превращение этилена в спирт достигает 90%.
В настоящее время всё большее распространение получает более совершенный метод - парофазная каталитическая гидратация, осуществляемая по циклической схеме. Процесс гидратации — экзотермическая равновесная реакция:
С2Н4 + Н2О = C2H5OН + 45,6 кДж
Как следует из уравнения реакции в термодинамических данных, чтобы равновесие сдвинуть в сторону гидратации этилена, необходимо понижение температуры и повышение давления, однако при температуре ниже 280 °С скорость гидратации очень мала, а применение давления свыше 80∙105 Н/м2 экономически не рентабельно.
В качестве катализатора используется фосфорная кислота, нанесенная на широкопористые носители: кизельгур, силикагель, алюмосиликат. Носители, обладающие широкими порами, облегчают протекание диффузии реагентов внутрь зерен пористого катализатора. Так как данный кислотногетерогенный катализ осуществляется свободной кислотой, находящейся в виде жидкой пленки (абсорбирующей пары воды из газовой фазы) на поверхности носителя, то активность катализатора зависит от концентрации кислоты, которая в свою очередь зависит от парциального давления паров воды. В результате обширных исследований и промышленных испытаний установлены основные условия взаимодействия газообразного этилена и водяных паров: 1) температура 280-290 оС; 2) давление 70∙105-80∙105 Н/м2 3) концентрация этилена в циркулирующем газе 80-85 об. %; 4) молярное отношение воды к этилену 0,6-0,75 : 1 и 5) концентрация фосфорной кислоты на поверхности катализатора не ниже 83%; 6) объемная скорость 1800—2500 ч-1. Перечисленные условия позволяют получать водноспиртовой раствор концентрацией спирта 15—16% при конверсии этилена за один проход 4-5%. Полезное использование этилена составляет 95%. Остальные 5% этилена расходуются на получение диэтилового эфира (2%), ацетальдегида (1%) димеров и полимеров (2%).
Технологическая схема прямой гидратации этилена (рис. 14.5) состоит из нескольких непрерывно протекающих операций: 1) приготовления исходной парогазовой смеси, 2) гидратации этилена, 3) нейтрализации паров продуктов, образующихся в результате реакции, 4) рекуперации тепла рециркулирующих потоков и 5) очистки циркулирующего газа.
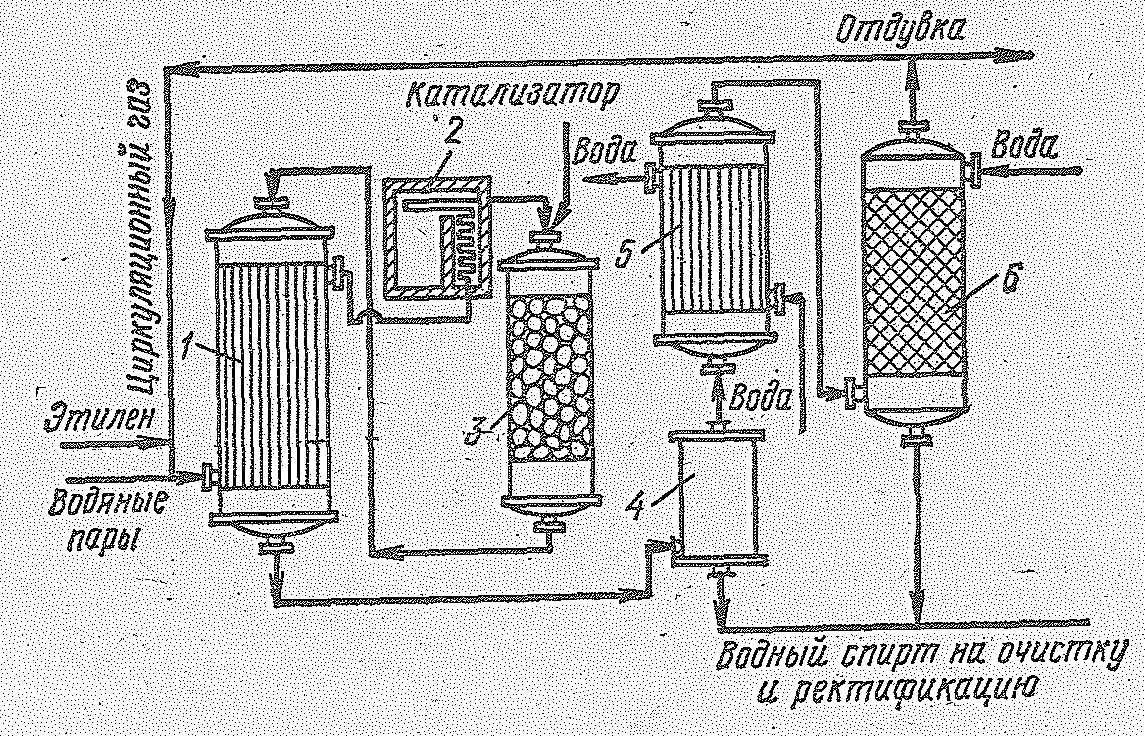
Рис. 14.5. Принципиальная схема установки для производства этилового спирта каталитической гидратацией этилена в паровой фазе: 1 — трубчатый теплообменник 2 — печь; 3 — реактор; 4 — сборник; 5 — холодильник; 6 — промывная колонна с насадкой.
Гидратация этилена проводится в контактном аппарате, который для защиты от коррозии выкладывается красной медью. Этилен, сжатый компрессором, смешивается с водяными парами и вся смесь направляется в теплообменник и затем в печь, откуда парогазовая смесь при 280 °С поступает в гидрататор, который заполнен твердым катализатором на высоту 8,5 м. Время контакта 18-20 с. Необходимую для процесса температуру исходной смеси можно получить смешением этилена с перегретым паром высокого давления (около 70∙105 Н/м2). По режиму работы гидрататор приближается к адиабатическому реактору идеального вытеснения.
Образовавшаяся в результате реакции смесь продуктов последовательно отдает тепло в теплообменнике, конденсируется водный раствор спирта в емкости и затем окончательно охлаждается в холодильнике. Полная отмывка газа от паров спирта идет в скруббере. Непрореагировавший этилен после сжатия вновь направляется в гидрататор, а спирт-сырец подвергается ректификации. На 1 т этилового спирта расходуется 0,685 т этилена, 5,6 кг фосфорной кислоты, 2 кг носителя и 16 кг едкого натра. Срок службы катализатора равен примерно 600 ч. Введением распыленной фосфорной кислоты в реактор в ходе процесса можно продлить службу катализатора, после чего его нужно заменять, так как на поверхности осаждаются смолистые соединения. Парофазная каталитическая гидратация этилена является более перспективной, чем сернокислотная.
Для производства синтетических каучуков применяют соединения с сопряженной системой двойных связей: дивинил (бутадиен-1,3), изопрен, хлоропрен и с одной двойной связью: изобутилен, стирол, -метилстирол, нитрил акриловой кислоты и др. Большинство из этих соединений образуется дегидрированием соответствующих углеводородов, содержащихся в промышленных нефтяных газах, попутных газах, газовом бензине, некоторых фракциях переработки нефти, а также синтетически. (например, этилбензол и изопропилбензол). Получение. дивинила осуществляется контактным разложением этилового спирта, а также дегидрированием бутана и бутиленов в одну или две стадии. Получение дивинила из спирта по способу, разработанному С. В. Лебедевым, является примером каталитического обратимого эндотермического процесса широко применяемого в промышленности.
