
- •3. Производство серной кислоты
- •3.1. Области применения серной кислоты
- •3.2. Сырьё.
- •3.3. Производство серной кислоты
- •3.3.1. Химическая схема производства серной кислоты из железного колчедана
- •3.3.2. Принципиальная схема производства серной кислоты
- •3.2.3. Получение обжигового газа из колчедана
- •3.4. Общая и специальная очистка обжигового газа.
- •Контактное окисление оксида серы (IV)
- •3.5.2. Поглощение оксида серы (VI)
- •3.6. Получение серной кислоты серы путём сжигания серы
- •Совершенствование сернокислотного производства
Лекция 3
3. Производство серной кислоты
В технике под серной кислотой понимают любые смеси триоксида серы с водой, собственно безводную серную кислоту Н2SO4 называют моногидратом, раствор SO3 в 100 % H2SO4 называют олеумом.
Физические свойства. Безводная серная кислота (моногидрат) – бесцветная маслянистая жидкость с Ткр = 10,37 ºС, Тк = 296,2 ºС, ρ = 1,85 г/см3, не дымит, не имеет цвета и запаха, смешивается с водой и серным ангидридом в любых соотношениях. При смешении образуется ряд соединений с различными температурами кристаллизации.
Товарные сорта серной кислоты
Современная промышленность выпускает несколько товарных сортов серной кислоты и олеум, отличающихся концентрацией и чистотой:
Сорт кислоты Содер-е Содер-е tкристалл. ºС
H2SO4% SO3%
Купоросное масло 92-93% 0,0 -22,0
Башенная кислота 75-76% 0,0 -29,5 (нитрозный способ)
Контактная кислота 92,5-94% 0,0 -22,0
Олеум 104,5% 20% +2,0
Высокопроцентный
олеум 114% 65% -0,35
Эти составы сортов товарной серной кислоты выделены как обладающие наименьшими температурами кристаллизации, это сделано для того, чтобы избежать кристаллизации серной кислоты при ее перевозке и хранении.
Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место: мировое производство серной кислоты составляет в настоящее время 160 млн. тонн в год.
Концентрированная серная кислота не разрушает черные металлы. В то же время, серная кислота относится к числу самых сильных минеральных кислот.
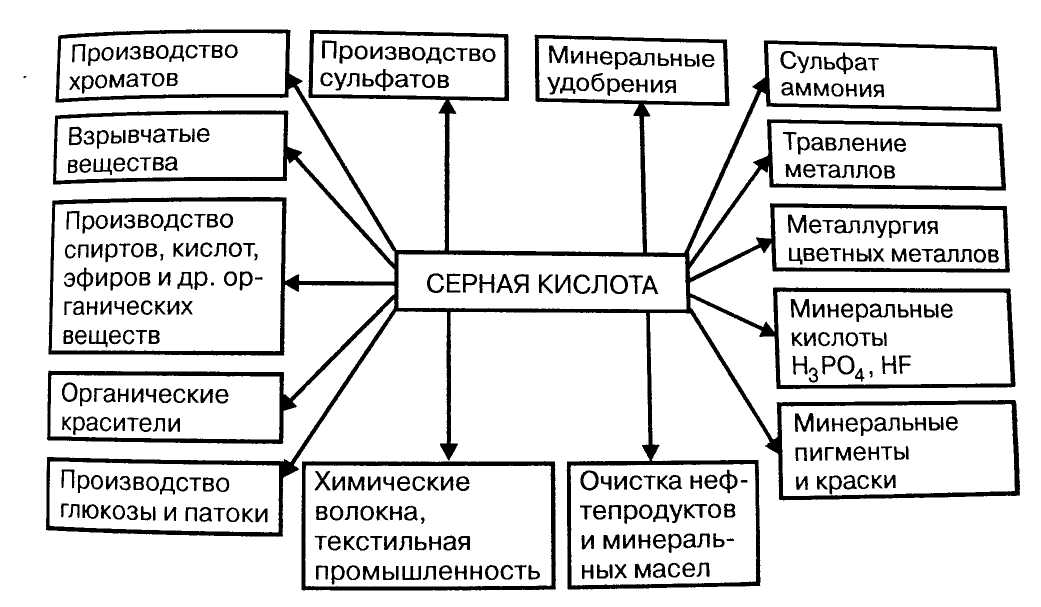
3.1. Области применения серной кислоты
1) Серная кислота широко используется в производстве фосфорных минеральных удобрений, различных солей и кислот. На производство минеральных удобрений расходуется до 50% всей вырабатываемой серной кислоты.
2) Большое количество (до 10%) серной кислоты используют для очистки нефтепродуктов и цветных металлов.
3) В металлообрабатывающей промышленности серную кислоту используют для снятия ржавчины с поверхности чёрных металлов перед защитным покрытием их лаками и цветными металлами.
4) Разбавленную серную кислоту и её соли применяют при производстве красителей (до 15%), лаков; лекарственных, моющих и взрывчатых веществ, в текстильной промышленности и производстве химических волокон.
5) В качестве катализатора в гидролизном производстве
6) Водоотнимающее вещество при осушке газов
Сырье для производства серной кислоты.
Историческая справка. До середины XVIII века серную кислоту в незначительных количествах получали термическим разложением железного купороса FeSO4∙7Н2О, поэтому и сейчас один из сортов серной кислоты называется купоросным маслом.
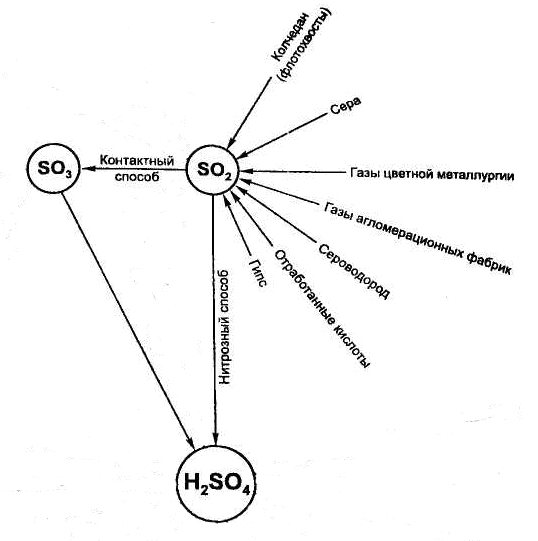
В настоящее время серная кислота производится двумя способами:
1) нитрозным (башенным), существующем более 200 лет,
2) контактным, освоенным в промышленности в конце ХIХ и начале ХХ века.
Контактный способ является более эффективным, что и послужило причиной вытеснения нитрозного способа из промышленности.
3.2. Сырьё.
Сырьё. Сырьём для производства серной кислоты могут быть свободная сера, и различные серосодержащие соединения (рисунок).
Из них в дальнейшем после обработки могут быть получены сера или непосредственно оксид серы (IV). Природные залежи самородной серы невелики. Чаще всего сера находится в природе в сульфидов и сульфатов металлов, а также входит в состав нефти, каменного угля, природных и попутных газов. Значительные количества серы содержатся в виде оксида веры в топочных газах цветной металлургии и в виде сероводорода, выделяющихся при очистке горючих газов.
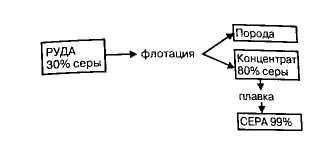
1) Железный колчедан. Наиболее распространённым сульфидом серы является пирит или железный колчедан. Природный железный колчедан представляет собой сложную породу, состоящую из сульфида железа и сульфидов других металлов (меди, цинка, свинца, кобальта, никеля). Содержание серы в колчедане колеблется от 35 до 50%. Процесс подготовки рядового колчедана к производству ставит целью извлечение из него ценных цветных металлов и повышение концентрации дисульфида железа. Схема подготовки рядового колчедана представлена на рисунке
Перед использованием железного колчедана для производства серной кислоты его подвергают обработке методом флотации с целью извлечения из него ценных металлов и повышения концентрации сульфида железа. Железный колчедан поступает на заводы по производству серной кислоты в виде порошка - флотационного колчедана.
Необходимо подчеркнуть, что при переработке сульфидов цветных металлов образуется большое количество оксида серы (IV) (до 10%), который можно непосредственно использовать для производства серной кислоты.

2)
Свободная сера
(S)
является самым совершенным сырьём для
производства серной кислоты. Сера легко
сгорает в токе воздуха без образования
отходов и побочных продуктов. Элементарная
сера может быть получена из серных руд
или газов, содержащих сероводород или
оксид серы (IV). В соответствии с этим
различают серу
самородную
и серу газовую (комовую).
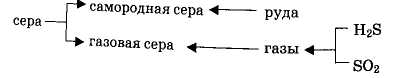
Источником газовой серы являются газо-конденсатные месторождения и месторождения попутного газа.
Из самородных руд серу выплавляют в печах, автоклавах или непосредственно в подземных залежах (метод Фраша). Для этого серу расплавляют непосредственно под землей, нагнетая в скважину перегретую воду, и выдавливают расплавленную серу на поверхность сжатым воздухом.
На рисунке представлены схема подготовки самородной серы.
Получение газовой серы из сероводорода, извлекаемого при очистке горючих и технологических газов, основано на процессе неполного окисления его над твердым катализатором. При этом протекают реакции:
H2S + 1,5О2 = SO2 + Н2О
2H2S + SO2 = 2H2O + 3S
2H2S + O2 = 2H2O + 2S.
Значительные количества серы могут быть получены из продуктов медеплавильного производства, содержащих различные соединения серы, в частности, пирит. При этом, в процессе плавки протекают реакции, приводящие к образованию элементарной серы:
2FeS2 = 2FeS + 2S, (4FeS + 7О2 = 2Fe2О3 + 4SО2↑ + Q)
SO2 + С = S + СО2,
CS2 + SO2 = 3S + CO2,
2COS + SO2 = 3S + 2CO2.
3) Сероводород. При переработке нефтепродуктов в качестве побочного продукта образуется сероводород. Источником сероводорода служат и другие горючие газы: коксовый, генераторный, попутный. Сероводород улавливают, концентрируют, а затем сжигают и получают оксид серы (IV), перерабатываемый в дальнейшем в серную кислоту.
