
- •Введение
- •Литературный обзор
- •Экспериментальная часть Исходные реагенты, аппаратура и методы измерений
- •1.Синтез Na2[RuNo(no2)4oh]*2h2o.
- •3.Синтез гран-Na[Ru(nh3)3(no2)3]*2h2o.
- •4. Синтез гран-[RuNo(nh3)3Cl2]Cl.
- •5. Взаимодействие гран-[RuNo(nh3)3Cl2]Cl с NaNo2.
- •Результаты и обсуждение
- •Основные результаты и выводы
- •Список литературы
Новосибирский Национальный Исследовательский Государственный Университет
Кафедра Общей Химии
Курсовая работа по неорганической химии
Синтез гран-триамминонитрозокомплекса рутения
студента I курса 12402 группы ФЕН НГУ
Кормушиной Юлии Олеговны
Научный руководитель:
кандидат химических наук,
доцент Емельянов В.А.
Новосибирск, 2013 г.
Оглавление
Введение.........................................................................................3
Литературный обзор......................................................................4
Экспериментальная часть..............................................................7
Результаты и обсуждение...............................................................9
Основные результаты и выводы....................................................13
Список литературы.........................................................................14
Введение
Яркой особенностью координационной химии рутения является способность к образованию нитрозокомплексов при взаимодействии самых разнообразных солей рутения с рядом азотсодержащих реагентов. Группировка (RuNO)3+, степень окисления металла в которой принята равной +2, может входить в состав как катионных, так и анионных октаэдрических комплексов. Эта группировка обладает высокой устойчивостью к различным химическим воздействиям и может быть разрушена только в очень жестких условиях. Такая повышенная стабильность определяет неизменный интерес исследователей всего мира к этим соединениям на протяжении всего прошлого столетия и в настоящее время.
Новые направления в химии нитрозокомплексов рутения обусловлены двумя открытиями, датированными последним десятилетием XX века. Первое – это участие оксида азота(II) и соединений, его содержащих, во многих физиологических процессах. Исследования биологической активности некоторых комплексов нитрозорутения показали, что препараты на их основе оказались менее токсичными и более эффективными, чем используемые в настоящее время в медицинской практике [1, 2].
Другое активно развивающееся в настоящее время направление в химии нитрозокомплексов связано с наличием двух донорных атомов в молекуле монооксида азота. В стабильном состоянии эта молекула координирована к переходному металлу атомом азота. При облучении исходного нитрозокомплекса жестким лазерным излучением способ координации NO меняется. Способность нитрозокомплексов к обратимому фотоиндуцированному переходу в долгоживущее метастабильное состояние открывает перспективу для синтеза гибридных материалов, сочетающих в одной кристаллической решетке два или более физических свойства, таких как проводимость, магнетизм, особые оптические свойства и т.д. Объекты, в которых магнитные свойства могут обратимо меняться под действием света, представляют большой научный и практический интерес, в частности, в качестве материалов для записи информации. Комбинация этих свойств в одной кристаллической решетке и их синергизм могут привести к новым физическим явлениям и новым приложениям в молекулярной электронике [3].
Среди огромного разнообразия нитрозокомплексов рутения особый интерес представляют амминокомплексы, как наиболее устойчивые и наименее токсичные. Перспектива масштабного применения таких комплексов в качестве биологически активных препаратов и предшественников для получения полифункциональных фотомагнитных материалов и порошков металлических сплавов требует от исследователей разработки методов синтеза этих соединений с высокими выходами и подробного изучения их свойств.
Литературный обзор
В настоящее время в литературе описаны пять нитрозокомплексов триамминового ряда. Первый комплекс состава [Ru(NO)(NH3)3Cl2]Cl H2O синтезирован по следующей методике [4]. Раствор Na2[Ru(NO)(NO2)4OH] 2H2O нагревали с концентрированным раствором NH3 в течение 3-5 ч, после чего к полученной смеси добавляли концентрированную соляную кислоту и выпаривали досуха. Авторы отмечают, что такая процедура приводит к образованию смеси комплексов гран‑[Ru(NO)(NH3)2Cl3], [Ru(NO)(NH3)3Cl2]Cl H2O и [Ru(NO)(NH3)3Cl(H2O)]Cl2. Реакционную массу растворяли в воде и отделяли труднорастворимый гран‑[Ru(NO)(NH3)2Cl3], а оставшийся маточный раствор, содержащий [Ru(NO)(NH3)3Cl2]Cl и [Ru(NO)(NH3)3Cl(H2O)]Cl2, испаряли досуха. Сухой остаток помещали в кварцевую лодочку и выдерживали при 215 С в атмосфере азота, полученный продукт перекристаллизовывали из 1 М HCl.
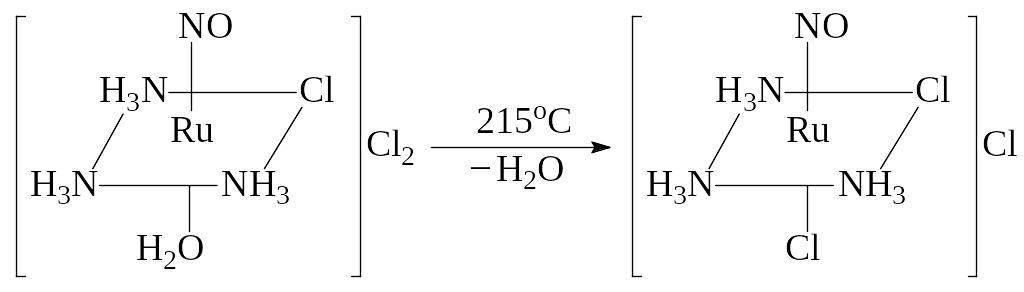
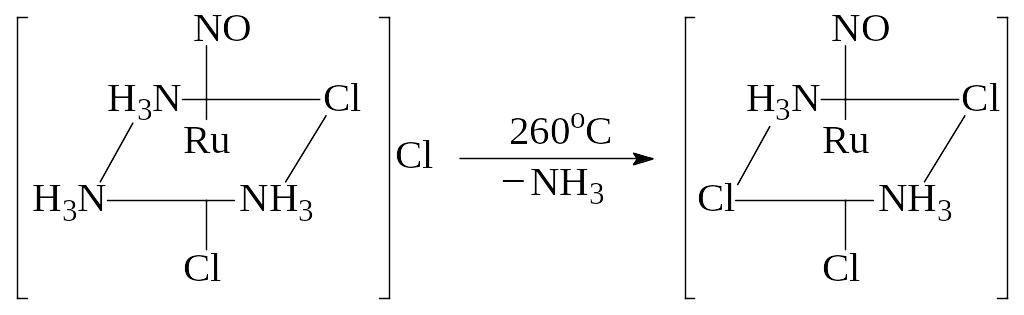
Дальнейшее нагревание полученного комплекса (до 260 С) приводит к потере одной молекулы аммиака и образованию ос‑[Ru(NO)(NH3)2Cl3]:
 .
.
По мнению авторов, образующийся комплекс должен иметь транс‑конфигурацию, что обусловлено большим транс‑влиянием хлора по сравнению с аммиаком. За счет этого молекула аммиака на координате ClRuNH3 должна быть менее прочно связанной, чем на координате H3NRuNH3, и при нагревании отщепляться в первую очередь.
Для полученного [Ru(NO)(NH3)3Cl2]Cl H2O был сделан элементный анализ на металл, азот и галоген, результаты которого хорошо согласуются с вычисленным содержанием элементов для данного состава. Результаты измерения молярной электропроводности раствора этого соединения показали, что оно является двухионным электролитом. В электронном спектре поглощения раствора хлорида дихлоротриамминнитрозорутения наблюдаются 3 полосы поглощения: 1 = 242 ( = 2950), 2 = 343 ( = 80) и 3 = 242 нм ( = 120 л/моль·см). Авторы обращают внимание на расщепление полос (RuNH3) и (NH3) в ИК‑спектре полученного соединения, что они объясняют неравноценностью координат H3NRuNH3 и ClRuNH3, однако подробного описания спектра не приводят.
Второй комплекс
нитрозорутения триамминового ряда
[Ru(NO)(NH3)3(H2O)Cl]Cl2
(в транс‑положении
к NO
находится молекула Н2О)
о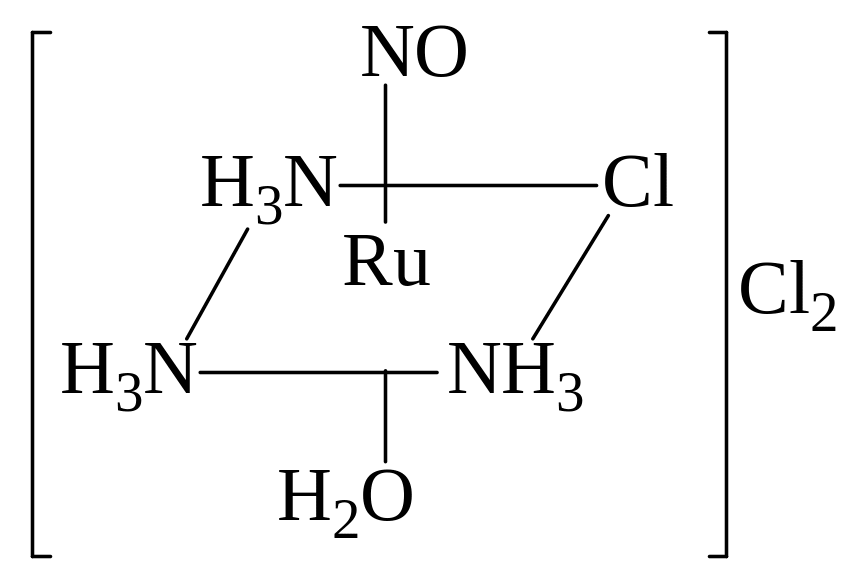 писан
в работе [5].
Водный раствор (NH4)2[Ru(NO)Cl5]
нагревали с концентрированным раствором
NH3
на водяной бане в течение 15‑20 мин.
Затем раствор упаривали до минимального
объема, охлаждали и отделяли осадок
транс‑[Ru(NO)(NH3)4OH]Cl2.
К маточному раствору добавляли
концентрированную соляную кислоту и
отфильтровывали осадок [Ru(NO)(NH3)3Cl(H2O)]Cl2,
выход которого составлял ~ 45 %.
Выделенный продукт исследован методами
ИК‑спектроскопии, рентгенофазового
и рентгеноструктурного анализа (пр. гр.
Pna21;
а = 13,151(2),
b = 6,852(1),
c = 10,361(1)
Å; Z = 4).
Авторы отмечают, что попытка получения
соединения состава [Ru(NO)(NH3)3Cl2]Cl
обработкой полученного аквакомплекса
[Ru(NO)(NH3)3Cl(H2O)]Cl2
концентрированной соляной кислотой
при нагревании в течение получаса не
увенчалась успехом.
писан
в работе [5].
Водный раствор (NH4)2[Ru(NO)Cl5]
нагревали с концентрированным раствором
NH3
на водяной бане в течение 15‑20 мин.
Затем раствор упаривали до минимального
объема, охлаждали и отделяли осадок
транс‑[Ru(NO)(NH3)4OH]Cl2.
К маточному раствору добавляли
концентрированную соляную кислоту и
отфильтровывали осадок [Ru(NO)(NH3)3Cl(H2O)]Cl2,
выход которого составлял ~ 45 %.
Выделенный продукт исследован методами
ИК‑спектроскопии, рентгенофазового
и рентгеноструктурного анализа (пр. гр.
Pna21;
а = 13,151(2),
b = 6,852(1),
c = 10,361(1)
Å; Z = 4).
Авторы отмечают, что попытка получения
соединения состава [Ru(NO)(NH3)3Cl2]Cl
обработкой полученного аквакомплекса
[Ru(NO)(NH3)3Cl(H2O)]Cl2
концентрированной соляной кислотой
при нагревании в течение получаса не
увенчалась успехом.
В работе [6] предложены два метода получения нитротриамминокомплекса [RuNO(NH3)3(NO2)(ОH)]Cl 0,5H2O. Первая методика использует последовательное замещение координированных нитрогрупп в тетранитрокомплексе. Навеску Na2[Ru(NO)(NO2)4OH] 2H2O растворяли в концентрированном растворе аммиака, добавляли NH4Cl и нагревали в течение 3 ч. Полученный раствор охлаждали, отфильтровывали малорастворимый [Ru(NO)(NH3)2(NO2)2OH]. После упаривания оставшегося маточного раствора до минимального объема выделяли целевой [RuNO(NH3)3(NO2)(ОH)]Cl 0,5H2O (выход 20-30 %).
Второй метод синтеза этого нитротриамминокомплекса сводился к нитрованию хлороакватриаммина, сопровождающемуся отщеплением протона от координированной молекулы воды. К водному раствору [RuNO(NH3)3(H2O)Cl]Cl2 добавляли NaNO2 и нагревали в течение 1 ч. Маточный раствор упаривали до минимального объема и отфильтровывали [RuNO(NH3)3(NO2)(ОH)]Cl 0,5H2O. Для очистки комплекс переосаждали из водного раствора спиртом. Выход целевого продукта составил 50-60 %.
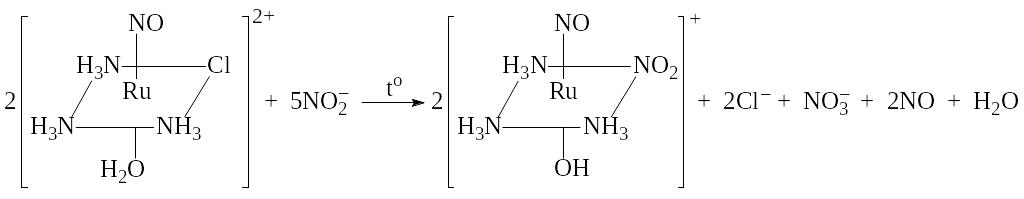
Полученный
[RuNO(NH3)3(NO2)(ОH)]Cl 0,5H2O
исследован методами ИК‑спектроскопии,
рентгенофазового и рентгеноструктурного
анализа (пр. гр.
![]() ;
а = 6,5752(7),
b = 11,0900(18),
c = 12,296(2)
Å; = 79,692(13),
= 85,088(11),
= 87,395(11);
Z = 4).
;
а = 6,5752(7),
b = 11,0900(18),
c = 12,296(2)
Å; = 79,692(13),
= 85,088(11),
= 87,395(11);
Z = 4).
Четвертым триамминонитрозокомплексом рутения является [RuNO(NH3)3(H2O)Cl](NO3)2 [7]. Получить данный комплекс можно взаимодействием [RuNO(NH3)3(NO2)OH]Cl*0,5H2O с 3 M HNO3 при нагревании на водяной бане с выходом 60-65%:
3[RuNO(NH3)3(NO2)OH]Cl + 5HNO3 = 3[RuNO(NH3)3(H2O)Cl](NO3)2 + 2NO↑ + H2O
Одним из важнейших результатов работы является вывод о том, что наличие хлорид-ионов в разбавленных азотнокислых растворах нитрозокомплексов рутения препятствует координации нитрит-иона и приводит к образованию нитрозохлорокомплексов рутения. Другим способом получения [RuNO(NH3)3(H2O)Cl](NO3)2 является обмен внешнесферными анионами при взаимодействии [RuNO(NH3)3(H2O)Cl]Cl2 с 8 М HNO3 при комнатной температуре:
[RuNO(NH3)3(H2O)Cl]Cl2 + 2HNO3 = [RuNO(NH3)3(H2O)Cl](NO3)2 + 2HCl
Пятым триамминонитрозокомплексом рутения является гран-[RuNO(NH3)3Cl2]Cl [8], получаемый по следущей методике: навеску KNa3[Ru(NO2)6] растворили в концентрированном аммиаке. Из полученного раствора с небольшим выходом были выделены оранжевые кристаллы гран-Na[Ru(NH3)3(NO2)3]*3H2O:
KNa3[Ru(NO2)6] + 3NH3 = гран-Na[Ru(NH3)3(NO2)3] + 2NaNO2 + KNO2.
Полученные кристаллы затем обрабатывали соляной кислотой, в результате чего получилось незначительное количество гран-[RuNO(NH3)3Cl2]Cl:
3Na[Ru(NH3)3(NO2)3] + 10HCl = 3[RuNO(NH3)3Cl2]Cl + NaCl + 5H2O + 4NO↑ + 2NaNO3.
