
- •Определение содержания никеля в черных сплавах фотоколориметрическим методом
- •Рецензент
- •Молекулярно-абсорбционный метод анализа
- •Закон поглощения света
- •Устройство фотоколориметра
- •Подготовка к работе
- •Порядок работы на фотоколориметре кфк-2мп
- •При повторении опыта необходимо:
- •Определение никеля в черных сплавах
- •Определение никеля фотоколориметрическим методом (с диметилглиоксимом в присутствии окислителя)
- •Расчет относительной ошибки точности измерения по формуле:
- •Техника безопасности
- •654007, Г. Новокузнецк, ул. Кирова, 42
Определение никеля в черных сплавах
Никель в чугуне и стали находится, главным образом, в виде компонента твердого раствора. При растворении в кислотах он переходит в раствор в виде двухвалентного иона:
Ni + 4HNO3 Ni(NO3)2 + 2NO2 + 2H2O
Из существующих способов определения наиболее распространены весовой (для больших количеств) и фотоколориметрический (для малых количеств).
Определение никеля фотоколориметрическим методом (с диметилглиоксимом в присутствии окислителя)
Сущность метода. Метод основан на том, что ионы двухвалентного никеля, полученные в результате растворения навески стали в кислоте, образуют с диметилглиоксимом в присутствии сильных окислителей растворимый комплекс красного цвета – соединение никеля с продуктом окисления диметиглиоксима. Реакцию проводят в щелочной среде, поэтому для предупреждения осаждения щелочью гидроксидов железа, марганца алюминия и других элементов, входящих в состав пробы, прибавляют комплексообразователь – сегнетову соль или винную кислоту, в присутствии которых перечисленные компоненты не осаждаются.
 CH3C=NOH
CH3C=NOH
NiCl2+2 +2NH4OH→
CH3C=NOH
C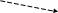
 H3C=NOH
ОN=C
H3C
H3C=NOH
ОN=C
H3C
→
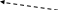 Ni
+ 2NH4Cl
+ 2Н2О
Ni
+ 2NH4Cl
+ 2Н2О
CH3C=NO ОN=C H3C
В связи с тем, что в образовании комплекса участвуют не прочные продукты взаимодействия, порядок сливания реактивов и их соотношение имеют существенное значение. Окраска комплекса развивается через 5-7 минут и устойчива в течение примерно 20 мин, после чего комплекс постепенно разрушается. Интенсивность окраски полученного комплекса пропорциональна содержанию никеля, поэтому фотометрируя окрашенный раствор, можно определить содержание никеля в анализируемом образце.
Ход анализа. Навеску стали 0,1 г помещают в коническую колбу на 100 мл и растворяют при нагревании в 10 мл азотной кислоты (1:3), затем разбавляют небольшим количеством воды (5-10 мл). Полученный раствор переводят в мерную колбу на 100 мл, тщательно ополаскивая колбочку, в которой велось растворение, небольшими порциями дистиллированной воды (4-5 раз). Доводят содержимое мерной колбы водой до метки. Если выпадает осадок графита при растворении, содержимое мерной колбы отфильтровывают. Полученный раствор в мерной колбе тщательно перемешивают.
Подготовка к колориметрированию. Одновременно готовят два раствора в мерных колбах на 50 мл, один будет называться рабочим, другой – холостым.
Из мерной колбы на 100 мл, отбирают пипеткой аликвотную часть раствора по 5 мл в две колбы на 50 мл. В каждую прибавляют 10 мл 20% сегнетовой соли, 10 мл 5% раствора щелочи, хорошо взбалтывают, при этом раствор должен обесцветиться (допускается слабо-желтая окраска, которая не будет мешать при дальнейшем колориметрировании). Затем прибавляют 10 мл 3% раствора персульфата аммония ((NH4)2S2O8), взбалтывают. В одну из колб прибавляют 10 мл щелочного раствора диметиглиоксима (это будет рабочий раствор). Обе колбы доводят до метки 5% раствором щелочи и тщательно перемешивают. На фотоколориметре измеряют оптическую плотность раствора D, как указанно в разделе «Порядок работы на фотоколориметре КФК – 2МП».
