
- •1. Основные понятия и стехиометрические законы химии
- •2 Эквивалентная масса (молярная масса эквивалента вещества)
- •3 Первый закон термодинамики
- •5 Понятие энтропии
- •6 Понятие об энергии Гиббса. Ее изменение в химических процессах.
- •7 Скорость химической реакции. Факторы влияющ. На скор. Хим. Реакции.
- •8 Равновесие в химических реакциях. Принцип Ле-Шателье.
- •9 Теория электролитической диссоциации
- •10 Теория электролитической диссоциации
- •11 Окислительно-восстановительные процессы. Понятие о степени окисления.
- •12 Классификация окислительно–восстановительных реакций. Пример
- •13 Квантово-механическая модель строения атома. Квантовые числа и их физический смысл. Атомные орбитали.
- •14 Типы химических связей
- •15 Ковалентная связь
- •16 Сигма, пи и дельта сязь.
- •17 Ионная связь. Направленность и ненасыщенность ионной связи.
- •18 Металлическая связь и ее характерные особенности.
- •19 Водородная связь. Межмолекулярная и внутримолекулярная связь: длина и энергия водородной связи. Влияние водородной связи на свойства вещества.
- •20 Комплексные соединения, их образование и строение. Внутренняя и внешняя сфера комплексного соединения, комплексообразователь и его коронационное число, лиганды.
- •21 Номенклатура комплексных соединений. Катионные, анионные и нейтральные комплексы.
- •22 Теория строения органических веществ а.М. Бутлерова
- •23 Изомерия. Виды.
- •24 Предельные ув: общая характеристика, строение.
- •25 Химические свойства предельных ув.
- •26 Этиленовые ув : общая характеристика, свойства.
- •28 Правило Марковникова. Эффект Хараша.
- •29 Полимеризация алкенов.
- •30 Озонолиз этиленовых ув.
- •31 Ацетиленовые ув: общая характеристика, строение.
- •32 Реакция Кучерова для ацетиленовых ув.
- •33 Реакции присоединения ацетиленовых ув: гидрирование, галогенирование, галогеноводородом, гидратация.
- •34 Особенности ароматических ув. Правило Хюккеля.
- •35 Реакции замещения ароматических ув.
- •36 Механизм реакции замещения ароматических ув.
- •37 Реакции присоединения ароматических ув.
- •38 Ориентанты первого и второго рода. Примеры.
6 Понятие об энергии Гиббса. Ее изменение в химических процессах.
Энергия Гиббса (изобарно-изотермический потенциал). Во многих случаях самопроизвольные процессы (процессы, происходящие без подвода энергии от внешнего источника) в природе протекают при наличии разности потенциалов, например, разность электрических потенциалов, обусловливает перенос заряда, а разность гравитационных потенциалов – падение тела. Эти процессы заканчиваются при достижении минимума потенциала. Движущей силой химических процессов, протекающих при постоянных давлении и температуре является изобарно-изотермический потенциал, называемый в настоящее время энергией Гиббса и обозначаемый G. Изменение энергии Гиббса в химическом процессе определяется соотношением
ΔG = ΔH –TΔS, (2.16)
где ΔG – изменение энергии Гиббса химического процесса; ΔH – изменение энтальпии химического процесса; ΔS – изменение энтропии химического процесса; Т – температура в Кельвинах.
Уравнение (2.16) может быть представлено в следующем виде: ΔH = ΔG + TΔS. (2.17)
Смысл уравнения (2.17) в том, что часть теплового эффекта реакции расходуется на совершение работы (ΔG), а часть рассеивается в окружающую среду (TΔS).
Энергия Гиббса является критерием принципиальной возможности самопроизвольного протекания реакции. Если в ходе реакции энергия Гиббса уменьшается, то процесс может протекать в данных условиях самопроизвольно ΔG < 0. Процесс в данных условиях неосуществим, если ΔG > 0. Реакция является обратимой, т.е. может протекать и в прямом и в обратном направлении, если ΔG = 0 (термодинамическое условие химического равновесия).
Эти соотношения применимы также к фазовым равновесиям, т.е. случаям, когда в равновесии находятся две фазы (агрегатных состояния) одного и того же вещества, например, лед и жидкая вода.
Энтальпийный и энтропийный факторы. Процессы могут протекать самопроизвольно (ΔG<0), если они сопровождаются уменьшением энтальпии (ΔH<0) и увеличением энтропии системы (ΔS>0). Если же энтальпия системы увеличивается (ΔH>0), а энтропия уменьшается (ΔS<0), то такой процесс протекать не может (ΔG>0). При иных знаках ΔS и ΔН принципиальная возможность протекания процесса определяется соотношением энтальпийного (ΔH) и энтропийного (ТΔS) факторов.
Если ΔН>0 и ΔS>0, т.е. энтальпийная составляющая противодействует, а энтропийная благоприятствует протеканию процесса, то реакция может протекать самопроизвольно за счет энтропийной составляющей, при условии, что |ΔH|<|TΔS|.
Если, энтальпийная составляющая благоприятствует, а энтропийная противодействует протеканию процесса, то реакция может протекать самопроизвольно за счет энтальпийной составляющей, при условии, что |ΔH|>|TΔS|.
Влияние температуры на направление реакции. Изменение знака энергии Гиббса произойдет при
![]() (2.21)
(2.21)
Очевидно, что смена знака энергии Гиббса с изменением температуры возможна только в двух случаях: 1) ΔН>0 и ΔS>0 и 2) ΔН<0 и ΔS<0.
Стандартная
энергия Гиббса образования - ![]() это
изменение энергии Гиббса реакции
образования 1 моль соединения из простых
веществ, устойчивых при стандартных
условиях. Энергия
Гиббса образования простых веществ
принимается равной нулю. Стандартные
энергии Гиббса образования веществ
можно найти в соответствующих справочниках.
это
изменение энергии Гиббса реакции
образования 1 моль соединения из простых
веществ, устойчивых при стандартных
условиях. Энергия
Гиббса образования простых веществ
принимается равной нулю. Стандартные
энергии Гиббса образования веществ
можно найти в соответствующих справочниках.
Энергия Гиббса химической реакции. Энергия Гиббса является функцией состояния, т.е. ее изменение в процессе не зависит от пути его протекания, а определяется исходным и конечным состоянием системы. Следовательно, энергию Гиббса химической реакции (2.10) можно рассчитать по формуле
![]()
Если условия отличаются от стандартных, то для нахождения ΔrG может быть использовано уравнение изотермы Вант-Гоффа, которое для реакции (2.11) между газами записывается как
![]()
а между растворенными веществами -
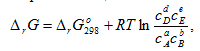 (2.24)
(2.24)
где ![]() _ относительные парциальные
давления соответствующих веществ; сА,
сВ,
сD, cE _ концентрации
соответствующих растворенных веществ,
а, b, c, d – соответствующие
стехиометрические коэффициенты.
_ относительные парциальные
давления соответствующих веществ; сА,
сВ,
сD, cE _ концентрации
соответствующих растворенных веществ,
а, b, c, d – соответствующие
стехиометрические коэффициенты.
Если реагирующие вещества находятся в стандартном состоянии, то уравнения (2.23) и (2.24) превращаются в
![]()
