
- •1. Основные понятия и стехиометрические законы химии
- •2 Эквивалентная масса (молярная масса эквивалента вещества)
- •3 Первый закон термодинамики
- •5 Понятие энтропии
- •6 Понятие об энергии Гиббса. Ее изменение в химических процессах.
- •7 Скорость химической реакции. Факторы влияющ. На скор. Хим. Реакции.
- •8 Равновесие в химических реакциях. Принцип Ле-Шателье.
- •9 Теория электролитической диссоциации
- •10 Теория электролитической диссоциации
- •11 Окислительно-восстановительные процессы. Понятие о степени окисления.
- •12 Классификация окислительно–восстановительных реакций. Пример
- •13 Квантово-механическая модель строения атома. Квантовые числа и их физический смысл. Атомные орбитали.
- •14 Типы химических связей
- •15 Ковалентная связь
- •16 Сигма, пи и дельта сязь.
- •17 Ионная связь. Направленность и ненасыщенность ионной связи.
- •18 Металлическая связь и ее характерные особенности.
- •19 Водородная связь. Межмолекулярная и внутримолекулярная связь: длина и энергия водородной связи. Влияние водородной связи на свойства вещества.
- •20 Комплексные соединения, их образование и строение. Внутренняя и внешняя сфера комплексного соединения, комплексообразователь и его коронационное число, лиганды.
- •21 Номенклатура комплексных соединений. Катионные, анионные и нейтральные комплексы.
- •22 Теория строения органических веществ а.М. Бутлерова
- •23 Изомерия. Виды.
- •24 Предельные ув: общая характеристика, строение.
- •25 Химические свойства предельных ув.
- •26 Этиленовые ув : общая характеристика, свойства.
- •28 Правило Марковникова. Эффект Хараша.
- •29 Полимеризация алкенов.
- •30 Озонолиз этиленовых ув.
- •31 Ацетиленовые ув: общая характеристика, строение.
- •32 Реакция Кучерова для ацетиленовых ув.
- •33 Реакции присоединения ацетиленовых ув: гидрирование, галогенирование, галогеноводородом, гидратация.
- •34 Особенности ароматических ув. Правило Хюккеля.
- •35 Реакции замещения ароматических ув.
- •36 Механизм реакции замещения ароматических ув.
- •37 Реакции присоединения ароматических ув.
- •38 Ориентанты первого и второго рода. Примеры.
28 Правило Марковникова. Эффект Хараша.
Марковникова правило: при присоединении протонных кислот или воды к несимметричным алкенам или алкинам атом водорода присоединяется к наиболее гидрогенизированному (гидрированному) атому углерода (в месте разрыва двойной связи). Названо по имени его автора В. В. Марковникова и сформулировано им в 1869 году.
Правило Марковникова объясняется +I-эффектом (положительным индуктивным электронным эффектом) алкильных групп. Например, в молекуле пропилена СН3–СН=СН2, метильная группа СН3, за счет суммирования небольшой полярности трех С–Н связей, является донором электронов и проявляет +I-эффект по отношению к соседним атомам углерода. Это вызывает смещение подвижных p-электронов двойной связи в сторону более гидрогенизированного атома углерода (в группе =СН2), и появлению на нем частичного отрицательного заряда δ-.

На менее гидрогенизированном атоме углерода (в группе -СН=) возникает частичный положительный заряд (δ+). Поэтому присоединение электрофильной частицы Н+ происходит к более гидрогенизированному углеродному атому, а электроотрицательная группа Х присоединяется к менее гидрогенизированному атому углерода. Кроме того, следует учитывать также относительную устойчивость промежуточных частиц (карбокатионов), образующихся на лимитирующей стадии реакции, поскольку реакция идет в том направлении, на котором образуются наиболее устойчивые частицы и, соответственно, более низкая энергия активации.

Устойчивость карбокатиона возрастает с увеличением числа алкильных групп, которые за счет +I-эффекта уменьшают положительный заряд на атоме углерода:

Исключения:
Современная электронная трактовка правила Марковникова позволяет объяснить и ряд случаев присоединения против этого правила. Так, присоединение электрофильных и нуклеофильных агентов к соединениям с сопряжёнными связями, содержащим электроотрицательную группировку у атома углерода двойной связи, происходит против правила Марковникова в соответствии со смещением электронной плотности к наиболее электроотрицательным атомам, например:

Правило Марковникова нарушается также в реакциях присоединения HBr к олефинам в присутствии перекисей (эффект Караша), так как механизм реакции в этом случае радикальный. Атакующей частицей является атомарный бром, а ориентация присоединения определяется стабильностью промежуточно образующегося углеродного свободного радикала:
Эффект Караша (эффект Хараша, перекисный эффект) — обращение региоселективности при присоединении галогеноводородов к алкенам в присутствии кислорода или перекисей. Данный эффект, впервые описанный М. Карашем и Ф. Майо в 1933 году[1], заключается в образовании аномального продукта, формально не соответствующего правилу Марковникова. Это связывают с изменением механизма реакции, которая в данном случае протекает не как электрофильное присоединение, а как радикальное присоединение[2].

Механизм[править | править исходный текст]
Присоединение галогеноводородов к несимметричным алкенам в присутствии перекиси протекает по радикальному механизму. На стадии инициирования радикал R, полученный в результате разложения пероксидного катализатора, отщепляет от галогеноводорода атом водорода с образованием атома галогена, который на второй стадии присоединяется к двойной С=С-связи с образованием двух изомерных алкильных радикалов. Преобладающим является более замещённый, более устойчивый радикал, который затем реагирует с галогеноводородом, давая продукт — алкилгалогенид и атом галогена, продолжающий цепную радикальную реакцию[3].
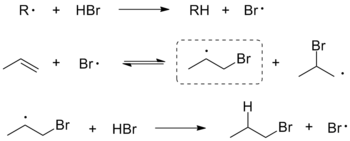
Реакция катализируется перекисями, однако их добавление извне необязательно, поскольку в присутствии кислорода алкены могут сами окисляться с образованием перекисей[4]. Наряду с радикальной реакцией происходит также классическое электрофильное присоединение, однако радикальная реакция имеет гораздо более высокую скорость, за счёт чего аномальный продукт образуется в преобладающем количестве[4].
Считается, что данный эффект характерен исключительно для бромоводорода HBr и не наблюдается в случае других галогеноводородов (HF, HCl и HI)[3][5] за счёт того, что молекулы HF и HCl слишком прочны для гомолитического разрыва, а молекула HI хотя и имеет более низкую энергию связи, но образующийся атом йода недостаточно реакционноспособен и не может развить цепную реакцию. Тем не менее, известны примеры, когда HCl также реагирует с алкенами с образованием продуктов, не согласующихся с правилом Марковникова. Однако, такие примеры не очень распространены, и в общем случае при использовании HCl скорости электрофильного и радикального присоединения сопоставимы, что приводит к смеси продуктов[4]. Радикальное присоединение HCl к алкенам также может осложняться образованием олигомеров за счёт реакции алкильных радикалов с молекулами алкена[6].
Стереохимия присоединения[править | править исходный текст]
Реакции радикального присоединения галогеноводородов к алкенам протекают как анти-присоединение, что объясняется образованием циклического бромониевого радикала, раскрытие которого происходит «с тыла»[6]. При повыщении температуры селективность снижается, поскольку становится возможным вращение С-С-связи в промежуточном алкильном радикале[4]. Для циклоалканов, в молекулах которых такое вращение невозможно, наблюдается образование только транс-продуктов[4].

