
- •1. Основные понятия и стехиометрические законы химии
- •2 Эквивалентная масса (молярная масса эквивалента вещества)
- •3 Первый закон термодинамики
- •5 Понятие энтропии
- •6 Понятие об энергии Гиббса. Ее изменение в химических процессах.
- •7 Скорость химической реакции. Факторы влияющ. На скор. Хим. Реакции.
- •8 Равновесие в химических реакциях. Принцип Ле-Шателье.
- •9 Теория электролитической диссоциации
- •10 Теория электролитической диссоциации
- •11 Окислительно-восстановительные процессы. Понятие о степени окисления.
- •12 Классификация окислительно–восстановительных реакций. Пример
- •13 Квантово-механическая модель строения атома. Квантовые числа и их физический смысл. Атомные орбитали.
- •14 Типы химических связей
- •15 Ковалентная связь
- •16 Сигма, пи и дельта сязь.
- •17 Ионная связь. Направленность и ненасыщенность ионной связи.
- •18 Металлическая связь и ее характерные особенности.
- •19 Водородная связь. Межмолекулярная и внутримолекулярная связь: длина и энергия водородной связи. Влияние водородной связи на свойства вещества.
- •20 Комплексные соединения, их образование и строение. Внутренняя и внешняя сфера комплексного соединения, комплексообразователь и его коронационное число, лиганды.
- •21 Номенклатура комплексных соединений. Катионные, анионные и нейтральные комплексы.
- •22 Теория строения органических веществ а.М. Бутлерова
- •23 Изомерия. Виды.
- •24 Предельные ув: общая характеристика, строение.
- •25 Химические свойства предельных ув.
- •26 Этиленовые ув : общая характеристика, свойства.
- •28 Правило Марковникова. Эффект Хараша.
- •29 Полимеризация алкенов.
- •30 Озонолиз этиленовых ув.
- •31 Ацетиленовые ув: общая характеристика, строение.
- •32 Реакция Кучерова для ацетиленовых ув.
- •33 Реакции присоединения ацетиленовых ув: гидрирование, галогенирование, галогеноводородом, гидратация.
- •34 Особенности ароматических ув. Правило Хюккеля.
- •35 Реакции замещения ароматических ув.
- •36 Механизм реакции замещения ароматических ув.
- •37 Реакции присоединения ароматических ув.
- •38 Ориентанты первого и второго рода. Примеры.
16 Сигма, пи и дельта сязь.
Сигма-связь
σ-связь(сигма-связь) — ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии». Характеризуется осевой симметрией. Связь, образующаяся при перекрывании гибридных орбиталей вдоль линии, соединяющей ядра атома.
Концепцию сигма- и Пи- связей сформулировал дважды лауреат Нобелевской премии Лайнус Полинг в 30-х годах прошлого века [1]. Идея включала гибридизацию атомных орбиталей, рассчитанную с помощью простых алгебраических действий.
Считалось, что сигма-связь образуется за счёт перекрывания вытянутых гибридных орбиталей (рис.1), а Пи-связь образуется за счёт перекрывания p-орбиталей (рис.2).
Однако сам Л.Полинг не был удовлетворён описанием сигма- и Пи- связей. На симпозиуме по теоретической органической химии, посвящённом памяти А.Кекуле (Лондон, сентябрь 1958г.), он раскритиковал и отказался от σ, π - описаний и предложил теорию изогнутой химической связи[2]. Последняя теория чётко учитывала физический смысл ковалентной химической связи, а именно кулоновскую электронную корреляцию.
Основная характеристика сигма-связи (длина и прочность) зависит от электронной конфигурации атомов, образующих сигма-связь.
17 Ионная связь. Направленность и ненасыщенность ионной связи.
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общаяэлектронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %.Рассмотрим способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 Зs2 3р5 Это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. — l е —> Na+ ион натрия, устойчивая восьмиэлектронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня. :Cl + 1е --> .Cl - ион хлора, устойчивая восьмиэлектронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
![]()
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Вернее, такой взгляд удобен. На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы окружённые диполями растворителя.
При растворении подобных соединений, как правило, выделяется энергия, так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион. Исключения составляют многие соли азотной кислоты (нитраты), которые при растворении поглощают тепло (растворы охлаждаются). Последний факт объясняется на основе законов, которые рассматриваются в физической химии.
Насыщенность
и направленность ковалентной связи
Число
ковалентных связей, которые образует
данный атом, ограничено и определяется
числом валентных орбиталей: s-, p- и d-
внешнего уровня, d- предвнешнего уровня,
f – второго снаружи уровня.
^ Насыщенность
ковалентной связи –
способность атома участвовать в
образовании только определенного числа
химических связей.
Направленность
ковалентной связи. Т.к.
все эл.облака (кроме s-) имеют определенную
пространственную направленность, а
перекрывание эл.облаков возможно только
при определенной взаимной ориентации,
то ковалентная химическая связь тоже
является направленной.
В некоторых
молекулах возникает несоответствие
между реальной геометрией молекулы и
предполагаемым направлением орбиталей
в пространстве. Для разрешения этой
проблемы в рамках теории МВС
существует теория
гибридизации АО (Л.Полинг):
-
при образовании молекулы вместо разных
по симметрии исходных АО возникают
смешанные («гибридные») орбитали,
одинаковые по энергии и форме; естественно,
что при этом меняется и форма электронных
облаков, а также их расположение в
пространстве:
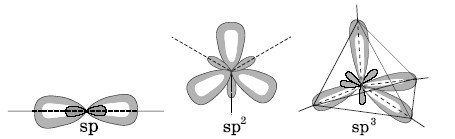 Рис.3.
Пространственное расположение электронных
облаков
для различных типов
гибридизации.
- для образования
гибридных облаков необходимы затраты
энергии, но они компенсируются, т.к.
энергия связи с гибридными облаками
больше, чем энергия связи с «чистыми»
облаками;
- число гибридных АО равно
числу исходных АО.
Рис.3.
Пространственное расположение электронных
облаков
для различных типов
гибридизации.
- для образования
гибридных облаков необходимы затраты
энергии, но они компенсируются, т.к.
энергия связи с гибридными облаками
больше, чем энергия связи с «чистыми»
облаками;
- число гибридных АО равно
числу исходных АО.
