
- •1. Основные понятия и стехиометрические законы химии
- •2 Эквивалентная масса (молярная масса эквивалента вещества)
- •3 Первый закон термодинамики
- •5 Понятие энтропии
- •6 Понятие об энергии Гиббса. Ее изменение в химических процессах.
- •7 Скорость химической реакции. Факторы влияющ. На скор. Хим. Реакции.
- •8 Равновесие в химических реакциях. Принцип Ле-Шателье.
- •9 Теория электролитической диссоциации
- •10 Теория электролитической диссоциации
- •11 Окислительно-восстановительные процессы. Понятие о степени окисления.
- •12 Классификация окислительно–восстановительных реакций. Пример
- •13 Квантово-механическая модель строения атома. Квантовые числа и их физический смысл. Атомные орбитали.
- •14 Типы химических связей
- •15 Ковалентная связь
- •16 Сигма, пи и дельта сязь.
- •17 Ионная связь. Направленность и ненасыщенность ионной связи.
- •18 Металлическая связь и ее характерные особенности.
- •19 Водородная связь. Межмолекулярная и внутримолекулярная связь: длина и энергия водородной связи. Влияние водородной связи на свойства вещества.
- •20 Комплексные соединения, их образование и строение. Внутренняя и внешняя сфера комплексного соединения, комплексообразователь и его коронационное число, лиганды.
- •21 Номенклатура комплексных соединений. Катионные, анионные и нейтральные комплексы.
- •22 Теория строения органических веществ а.М. Бутлерова
- •23 Изомерия. Виды.
- •24 Предельные ув: общая характеристика, строение.
- •25 Химические свойства предельных ув.
- •26 Этиленовые ув : общая характеристика, свойства.
- •28 Правило Марковникова. Эффект Хараша.
- •29 Полимеризация алкенов.
- •30 Озонолиз этиленовых ув.
- •31 Ацетиленовые ув: общая характеристика, строение.
- •32 Реакция Кучерова для ацетиленовых ув.
- •33 Реакции присоединения ацетиленовых ув: гидрирование, галогенирование, галогеноводородом, гидратация.
- •34 Особенности ароматических ув. Правило Хюккеля.
- •35 Реакции замещения ароматических ув.
- •36 Механизм реакции замещения ароматических ув.
- •37 Реакции присоединения ароматических ув.
- •38 Ориентанты первого и второго рода. Примеры.
13 Квантово-механическая модель строения атома. Квантовые числа и их физический смысл. Атомные орбитали.
В основу КММ положена квантовая теория атома, согласно которой электрон обладает как свойствами частицы, так и свойствами волны. Другими словами, о местоположении электрона в определенной точке можно судить не точно, а с определенной долей вероятности. Поэтому в КММ орбиты Бора заменили орбиталями (эдакие "электронные облака" - области пространства в которых существует вероятность пребывания электрона). Квантовые числа и их физический смысл
Как следует из решения уравнения Шредингера для атома водорода, квантовое состояние электрона в этом атоме (можно сказать и квантовое состояние атома) полностью определяется заданием трех квантовых чисел. "Задайте значения квантовых чисел, и я полностью опишу свойства атома" - так может современный физик перефразировать известное изречение Архимеда.
Каждое из квантовых чисел принимает только целочисленные значения и определяет, то есть предсказывает результаты измерения основных физических величин в заданном квантовом состоянии атома.
1. Главное
квантовое число ![]() . Это
квантовое число принимает значения
. Это
квантовое число принимает значения
![]()
и определяет полную энергию электрона в любом квантовом состоянии
|
(5.37) |
Можно
отметить, что эти значения энергии
являются собственными значениями
гамильтониана (5.17a).
Поэтому в связанном состоянии электрон
в атоме водорода имеет дискретный
энергетический спектр, лежащий в области
отрицательных значений и имеющий точку
сгущения ![]() .
.
2. Орбитальное
(азимутальное) квантовое число ![]() . В
квантовых состояниях с заданным значением
главного квантового числа
азимутальное
квантовое число может иметь следующие
значения:
. В
квантовых состояниях с заданным значением
главного квантового числа
азимутальное
квантовое число может иметь следующие
значения:
![]() .
.
Из
выводов предыдущего параграфа следует,
что стационарные волновые функции ![]() ,
описывающие различные квантовые
состояния атома, являются собственными
функциями не только оператора полной
энергии
,
описывающие различные квантовые
состояния атома, являются собственными
функциями не только оператора полной
энергии ![]() ,
но и оператора квадрата момента
импульса
,
но и оператора квадрата момента
импульса ![]() ,
причем
,
причем
![]() .
.
Следовательно, в любом квантовом состоянии атом обладает определенным значением квадрата момента импульса, причем модуль орбитального момента импульса движущегося в атоме электрона однозначно определяется орбитальным квантовым числом:
|
(5.38) |
Проанализируем
эту формулу
квантования момента импульса.
Сравнивая ее с условием (5.3) квантования
момента импульса движущегося электрона
в теории Бора, можно заметить, что эти
условия не совпадают. И дело не только
в отличии числовых значений, рассчитанных
по этим формулам. Принципиальное отличие
этих соотношений состоит в том, что в
квантовой механике возможны состояния
атома с нулевым моментом импульса. Во
всех ![]() -состояниях
и, частности, в основном
-состояниях
и, частности, в основном ![]() -состоянии,
когда
-состоянии,
когда ![]() ,
по формуле (5.38) получаем
,
по формуле (5.38) получаем ![]() .
.
При классическом описании движения электрона в атоме по определенной траектории (орбите) в любом состоянии атом должен обладать ненулевым моментом импульса.
Опыт подтверждает существование квантовых состояний атома с нулевыми орбитальными моментами. Следовательно, опыт подтверждает, что только отказ от классического траекторного способа описания движения электрона в атоме позволяет правильно рассчитать и предсказать свойства атома. Вероятностный способ описания движения частиц в квантовой механике является единственно правильным способом описания свойств атомных систем - таков вывод современной физики.
Так
как движущийся вокруг ядра электрон
является заряженной частицей, то такое
движение обуславливает протекание
некоторого замкнутого тока в атоме,
который можно охарактеризоватьорбитальным
магнитным моментом![]() .
.
В
теории Бора, когда с позиции классической
теории рассматривается круговое движение
электрона по орбите радиуса ![]() со
скоростью
со
скоростью ![]() ,
величина орбитального механического
момента равна
,
величина орбитального механического
момента равна ![]() .
Если время полного оборота электрона
.
Если время полного оборота электрона ![]() ,
то такому движению соответствует
замкнутый ток
,
то такому движению соответствует
замкнутый ток
![]() ,
,
который можно охарактеризовать величиной магнитного момента
![]() .
.
Связь механического и магнитного моментов при этом определяется гиромагнитным отношением
|
(5.39) |
Так
как заряд электрона отрицателен, то для
орбитального движения направление
вектора магнитного момента
противоположно
направлению вектора механического
момента импульса ![]() (рис.
5.8).
(рис.
5.8).
Для
расчета орбитального магнитного момента
в квантовой теории следует определить
пространственную плотность электрического
тока ![]() через
плотность потока вероятностей
через
плотность потока вероятностей ![]() по
формуле:
по
формуле: ![]() .
Плотность потока вероятности при этом
можно найти по формуле (3.23),
зная волновую функцию электрона в
заданном квантовом состоянии атома.
Точный квантовомеханический расчет
гиромагнитного отношения также приводит
к формуле (5.39).
.
Плотность потока вероятности при этом
можно найти по формуле (3.23),
зная волновую функцию электрона в
заданном квантовом состоянии атома.
Точный квантовомеханический расчет
гиромагнитного отношения также приводит
к формуле (5.39).
Итак,
в любом квантовом состоянии атом водорода
обладает не только механическим
моментом ![]() ,
величина которого определяется
формулой (5.38),
но и магнитным моментом.
,
величина которого определяется
формулой (5.38),
но и магнитным моментом.
|
(5.40) |
Здесь универсальная постоянная
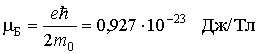
служит единицей измерения магнитных моментов атомов и называется магнетоном Бора.
Если
атом переходит из одного квантового
состояния в другое с испусканием
(поглощением) фотона излучения, то
возможны лишь такие переходы, для которых
орбитальное квантовое число
изменяется
на единицу. Это правило, согласно которому
для оптических переходов ![]() ,
называется правилом
отбора.
Наличие такого правила отбора обусловлено
тем, что электромагнитное излучение
(фотон) уносит или вносит не только квант
энергии, но и вполне определенный момент
импульса, изменяющий орбитальное
квантовое число для электрона всегда
на единицу.
,
называется правилом
отбора.
Наличие такого правила отбора обусловлено
тем, что электромагнитное излучение
(фотон) уносит или вносит не только квант
энергии, но и вполне определенный момент
импульса, изменяющий орбитальное
квантовое число для электрона всегда
на единицу.
3. Магнитное
квантовое число ![]() . В
квантовом состоянии с заданным значением
орбитального квантового числа
,
магнитное квантовое число может
принимать
. В
квантовом состоянии с заданным значением
орбитального квантового числа
,
магнитное квантовое число может
принимать ![]() различных
значений из ряда
различных
значений из ряда
![]() .
.
Физический
смысл магнитного квантового числа
вытекает из того, что волновая функция ![]() ,
описывающая квантовое состояние
электрона в атоме водорода, является
собственной функцией оператора проекции
момента импульса
,
описывающая квантовое состояние
электрона в атоме водорода, является
собственной функцией оператора проекции
момента импульса ![]() ,
причем
,
причем
![]() .
.
Поэтому,
из общих положений квантовой механики
(см. раздел
3.5)
следует, что проекция момента импульса
электрона на выделенное в пространстве
направление ![]() может
иметь только определенные значения,
равные
может
иметь только определенные значения,
равные
|
(5.41) |
Направление в пространстве обычно выделяется внешним полем (например, магнитным или электрическим), в котором находится атом.
Так как формула (5.41) квантования проекции механического момента соответствует вполне определенным направлениям ориентации в пространстве вектора (рис. 5.9), то эту формулу называют обычно формулой пространственного квантования.
С точки зрения классического представления об электронной орбите, с учетом перпендикулярности вектора к плоскости орбиты, соотношение (5.41) определяет возможные дискретные расположения электронных орбит в пространстве по отношению к направлению внешнего поля.
Отмеченная выше связь механического и магнитного моментов атома позволяет с учетом (5.41) записать также возможные значения проекции магнитного момента атома на выделенное направление :
|
(5.42) |
зависящие от значения магнитного квантового числа .
Атомная орбиталь — одноэлектронная волновая функция, полученная решением уравнения Шрёдингера для данного атома[1], задаётся главным n, орбитальным l и магнитным m квантовыми числами.
Волновая функция рассчитывается по волновому уравнению Шрёдингера в рамках одноэлектронного приближения (метод Хартри — Фока) как волновая функция электрона, находящегося в самосогласованном поле, создаваемым ядром атома со всеми остальными электронами атома.
Сам Э.Шрёдингер рассматривал электрон в атоме как отрицательно заряженное облако, плотность которого пропорциональна квадрату значения волновой функции в соответствующей точке атома. В таком виде понятие электронного облака было воспринято и в теоретической химии.
Однако большинство физиков не разделяли убеждений Э.Шрёдингера — доказательства существования электрона как «отрицательно заряженного облака» не было. Макс Борн обосновал вероятностную трактовку квадрата волновой функции. В 1950 г. Э.Шрёдингер в статье «Что такое элементарная частица?» вынужден согласиться с доводами М.Борна, которому в 1954 году присуждена Нобелевская премия по физике с формулировкой «За фундаментальное исследование в области квантовой механики, особенно за статистическую интерпретацию волновой функции».
Название «орбиталь» (а не орбита) отражает геометрическое представление о стационарных состояниях электрона в атоме; такое особое название отражает тот факт, что состояния электрона в атоме описывается законами квантовой механики и отличается от классического движения по траектории. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.

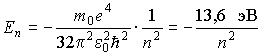 .
. .
.