
- •Часть 1
- •Часть 1
- •Содержание
- •Введение
- •Классификация неорганических соединений Теоретическое введение к лабораторным работам № 1, 2
- •Химические свойства основных оксидов
- •Химические свойства кислотных оксидов
- •Химические свойства амфотерных оксидов
- •Гидроксиды
- •Получение гидроксидов
- •Химические свойства гидроксидов
- •1. Основные гидроксиды (основания)
- •2.Амфотерные гидроксиды
- •Кислоты
- •Получение нормальных или средних солей
- •Получение кислых солей
- •Получение нормальных солей из кислых
- •Получение основных солей
- •Получение нормальных солей из основных
- •Лабораторная работа 1. Получение гидроксидов и кислот и их свойства
- •Лабораторная работа 2. Получение солей
- •Лабораторная работа 3. Определение молярной массы эквивалентов алюминия Теоретическое введение
- •Количество вещества эквивалентов
- •Законы эквивалентов
- •Выполнение лабораторной работы
- •Обработка результатов
- •Лабораторная работа 4. Определение изменения энтальпии при реакции нейтрализации Теоретическое введение
- •Выполнение лабораторной работы
- •Лабораторная работа 5. Скорость химических реакций и смещение химического равновесия Скорость химических реакций
- •Химическое равновесие
- •Выполнение лабораторной работы
- •Лабораторная работа 6. Периодическая система элементов Теоретическое введение
- •Выполнение лабораторной работы
- •Лабораторная работа 7. Комплексные соединения Теоретическое введение
- •Выполнение лабораторной работы
- •Лабораторная работа 8. Электролитическая диссоциация Теоретическое введение
- •Выполнение лабораторной работы
- •Лабораторная работа 9. Гидролиз солей Теоретическое введение
- •Выполнение лабораторной работы
- •Лабораторная работа 10. Окислительно-восстановительные реакции Теоретическое введение к лабораторным работам № 10, 11
- •Выполнение лабораторной работы
- •Лабораторная работа 11. Направление окислительно-восстановительных реакций
- •Лабораторная работа 12. Коррозия и защита металлов Теоретическое введение
- •Выполнение лабораторной работы
- •Лабораторная работа 13. Действие кислот и щелочей на простые вещества Теоретическое введение
- •Выполнение лабораторной работы
- •Общая и неорганическая химия
- •Часть 1
- •654007, Г. Новокузнецк, ул. Кирова, 42.
Выполнение лабораторной работы
ОПЫТ 1. Коррозия при контакте двух различных металлов.
В пробирку налейте 5 – 6 мл раствора серной кислоты и опустите туда алюминиевую пластинку. Наблюдайте медленное выделение водорода. Опустите в раствор медную пластинку и приведите в контакт с алюминиевой пластинкой. Объясните бурное выделение водорода на меди.
Составьте уравнение проходящих реакций. Как повлиял контакт с медью на скорость коррозии алюминия?
ОПЫТ 2. Образование микрогальванопар.
В пробирку с 3 – 4 мл разбавленной серной кислоты опустите кусочек гранулированного цинка. Обратите внимание на медленное выделение водорода. Добавьте несколько капель раствора сульфата меди. Чем объясните энергичное выделение пузырьков водорода? Напишите уравнение реакций.
ОПЫТ 3. Анодные и катодные покрытия.
В две пробирки налейте по 3 – 4 мл дистиллированной воды и 2 – 3 капли раствора серной кислоты и красной кровяной соли К3[Fе(СN)6], являющейся реактивом на ион Fe2+. В одну из пробирок опустите железную проволоку, соединенную с цинком, а в другую – железную проволоку, соединенную с оловом. Наблюдайте через некоторое время посинение раствора в одной из пробирок. Чем оно объясняется? Почему в другой пробирке не появляется посинение? Какие гальванические пары образовались? Составьте уравнение коррозии оцинкованного и луженого железа в кислой среде.
ОПЫТ 4. Действие замедлителей коррозии.
В четыре пробирки налейте равные объемы раствора соляной кислоты и в каждую опустите немного железных стружек. В одну из пробирок добавьте 3–4 капли уротропина, во вторую 3–4 капли раствора иодида калия, в третью – кристаллик бихромата калия, четвертую оставить для сравнения. Что наблюдаете? Чем объяснить замедление и прекращение выделения водорода?
Лабораторная работа 13. Действие кислот и щелочей на простые вещества Теоретическое введение
В окислительно-восстановительных реакциях взаимодействия простых веществ с кислотами последние выступают в качестве окислителя, а простое вещество – в роли восстановителя.
Данные процессы протекают в зависимости от природы кислоты и её концентрации, температуры, природы простого вещества. Кислоты можно разделить на 2 группы: окислительные и неокислительные. К неокислительным кислотам относятся соляная (разбавленная и концентрированная) и серная (разбавленная). Их окислительные свойства проявляются за счет иона водорода. Окислительные кислоты – серная (концентрированная) и азотная (разбавленная и концентрированная). В них окислителями выступают ионы кислотного остатка, а именно, сера (VI) и азот (V).
Неокислительные кислоты окисляют простые вещества за счёт иона Н+. Поэтому эти кислоты могут взаимодействовать только с теми металлами, которые стоят в ряду напряжений до водорода. При этом образуются соответствующие соли и выделяется водород:
Ме + n Н+
= Меn+
+
![]() Н2↑.
Н2↑.
Продукты взаимодействия металлов с концентрированной серной кислотой зависят от активности металлов. Химически активными металлами считаются металлы с электродными потенциалами Е0 < –0,4В, а химически малоактивными с Е0 > 0. Между указанными металлами находятся металлы средней активности. Чем активнее металл, тем выше степень восстановления окислителя.
Взаимодействие H2SO4 конц. с металлами происходит по схеме:

На взаимодействие металлов с азотной кислотой, кроме активности металлов, оказывает влияние и степень разбавления кислоты. Чем активнее металл и чем разбавленнее кислота, тем выше степень восстановления N+5. В зависимости от вышесказанного возможны следующие продукты восстановления окислителя:
![]() Следует
помнить, что при взаимодействии
концентрированной азотной кислотой с
любым металлом образуется диоксид азота
NO2:
Следует
помнить, что при взаимодействии
концентрированной азотной кислотой с
любым металлом образуется диоксид азота
NO2:
Me + HNO3 → Me(NO3)n + NO2↑ + H2O.
Водные растворы азотной кислоты взаимодействуют по схеме:
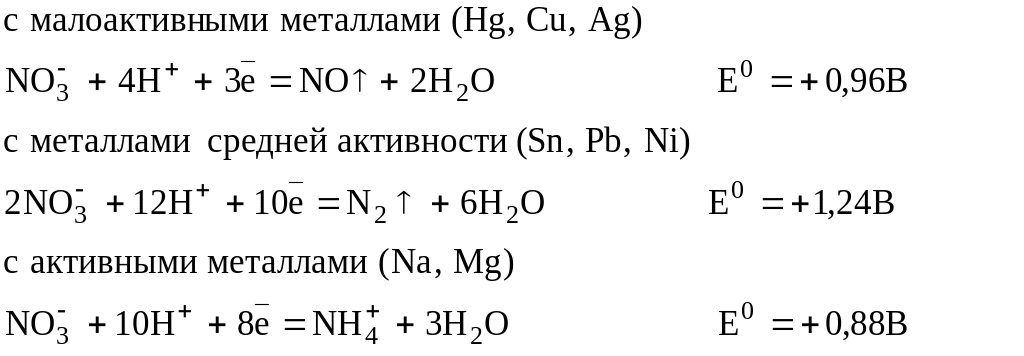
Концентрированная азотная и серная кислоты обладают способностью пассивировать отдельные металлы (Ti, Al, Cr, Be, Mo, Bi, Co, Fe, Mg, Nb). При пассивации на поверхности металлов образуется защитная плёнка оксида, предотвращающая воздействие на них кислот.
Действие щелочей на простые вещества определяется природой этих веществ. Металлы, образующие амфотерные гидроксиды, взаимодействуют с растворами щелочей с образованием гидроксокомплексов и выделением водорода.
Например: Zn + 2 NaOH + 2 Н2О → Nа2[Zn(OН)4] + Н2↑.
К таким металлам относятся: Zn, Аl, Cr, Sn, Ве и др. (это металлы р- и d-семейства, за исключением бериллия).
