
- •Часть 1
- •Часть 1
- •Содержание
- •Введение
- •Классификация неорганических соединений Теоретическое введение к лабораторным работам № 1, 2
- •Химические свойства основных оксидов
- •Химические свойства кислотных оксидов
- •Химические свойства амфотерных оксидов
- •Гидроксиды
- •Получение гидроксидов
- •Химические свойства гидроксидов
- •1. Основные гидроксиды (основания)
- •2.Амфотерные гидроксиды
- •Кислоты
- •Получение нормальных или средних солей
- •Получение кислых солей
- •Получение нормальных солей из кислых
- •Получение основных солей
- •Получение нормальных солей из основных
- •Лабораторная работа 1. Получение гидроксидов и кислот и их свойства
- •Лабораторная работа 2. Получение солей
- •Лабораторная работа 3. Определение молярной массы эквивалентов алюминия Теоретическое введение
- •Количество вещества эквивалентов
- •Законы эквивалентов
- •Выполнение лабораторной работы
- •Обработка результатов
- •Лабораторная работа 4. Определение изменения энтальпии при реакции нейтрализации Теоретическое введение
- •Выполнение лабораторной работы
- •Лабораторная работа 5. Скорость химических реакций и смещение химического равновесия Скорость химических реакций
- •Химическое равновесие
- •Выполнение лабораторной работы
- •Лабораторная работа 6. Периодическая система элементов Теоретическое введение
- •Выполнение лабораторной работы
- •Лабораторная работа 7. Комплексные соединения Теоретическое введение
- •Выполнение лабораторной работы
- •Лабораторная работа 8. Электролитическая диссоциация Теоретическое введение
- •Выполнение лабораторной работы
- •Лабораторная работа 9. Гидролиз солей Теоретическое введение
- •Выполнение лабораторной работы
- •Лабораторная работа 10. Окислительно-восстановительные реакции Теоретическое введение к лабораторным работам № 10, 11
- •Выполнение лабораторной работы
- •Лабораторная работа 11. Направление окислительно-восстановительных реакций
- •Лабораторная работа 12. Коррозия и защита металлов Теоретическое введение
- •Выполнение лабораторной работы
- •Лабораторная работа 13. Действие кислот и щелочей на простые вещества Теоретическое введение
- •Выполнение лабораторной работы
- •Общая и неорганическая химия
- •Часть 1
- •654007, Г. Новокузнецк, ул. Кирова, 42.
Лабораторная работа 10. Окислительно-восстановительные реакции Теоретическое введение к лабораторным работам № 10, 11
Реакции, в результате которых изменяются степени окисления элементов, называются окислительно-восстановительными.
Рассмотрим пример. Вначале возьмем реакцию, в результате которой железо окисляется до железа (II):
![]() .
.
Атомы железа в ходе реакции превращаются в положительно заряженные ионы, степень окисления (С.О.) железа повышается от 0 до+2:
![]() .
.
Такой процесс – отдача электронов (–ē), сопровождающийся повышением степени окисления элемента называется окислением.
Электроны, отдаваемые железом, принимаются катионами водорода, которые превращаются в атомы водорода, степень окисления водорода изменяется от +2 до 0:
![]() .
.
Присоединение электронов (+ē), сопровождающееся понижением степени окисления элемента, называется восстановлением.
Таким образом, в рассматриваемой реакции железо окисляется, а водород восстанавливается.
Вещество в состав, которого входит окисляющийся элемент, называется восстановителем, а вещество, содержащее восстанавливающийся элемент – окислителем.
+ē - окислитель,
принимает ē, С.О.↓, процесс восстановления;
-ē - восстановитель,
отдает ē, С.О.↑, процесс окисления.
Составляем уравнения полуреакций процесса окисления и восстановления:
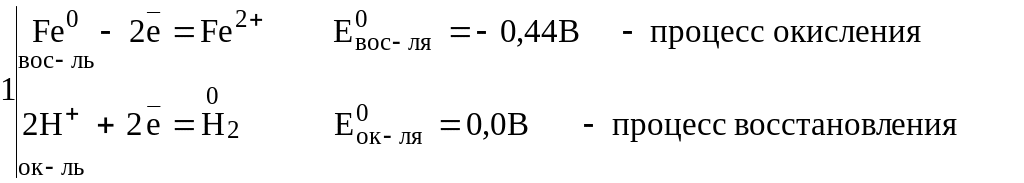
![]() .
.
Так как
![]() >
>![]() ,
реакция возможна.
,
реакция возможна.
Теперь рассмотрим возможность окисления железа до оксида железа (III):
![]() .
.
Железо – восстановитель, отдает ē; ион водорода – окислитель, принимает ē.
Составляем уравнения полуреакций процесса окисления и восстановления:
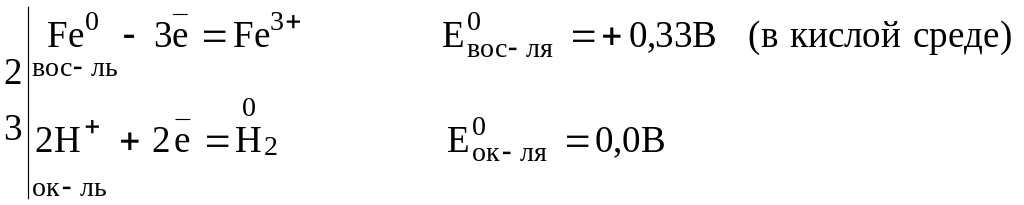
Так как < , реакция невозможна.
2Fe + 3H2SO4 разб ≠ Fe2(SO4)3 + 3H2.
Вывод: неокислительной кислотой Fe0 окисляется только до Fe2+.
При уравнивании реакций методом электронно-ионного баланса (методом полуреакций) записываем две полуреакции – окисления и восстановления, в которых сильные электролиты пишем в виде ионов, а слабые – в виде молекул. Затем каждую полуреакцию уравниваем. Уравнивание полуреакций зависит от среды раствора. Если среда кислая, то для уравнивания используем ионы водорода Н+ и Н2О, а если щелочная – то гидроксо – группы ОН– и Н2О. После этого уравниваем число отданных и принятых электронов, выставляем коэффициенты перед полуреакциями окислителя и восстановителя и записываем суммарное ионно-молекулярное уравнение с учетом выставленных коэффициентов. В полученном уравнении приводим подобные члены и переносим коэффициенты в молекулярное уравнение.
а )
K2Cr2O7+H3PO3+H2SO4→Cr2(SO4)3+H3PO4+K2SO4+H2O,
)
K2Cr2O7+H3PO3+H2SO4→Cr2(SO4)3+H3PO4+K2SO4+H2O,
1 Cr2O72– + 6e + 14H+ = 2Cr3+ + 7H2O,
3 H3PO3 – 2e + H2O = H3PO4 + 2H+,
Cr2O72– + 14H+ + 3H3PO3 + 3H2O = 3H3PO4+ 6H+ +2Cr3+ + 7H2O,
Cr2O72– + 8H+ + 3H3PO3 = 3H3PO4 + 2Cr3+ + 4H2O,
K2Cr2O7+3H3PO3+4H2SO4 = Cr2(SO4)3+3H3PO4+K2SO4+4H2O.
K2Cr2O7
– окислитель;
H3PO3
– восстановитель.
б ) Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH,
3 SO32– – 2e + 2ОН– = SO42–+ H2O,
2 MnO4– + 3e + 2H2O = MnO2 + 4OH–,
3SO32– + 6ОН– + 2MnO4– + 4H2O = 3SO42–+ 3H2O + 2MnO2 + 8OH–,
3SO32– + 2MnO4– + H2O = 3SO42– + 2MnO2 + 2OH–,
3Na2SO3 +2 KMnO4 + H2O = 3 Na2SO4 + 2MnO2 + 2KOH.
Na2SO3 – восстановитель; KMnO4 – окислитель.
