
- •Часть I
- •Предисловие
- •Работа №1 Определение молекулярной массы газообразных веществ.
- •Определение эквивалентов.
- •Энергетика химических реакций
- •Скорость химических реакций
- •Химическое равновесие. Смещение химического равновесия.
- •Бесцветный малиновый
- •Растворимость веществ. Концентрация растворов. Приготовление растворов различной концентрации.
- •1. Процентную концентрацию растворов
- •2. Молярную концентрацию раствора
- •3. Нормальную (эквивалентную) концентрацию раствора
- •4. Моляльную концентрацию раствора
- •5. Титр раствора
- •6. Мольную долю растворенного вещества и растворителя в растворе
- •Работа № 7
- •Электролитическая диссоциация.
- •Криоскопическое определение молекулярной массы
- •И степени диссоциации.
- •Водородный показатель среды рН.
- •Гидролиз солей
- •Коллоидные растворы
- •Реакции в растворах электролитов. Произведение растворимости.
- •Комплексные соединения.
- •Окислительно-восстановительные реакции.
- •Электрохимические процессы.
- •Коррозия металлов
- •Значение защитных пленок в процессе коррозии.
- •Определение жесткости и умягчения воды.
- •Химические реакции между веществами в твердой фазе. Изучение мешающего влияния ионов.
- •Металлы побочных подгрупп.
- •Экспериментальная часть.
- •Элементы групп III – VII главных подгрупп.
Энергетика химических реакций
Цель работы: выполнение калориметрических измерений и термодинамических расчетов, связанных с энергетикой химических реакций.
При химических реакциях происходит не только изменение химического состава вещества, но и, одновременно, изменение запаса химической энергии системы. К важнейшим величинам, характеризующим химические системы, относятся: внутренняя энергия системы U, энтальпия Н, энтропия S и энергия Гиббса (изобарно-изотермический потенциал) G. Все эти величины представляют собой функции состояния, т.е. зависят только от состояния системы, но не от способа, которым это состояние достигнуто.
Любые энергетические изменения в химической системе подчиняются закону сохранения энергии
Q
= U
+ A,
U
+ A,
где Q – теплота, подведённая к системе, затрачиваемая на изменение внутренней энергии системы U и совершение работы А.
Внутренняя энергия системы U складывается из энергии движения молекул, атомов и электронов системы, кроме кинетической и потенциальной энергии системы в целом. Абсолютную величину внутренней энергии определить невозможно, и в этом нет практической необходимости, т.к. человечество в своей деятельности имеет дело только с изменениями энергии при переходе системы из одного состояния в другое.
Если вследствие химического изохорного процесса (V = const) выделяется теплота, то это выделение теплоты соответствует убыли энергии системы. Эта убыль обозначается – U. Поглощение же теплоты в изохорном процессе соответствует приросту внутренней энергии системы. Выделение теплоты в изобарном процессе соответствует увеличению энтальпии и обозначается – Н; поглощение теплоты в изобарном процессе соответствует увеличению энтальпии и обозначается + Н. Значение Q, U, H выражаются в одних и тех же единицах (калориях или джоулях; 1 Дж = 0,239 кал).
Реакции, протекающие с выделение теплоты, называются экзотермическими, а реакции, протекающие с поглощением теплоты из окружающей среды, – эндотермическими.
Количество тепла, выделяемое или поглощаемое при химических реакциях, называются тепловым эффектом реакции.
Химические уравнения, в которых указывается тепловой эффект реакции, называются термохимическими уравнениями.
В основе изучения термохимических процессов лежит закон Гесса: тепловой эффект химической реакции (т.е. изменение энтальпии или внутренней энергии системы в результате реакции) зависит только от начального и конечного состояния участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
В термохимических расчётах часто используют понятия «теплота образования» и «теплота сгорания» вещества. Теплотой образования называют тепловой эффект реакции образования 1 моля сложного вещества из простых веществ. Теплоты образования обычно приводят для стандартных условий (Р = 1 атм, Т = 298 К) и обозначают Н0298 или Н0 (см. табл. 4 приложения). Теплоты образования простых веществ при стандартных условиях принимаются равными нулю.
Из закона Гесса суммарный тепловой эффект равен сумме тепловых эффектов отдельных стадий: Н1 = Н2 + Н3.
Пример1. Рассчитайте теплоту образования жидкого тетрахлорида TiCl4 по данным для других термохимических уравнений:
Ti
(к)
+
 Cl2
(г) = TiCl3
(к) + 172,4 ккал
(a)
Cl2
(г) = TiCl3
(к) + 172,4 ккал
(a)
TiCl3
(к) +
 Cl2
(г) = TiCl4
(ж) + 19,9 ккал
(б).
Cl2
(г) = TiCl4
(ж) + 19,9 ккал
(б).
Решение.
Складываем почленно уравнения (а) и (б).
Ti (к)+ 2Cl2 (г) = TiCl4 (ж) + 192,3 ккал.
Следовательно, Н0298 = –192,3 ккал/моль (–803,8 кДж/моль).
Из законов Гесса вытекает очень важное следствие, применение которого упрощает многие термохимические расчёты: стандартное изменение энтальпии химической реакции равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ.
Пример 2. Пользуясь данными таблицы 4 приложения, вычислить Н0 реакции.
2 Mg (к) + CO2 (г) = 2 MgO (к) + C (графит)
Решение.
По данным табл.4 стандартные энтальпии образования СО2 (г) и MgO (к) равны, соответственно –393,5 и –601,8 кДж/моль.
Отсюда, для стандартной энтальпии реакции находим
Н0 = 2 Н0 (MgO) – H0 (CO2) = 2∙(–601,8) – (–393,5) = –810,1 кДж.
Внутренняя энергия и энтальпия системы связаны соотношением
U = H - nRT.
Для определения направления обратимых химических процессов, константы равновесия и других термодинамических величин помимо энтальпии необходимы и другие функции состояния системы: энтропия S и энергия Гиббса G. Энтропия является мерой неупорядоченности системы и равна:
S
=
 ,
,
где R – универсальная газовая постоянная,
Nа – число Авогадро,
W – вероятность состояния вещества, т.е. число микросостояний, с помощью которого осуществляется данное микросостояние системы.
Самопроизвольное протекание химического процесса связано с увеличением энтропии.
Таким образом, мы видим, что самопроизвольное протекание химического процесса зависит от стремления системы:
а) к переходу в состояние с наименьшей внутренней энергией, мерой этого фактора является изменение энтальпии: – Н указывает на уменьшение, а + Н – на возрастание энтальпии системы;
б) к беспорядку, к достижению наиболее вероятного состояния, которое может быть реализовано наибольшим числом равновероятных способов, мерой этого фактора является энтропия. Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое, и из жидкого в газообразное.
Энергия Гиббса G является функцией состояния, которая одновременно отражает влияние энтальпии и энтропии на направление протекания химических процессов, и связана с ним отношением:
G = H - ST,
где Т – абсолютная температура.
При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается ( G < 0).
Величины G, так же как и Н, для простых веществ принимают равными нулю. Энтропии ΔS0 простых веществ не равны нулю. Энергию Гиббса, энтропию и энтальпию можно рассчитывать по закону Гесса и следствиям из него.
Пример 3. Определите изменение внутренней энергии при испарении 250 г воды при 20 0С, допуская, что пары воды подчиняются законам идеальных газов. Объёмом жидкости, по сравнению с объёмом пара, можно пренебречь. Удельная теплота парообразования воды Н = 2451Дж/г.
Решение.
U = H - nRT.
Число молей воды равно:
n = 250/18 = 13,87 моль
R = 8,314 Дж/(моль∙К).
При определении изменения внутренней энергии учитывается общая масса испаряющейся воды (250г):
U = 2451 ∙ 250 – 13,87 ∙ 8,3144 ∙ 293 = 579,0 кДж.
Внутренняя энергия увеличилась на 579,0 кДж.
Пример 4. Возможна ли следующая реакция:
SiO2
(к) + 2 NaOH
(р)
 Na2SiO3
(к) +H2O
(ж),
Na2SiO3
(к) +H2O
(ж),
если
 =
– 803,75 кДж/моль;
=
– 803,75 кДж/моль;
 =
– 1427,8 кДж/моль;
=
– 1427,8 кДж/моль;
 =
– 419,5 кДж/моль;
=
– 419,5 кДж/моль;
 =
– 237,5 кДж/моль?
=
– 237,5 кДж/моль?
Можно ли выпаривать щёлочь в стеклянном сосуде?
Решение.
Изменение энергии Гиббса G0298 реакции равно:
G0298
= Σ
G0прод.реакций
–
 ΣΔG0исход.
веществ;
ΣΔG0исход.
веществ;
G0298 = (–1427,8 – 237,5) – (–803,75 – 419,5 ∙ 2) = – 22,55 кДж;
G0298 = – 22,55 кДж (т.е. G0 < 0), а следовательно, данная реакция возможна. Щелочь нельзя выпаривать в стеклянном сосуде, так как в состав стекла входит SiO2.
Экспериментальная часть
Определение теплоты растворения соли
Растворение кристаллических солей представляет собой сложное физико-химическое явление. При растворении кристаллической соли в воде происходят два основных процесса:
1) эндотермический, связанный с разрушением кристаллической решётки;
2) экзотермический, обусловленный взаимодействием частиц растворяемого вещества с молекулами растворителя и образованием гидратированных ионов.
В зависимости от того, какой из двух вышеупомянутых тепловых процессов преобладает, тепловой эффект растворения может быть величиной или положительной или отрицательной.
При практическом определении теплоты растворения устанавливают количество тепла, поглощающегося или выделяющегося при растворении произвольно выбранной навески определяемого вещества. Так как количество тепла пропорционально количеству растворённого вещества, то в дальнейшем полученное количество тепла пересчитывают на один моль растворённого вещества.
Определяют теплоту растворения с помощью специального прибора – калориметра. Определённое количество воды помещают в калориметр и измеряют её температуру. Растворяют в ней точно взвешенное количество какого-либо вещества и измеряют максимальную температуру раствора.
В зависимости от характера процесса и реагирующих веществ применяют калориметры различных конструкций, но все калориметры содержат калориметрический сосуд, который защищает от потерь тепла и снабжён чувствительный ртутными термометрами или другим устройством для измерения температуры.
Простейший калориметр представлен на рис.3. Систему из двух стаканов можно заменить сосудом Дьюара.
Проведение опыта
Вынуть внутренний стакан калориметра, взвесить на технохимических весах, налить в него около 200 мл воды и снова взвесить. Взять сухую соль (нитрат аммония), тщательно растереть в ступке, насыпать её в сухую пробирку, примерно на 1/3 её высоты, и закрыть пробкой. Пробирку с солью взвесить и вставить в калориметр так, чтобы нижняя часть пробирки, заполненная солью, была погружена в воду калориметра.
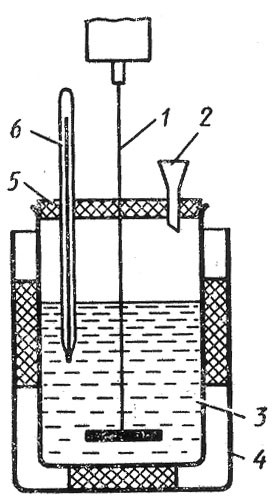
Рисунок 3. Калориметр
Через 5–10 минут, перемешав воду мешалкой, измерить с точностью до 0,10 температуру Т1 воды в калориметре.
Вынуть пробирку из калориметра и высыпать её содержимое во внутренний стакан калориметра с водой. Закрыв отверстие в крышке калориметра пробкой, перемешать жидкость до полного растворения соли и измерить минимальную температуру Т2 раствора.
По окончании опыта пробирку с пробкой и остатками соли тщательно обтереть снаружи и снова взвесить. Определите по разности массу растворённой соли.
Далее записываются результаты опыта:
масса сухого стакана m1, г |
|
масса стакана с водой m2, г |
|
масса воды в стакане m = m2 – m1 |
|
масса пробирки с пробкой и солью m3, г |
|
масса пробирки с пробкой m4, г |
|
масса растворённой соли m/ = m4 – m3 |
|
температура воды Т1 |
|
температура раствора Т2 |
|
разность температур ΔТ = Т2 – Т1 |
|
Молекулярная масса растворённого вещества М |
|
Определяем теплоту растворения нитрата аммония по формуле:
 кДж/моль
кДж/моль
Рассчитать относительную ошибку опыта.
Определение теплоты нейтрализации.
Работу проводить в калориметре (см. рис. 3). В сухой внутренний стакан калориметра налить из бюретки 100 мл 1 н. раствора едкого натра. В другой сухой стакан налить 100 мл 1 н. раствора кислоты. Измерить с точностью до 0,10 температуры Т1 кислоты и щёлочи. Если температура растворов различна, выдержать их до одинаковой температуры. Затем быстро через воронку влить кислоту в раствор щёлочи и, перемешав раствор мешалкой, измерить максимальную температуру с той же точностью, Т2.
По данным рассчитать количество тепла, выделяющегося при реакции, по формуле:
q = V∙d∙ΔT∙с∙4,186 кДж.
где V – объём раствора после нейтрализации,
d – плотность раствора,
с – теплоёмкость раствора,
ΔT – разность температур.
Для простоты расчёта следует применять плотность раствора после нейтрализации за единицу, а его теплоёмкость равной теплоёмкости воды. Далее составить уравнение нейтрализации и рассчитать тепловой эффект нейтрализации грамм-эквивалента кислоты, а затем определить относительную ошибку опыта.
Вопросы и задачи.
1.Что называется теплотой образования химического соединения?
2. Привести примеры применения закона Гесса для химических реакций, протекающих через промежуточные стадии.
3. Определите стандартную теплоту образования сероуглерода СS2, если известно, что CS2 (ж) + 3 O2 = CO2 (г) + 2 SO2 (г) – 1075 кДж/моль.
4. При взаимодействии 5 г металлического натрия с водой выделяется 40,25 кДж теплоты, а при взаимодействии 10 г оксида натрия с водой выделяется 36,46 кДж теплоты. Рассчитайте ΔН0298 Na2O.
5. Вычислите стандартную теплоту образования сахарозы С12Н22О11, если тепловой эффект реакции С12Н22О11 + 12 О2 = 12 СО2 + 11 Н2О(ж) равен – 5694 кДж.
6. Вычислить тепловой эффект реакции Al2O3 (к) + 3 SO3 (г) = Al2(SO4)3 (к), если известны стандартные теплоты образования реагирующих веществ.
7. По стандартным теплотам сгорания веществ рассчитайте Δ Н0298 системы
С2Н5ОН (ж) + СН3СООН (ж) = СН3СООС2Н5 (ж) + Н2О
и Δ Н0сгор. (СН3СООС2Н5) = – 2254,21 кДж/моль. Конечные продукты сгорания – газообразный СО2 и жидкая Н2О.
8. Определите тепловой эффект реакции: 2 PbS(к) + 3 O2 (г) = 2 PbO(к) + 2 SO2 (г)
используя значение стандартных теплот образования реагирующих веществ.
9. Определите ΔU при испарении 100 г воды при 20 0С, допуская, что пары воды подчиняются законам идеальных газов и что объём жидкости незначителен по сравнению с объёмом пара. Удельная теплота парообразования воды 2451 Дж/г.
10. Разложение хлората калия протекает по уравнению:
КClO3(к) = KCl(к) + 1,5 O2 (г)
Какое количество тепла выделилось, если объём кислорода после окончания реакции равен 2,24 л?
11. Возможна ли следующая реакция: 2 Hg2Cl2 = 2 HgCl2 + 2 Hg.
Ответ подтвердите, рассчитав ΔG0298 этой системы.
12. Какая из приведённых реакций разложения KNO3 наиболее вероятна:
а) KNO3 = K + NO2 + ½ O2;
б) 2 KNO3 = K2O + 2 NO2 + O2
в) KNO3 = KNO2 + ½ O2.
13. Определите знак изменения энтропии для реакции
2 А2 (г) + В2 (г) = 2 А2В(ж).
Возможно ли протекание этой реакции в стандартных условиях? Ответ обосновать.
14. Можно ли получить серный ангидрид по реакции
CaSO4 (к) + CO2 (г) = CaCO3 (к) + SO3 (г)?
Работа № 4
