
- •Часть I
- •Предисловие
- •Работа №1 Определение молекулярной массы газообразных веществ.
- •Определение эквивалентов.
- •Энергетика химических реакций
- •Скорость химических реакций
- •Химическое равновесие. Смещение химического равновесия.
- •Бесцветный малиновый
- •Растворимость веществ. Концентрация растворов. Приготовление растворов различной концентрации.
- •1. Процентную концентрацию растворов
- •2. Молярную концентрацию раствора
- •3. Нормальную (эквивалентную) концентрацию раствора
- •4. Моляльную концентрацию раствора
- •5. Титр раствора
- •6. Мольную долю растворенного вещества и растворителя в растворе
- •Работа № 7
- •Электролитическая диссоциация.
- •Криоскопическое определение молекулярной массы
- •И степени диссоциации.
- •Водородный показатель среды рН.
- •Гидролиз солей
- •Коллоидные растворы
- •Реакции в растворах электролитов. Произведение растворимости.
- •Комплексные соединения.
- •Окислительно-восстановительные реакции.
- •Электрохимические процессы.
- •Коррозия металлов
- •Значение защитных пленок в процессе коррозии.
- •Определение жесткости и умягчения воды.
- •Химические реакции между веществами в твердой фазе. Изучение мешающего влияния ионов.
- •Металлы побочных подгрупп.
- •Экспериментальная часть.
- •Элементы групп III – VII главных подгрупп.
Определение эквивалентов.
Цель работы: ознакомление с понятием эквивалента вещества и методикой расчета, связанной с законом эквивалентов.
Количества элементов, входящих в состав химических соединений, находятся между собой в определённых и постоянных отношениях (закон постоянства состава). Эти отношения соответствуют их эквивалентам, т.е. с одним эквивалентом любого элемента соединяется один эквивалент другого элемента. В этом состоит суть закона эквивалентов. Эквивалент элемента – это такое его количество, которое может при химических реакциях присоединять или замещать 1 моль атомов водорода или ½ моль атомов кислорода. Масса одного эквивалента, выраженная в граммах, называется эквивалентной массой (mЭ) или молярной массой эквивалента. Молярная масса эквивалента водорода mЭ = 1 г, молярная масса эквивалента кислорода mЭ = 8 г. Эквивалентным объёмом называется объём, который занимает при данных условиях 1 эквивалент рассматриваемого вещества.
Например, при нормальных условиях эквивалентный объём водорода равен 11,2 л, эквивалентный объём кислорода – 5,6 л.
При экспериментальном определении эквивалента следует учесть, что согласно закону эквивалентов все вещества взаимодействуют между собой в количествах, пропорциональных их эквивалентам, т.е. с одним эквивалентом какого-либо элемента или вещества взаимодействует один эквивалент другого элемента или вещества. Соответственно, с одной эквивалентной массой или одним эквивалентным объёмом какого-либо вещества взаимодействует одна эквивалентная масса или один эквивалентный объём другого вещества. Так, например, один эквивалент металла вытесняет из кислоты 11,2 л водорода (н.у.). Экспериментальное определение эквивалентов элемента может быть проведено различными методами.
1. Метод прямого определения.
Находят массовое количество элемента, соединяющееся с 1,008 г/моль водорода или с 8 г/моль кислорода.
Пример. При окислении 8,71 г металла получено 9,71 г оксида. Эквивалентная масса металла определяется из простого соотношения:
на 8,71г металла пошло (9,71 – 8,71) г кислорода
Э г/моль –“ – - 8 г/моль –“–
Тогда
Э =
 г/моль
г/моль
2. Метод вытеснения.
Если элемент вытесняет водород, то эквивалент его может быть определён по количеству выделенного водорода на единицу массы затраченного металла.
3. Электрический метод.
Химические эквиваленты элементов определяются на основе закона Фарадея, согласно которому 96500 Кл электричества выделяют из электролита один эквивалент вещества.
Экспериментальная часть.
Вариант (а)
Определение молярной массы эквивалента цинка методом вытеснения водорода.
В настоящей работе каждому студенту выдаётся взвешенный кусочек цинка, эквивалент которого нужно определить.
Прибор для определения химического эквивалента изображён на рис.2.
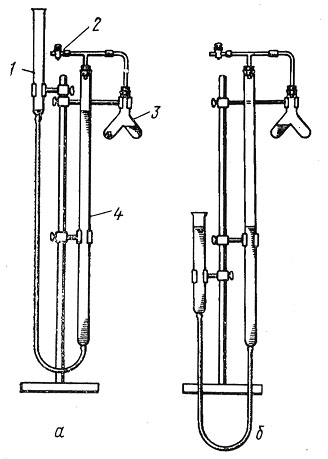
Рисунок 2. Прибор для определения химического эквивалента
Прибор состоит из следующих частей: бюретки на 50 мл (4), двухколенной пробирки (3), открытой трубки, служащей в качестве уравнительного сосуда (1), стеклянного крана (2) (кран можно заменить зажимом).
В уравнительный сосуд залейте воду, которая заполнит бюретку и вытеснит из прибора избыток воздуха через открытый кран (2). Бюретку укрепите на штативе так, чтобы уровни воды в бюретке и открытой трубке совпадали с нулевым делением. Для удобства отсчётов бюретку целесообразно опустить так, чтобы нулевое деление было на уровне глаз наблюдателя. Отсчёты уровня жидкости делайте по нижнему уровню (краю) мениска.
Кусочек цинка поместите в одно из колен пробирки, в другое колено пробирки налейте из маленького мерного цилиндра 24 %-ный раствор соляной кислоты.
Перед началом реакции проверьте прибор на герметичность. Для этого плотно вставьте пробки и закройте кран тройника, уравнительный сосуд снимите с держателя и опустите вниз на 15-20 см. Уровень воды в бюретке несколько снизится и останется без изменения, если прибор герметичен. При возвращении сосуда на прежнее место вода в нём и в бюретке должна быть на том же уровне (нулевом). Проверните пробирку таким образом, чтобы жидкость перелилась в то колено, где находится цинк. Реакция идёт по уравнению:
Zn + 2 HCl = ZnCl2 + H2,
Пока идёт реакция, зарисуйте в свой тетради установку и запишите показания барометра – Ратм и термометра – t 0C. В конце реакции передвижением сосуда приведите воду в бюретке и в сосуде к одинаковому уровню (зачем?). После охлаждения пробирки отметьте и запишите уровень воды в бюретке.
Результаты измерений запишите в таблицу:
Масса цинка mZn, г |
|
Объём
вытесненного газа
|
|
Давление Ратм, мм рт. ст. |
|
Температура t, 0С |
|
Давление насыщенного водяного пара при температуре t, мм рт. ст. |
|
Вычислите
массу вытесненного водорода
 ,
пользуясь уравнением Менделеева-Клайперона:
,
пользуясь уравнением Менделеева-Клайперона:
 ,
,
где
 –
парциальное давление водорода, мм рт.
ст.
–
парциальное давление водорода, мм рт.
ст.
Из закона эквивалентов выразите ЭZn:
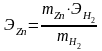
Вычислите абсолютную и относительную ошибки:
Аб. ошибка = Этеор – Ээксп ,
где

Отн.
ошибка =

Вариант (б)
Последовательность выполнения работы.
1. Возьмите на химико-технических весах навеску металлического цинка – 0,1г.
2. Подготовьте трубку для собирания газа:
а) наполните её с помощью воронки водой;
б) закройте пальцами, опрокиньте в кристаллизатор с водой и закрепите на штативе.
3. Подготовьте пробирку с газоотводной трубкой для получения водорода, для этого:
а) подведите конец газоотводной трубки к трубке для собирания газа закрепляемой на штативе,
б) заполните 1/3 пробирки 15 %-ной соляной кислотой и бросьте в неё навеску металлического цинка.
4. Быстро закройте отверстие пробирки пробкой с газоотводной трубкой и соберите выделяющийся водород, доведя растворение цинка до конца.
5. Собрав выделяющийся газ, измерьте высоту столба воды, оставшейся в трубке, с помощью полоски миллиметровой бумаги. Высота измеряется от уровня воды в кристаллизаторе. Выразите давление столба воды в мм.рт.ст., для чего получаемое в миллиметрах значение высоты разделите на 13,6.
6. Запишите величину атмосферного давления во время опыта.
7. В таблице «Давление насыщенных водяных паров» найдите парциальное давление водяного пара в газовой смеси при комнатной температуре.
8. По данным опыта вычислите парциальное давление водорода.
9. Определите объём полученного водорода по делениям трубки для собирания газа.
10. Запишите температуру выделившегося водорода, приняв её равной комнатной температуре.
11. Вычислите массу водорода по уравнению Менделеева – Клапейрона.
12. На основании полученных данных рассчитайте эквивалент цинка.
13. Определите табличный эквивалент цинка.
14. Найдите абсолютную и относительную ошибку опыта.
Форма отчета.
1. Укажите название темы и подтемы.
2. Сделайте рисунок «Установка для определения химического эквивалента цинка». (Рисунок должен изображать установку в момент окончания растворения цинка).
3. Данные опыта для определения химического эквивалента цинка приведите в таблице.
Данные опыта по определению эквивалента цинка.
1. |
Навеска цинка mZn, г. |
|
2. |
Объём водорода , мл. |
|
3. |
Высота столба воды, оставшейся в бюретке h, мм |
|
4. |
Давление
столба воды, оставшейся в бюретке
мм рт. ст. |
|
5. |
Атмосферное давление Pатм, мм рт. ст. |
|
6. |
Парциальное
давление паров воды
|
|
7. |
Парциальное давление водорода , мм рт. ст. |
|
8. |
Масса водорода , г |
|
9. |
Эквивалент цинка, рассчитанный по табличной атомной массе (Этабл.) |
|
10. |
Эквивалент цинка, вычисленный по данным опыта (Эоп). |
|
11. |
Абсолютная ошибка определения (Аабс). |
|
12. |
Относительная ошибка определения (Аотнос.). |
|
К таблице приложите:
1. Формулу для вычисления массы водорода и схему расчёта массы водорода по данным опыта.
2. Схему вычисления эквивалента цинка по определённой массе водорода.
3. Нахождение абсолютной и относительной ошибок опыта.
Определение молярной массы эквивалента сложного вещества.
Одно и тоже вещество может иметь разные эквиваленты в различных реакциях, в зависимости от условий их проведения, что особенно характерно для реакций окисления-восстановления.
Эквивалент соли, основания или кислоты в реакциях обмена равен мольной массе, делённой на суммарную зарядность (заряд, выраженный в единицах элементарного заряда – катиона или аниона).
Э = М/кz ,
где М – мольная масса вещества.
к – число атомов катиона в молекуле.
z – зарядность катиона.
Эквивалент вещества в реакциях окисления-восстановления равен его мольной массе, делённой на число принятых или отданных молекулой электронов n:
Э = М/n.
Понятие эквивалента сложного вещества широко используется в различных расчётах, особенно в области аналитической химии.
Очевидно, для нахождения величины эквивалента надо составить уравнение химической реакции, в которой участвует вещество, и с учётом уравнения реакции произвести вычисления.
Эквивалент многих сложных соединений определяется в растворах. В этом случае для определения эквивалента одного вещества по другому целесообразно пользоваться концентрациями: нормальностью и титром.
Нормальная концентрация (N) – это количество грамм-эквивалентов вещества, растворённого в 1 л раствора.
Количество растворенного вещества в граммах, содержащееся в 1 мл раствора, называют титром раствора – Т.
Нормальность
N,
эквивалентная масса Э
и титр Т
связаны соотношением
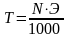 .
.
Раствор с известным титром называется титрованным.
Если необходимо определить величину эквивалента кислот, то определённое количество кислоты титруют раствором щёлочи, нормальность которого известна. Для этого к раствору кислоты постепенно приливается раствор щёлочи. Точку эквивалентности (когда число эквивалентов кислоты равно числу эквивалентов щёлочи) определяют с помощью индикатора (метил-оранжа или фенолфталеина). В соответствии с законом эквивалентов в точке эквивалентности числа миллиграмм-эквивалентов щёлочи и кислоты будут равны произведениям соответствующих объёмов на нормальность
Vщёлочи ∙ Nщёлочи = Vкислоты ∙Nкислоты
Экспериментальная часть
Определение молярной массы эквивалента серной кислоты
Для работы приготовить бюретку, пипетку на 10 мл, три конических колбочки (50 – 100 мл).
Бюретку наполнить до нулевой отметки раствором NaOH, нормальность которого известна. Нужно добиваться до полного заполнения раствором узкой части бюретки под краном (или зажимом). При отсчёте объёма на бюретке глаз наблюдателя должен быть на одном уровне с нижним краем мениска.
Пипетку вымыть данным раствором серной кислоты, титр которого узнать у лаборанта. Затем с помощью пипетки в каждую колбочку отмерить по 10 мл раствора серной кислоты с известной величиной титранта. В каждую колбочку добавить по 2 капли раствора фенолфталеина.
Ход титрования.
Коническую колбочку с раствором кислоты поместить под бюреткой на белую бумагу, левой рукой медленно открыть зажим бюретки и по капле вводить в раствор щёлочи в колбочку с кислотой, а правой рукой придать плавное круговое движение жидкости в колбочке и этим способствовать хорошему смешиванию обоих растворов. Закончить титрование тогда, когда после последней капли раствора щёлочи вся жидкость окрасится в бледно-розовый цвет, который не исчезает в течение минуты.
Отсчитайте по бюретке объём щёлочи, израсходованной на нейтрализацию раствора титруемой кислоты. Таким же образом проделайте и остальные два титрования. Если во всех 3-х случаях результаты различаются не более чем на 0,1 мл, то титрование было проведено правильно.
Расчёты:
1. Взято мл раствора кислоты;
2. Пошло мл раствора щёлочи;
I
II
III
Среднее
3. Титр раствора щёлочи;
Нормальность раствора щёлочи;
Нормальность раствора серной кислоты:

Молярная масса эквивалента серной кислоты:

Относительная ошибка определения:

Вопросы и задачи.
Что называется эквивалентом вещества?
Что называется эквивалентной массой элемента?
Как определить атомную массу элемента, если известен его эквивалент?
Чему равны эквиваленты: кислоты, соли, основания, оксида?
Как формулируется закон эквивалентов?
Какими методами можно определить эквиваленты вещества?
Вычислить эквивалент серы, если известно, что при горении 3 г серы получилось 6 г оксида.
На сжигание 1 г металла требуется 462 мл кислорода при н.у. Найти эквивалент этого металла.
0,12 г цинка растворили в кислоте, причём выделилось 5 мл водорода при н.у. Найти эквивалент этого металла.
Определить эквивалент металла, если 0,195 г металла вытесняют 56 мл водорода при н.у.
Эквивалент металла равен 20 г/моль. Какой объём водорода при температуре 15 0С и давлении 740 мм рт.ст. выделится из кислоты, если водород собирается над водой, а в кислоту брошена навеска металла в 0,8 г?
На восстановление 1,8 г оксида металла пошло 833 мл водорода, измеренного при н.у. Рассчитайте эквивалент оксида и эквивалент металла.
Сколько литров водорода (н.у.) потребуется для восстановления 112 г оксида металла, содержащего 71,43 % металла? Каков эквивалент металла?
В оксиде свинца содержится 7,18 % кислорода. Определить эквивалент свинца.
Хлорное железо содержит 34,42 % железа и 65,58 % хлора. Эквивалент хлора 35,46 г/моль. Определить эквивалент железа.
При восстановлении 2,32 г оксида вольфрама водородом выделилось 0,54 г воды. Определить эквивалент вольфрама в этом соединении.
При нейтрализации некоторой кислоты едким натром на 1,125 г кислоты идёт 1 г едкого натра, эквивалент которого 40 г/моль. Вычислить эквивалент кислоты.
Титр раствора H2SO4 равен 0,0024 г/мл. Чему равна нормальность этого раствора?
На нейтрализацию 10 мл раствора щёлочи пошло 6 мл 0,5 н. раствора соляной кислоты. Вычислить нормальность раствора щёлочи.
Вычислить эквивалент органической кислоты, если на титрование навески её 0,2350 г пошло 28,2 мл 0,1 н. раствора щёлочи.
Смешивают два раствора, один из которых в 1 л содержит 16 г NaOH, другой – 48 г HCl. В каких объёмных соотношениях надо взять указанные растворы для их полной нейтрализации?
Вычислить массы 5 молей эквивалентов хлора, серной кислоты и углекислого натрия.
Работа №3

 ,
мл
,
мл ,
,
 ,
мм рт. ст.
,
мм рт. ст.