
- •Часть I
- •Предисловие
- •Работа №1 Определение молекулярной массы газообразных веществ.
- •Определение эквивалентов.
- •Энергетика химических реакций
- •Скорость химических реакций
- •Химическое равновесие. Смещение химического равновесия.
- •Бесцветный малиновый
- •Растворимость веществ. Концентрация растворов. Приготовление растворов различной концентрации.
- •1. Процентную концентрацию растворов
- •2. Молярную концентрацию раствора
- •3. Нормальную (эквивалентную) концентрацию раствора
- •4. Моляльную концентрацию раствора
- •5. Титр раствора
- •6. Мольную долю растворенного вещества и растворителя в растворе
- •Работа № 7
- •Электролитическая диссоциация.
- •Криоскопическое определение молекулярной массы
- •И степени диссоциации.
- •Водородный показатель среды рН.
- •Гидролиз солей
- •Коллоидные растворы
- •Реакции в растворах электролитов. Произведение растворимости.
- •Комплексные соединения.
- •Окислительно-восстановительные реакции.
- •Электрохимические процессы.
- •Коррозия металлов
- •Значение защитных пленок в процессе коррозии.
- •Определение жесткости и умягчения воды.
- •Химические реакции между веществами в твердой фазе. Изучение мешающего влияния ионов.
- •Металлы побочных подгрупп.
- •Экспериментальная часть.
- •Элементы групп III – VII главных подгрупп.
Электрохимические процессы.
Цель работы: составление и расчет ЭДС гальванического элемента, получение катодного цинка и расчет выхода цинка по току.
В реакциях окисления-восстановления электроны непосредственно переходят от восстановителя к окислителю. Однако, если процессы окисления и восстановления пространственно разделить, а электроны направить металлическому проводнику, то такая система будет представлять собой гальванический элемент.
Гальванический элемент – это устройство, в котором на основе окислительно-восстановительной реакции получают электрический ток, т.е. химическая энергия реакции превращается в энергию электрического тока.
Рассмотрим в качестве примера гальванический элемент.
Zn | ZnSO4 || CuSO4 | Cu.
Схематически гальванические элементы записываются в строку, и при этом более активный электрод указывается слева; граница между электродом и раствором обозначается черточкой, а между растворами двумя черточками. Как показывает опыт, электроны по внешнему участку цепи перемещаются от цинка к меди. В гальваническом элементе происходят следующие процессы:
Zn0 – 2e = Zn2+ (на аноде),
Сu2+ (из раствора) + 2e = Cu0 (на катоде).
Ионы SO42- через пористую перегородку постепенно диффундируют в сторону цинкового электрода.
В электрохимии названия электродов гальванического элемента даются по отношению к тем процессам, которые на них происходят: на катоде – восстановление катионов, на аноде – окисление анионов или вещества самого анода.
При действии гальванических элементов на электродах возникают электрические потенциалы. Величина этих потенциалов характеризует активность окислителей и восстановителей.
Так как узнать действительную разность потенциалов между металлом и раствором не удается, то вместо этого измеряют относительные электродные потенциалы, пользуясь так называемыми электродами сравнения. Основным электродом сравнения является водородный. Потенциал водородного электрода принимается за нуль. Для измерения электродных потенциалов составляют гальванический элемент, у которого один полуэлемент – нормальный водородный электрод, а второй – металл.
Величина потенциала зависит не только от природы металла, но и от окружающей среды и от концентрации собственных ионов металла в растворе. Зависимость величины электродного потенциала металла от концентрации собственных ионов в растворе отражает формула Нернста.
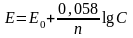 ,
,
где Е – потенциал металла, помещенного в раствор своей соли,
Е0 – нормальный потенциал,
n – зарядность металла,
С – концентрация ионов металла (моль/л).
Из формулы видно, что увеличение концентрации ионов приводит к смещению потенциала в сторону положительных значений, уменьшение концентрации – в сторону отрицательных.
Формулой Нернста часто пользуются для расчетов ЭДС гальванических элементов. Электродвижущая сила гальванического элемента равняется разности потенциалов положительного и отрицательного электродов. Поэтому при вычислении ЭДС гальванических элементов нужно предварительно установить величину электродных потенциалов обоих электродов, затем взять указанную разность потенциалов.
Электролиз.
Если систему, состоящую из двух электродов и раствора электролита, включить в цепь постоянного электрического тока, то у электродов начинают протекать реакции окисления-восстановления – у анода восстановитель отдает электроны (в сеть) и окисляется; у катода окислитель принимает электроны (из сети) и восстанавливается.
Процесс окисления-восстановления, который осуществляется под действием постоянного электрического тока, называется электролизом.
Химические реакции, протекающие при электролизе, зависят от растворенного электролита, растворителя и материала электродов.
На катоде в первую очередь идут процессы, характеризуемые наиболее положительным потенциалом, т.е. в первую очередь реагируют сильные окислители. На аноде в первую очередь идут процессы, характеризуемые наиболее положительным потенциалом, т.е. в первую очередь идут процессы, в которых реагируют сильные восстановители.
Если потенциалы двух или нескольких электродных реакций равны, то эти реакции протекают на электроде одновременно. При этом прошедшее через электрод электричество расходуется на все эти реакции. Доля количества электричества, расходуемая на превращение одного из веществ (Bј), называется выходом по току этого вещества.
Bј(%) = Qј ∙100/Q,
где Qј – количество электричества, израсходованное на превращение ј вещества.
Q – общее количество электричества, прошедшего через раствор.
Теоретическое соотношение между количеством прошедшего электричества и количеством вещества, окисленного или восстановленного на электроде, определяется законом Фарадея, согласно которому при прохождении через электрод одного Фарадея электричества (F = 96500Кл = 26,8А∙ч) на нем окисляется или восстанавливается 1 моль эквивалентов вещества.
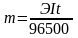 ,
,
где m – масса вещества, окисленного или восстановленного на электроде, г
Э – величина эквивалентной массы вещества,
I – сила тока в амперах (А),
t – время электролиза, сек.
Экспериментальная часть
Опыт 1.Определение ЭДС элемента.
Соберите следующую установку:
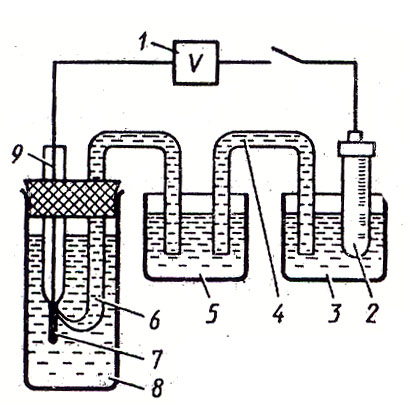
катодный вольтметр
электрод сравнения
сосуд с электродом сравнения
соединительный электролитический ключ
промежуточный сосуд
электрический ключ с капилляром, прижимаемым к электроду
изучаемый электрод
сосуд для изучаемого электрода.
I. Для этого приготовьте две электродные системы, состоящие из металлов, погруженных в растворы собственных солей. Конкретные металлы (Zn, Cd, Fe, Cu, Pb, Sn).
Сосуды для растворов предварительно вымойте проточной водой под краном, ополосните раствором соли соответствующего металла и залейте этот раствор на 2/3 их объема. Металлические стержни или пластинки тщательно зачистите наждачной бумагой, промойте проточной водой под краном и погрузите сосуды с раствором соли.
Включите ключом 9 измерительную цепь схемы. Запишите показания катодного вольтметра 1.
Запишите уравнения электродных и токообразующих реакций.
Рассчитайте ЭДС и сравните ее с экспериментальным значением.
Рассчитайте стандартную ЭДС элемента.
II.ьно залла и залейте этот раствор на 2/3 их объема.сните ратсвором ры собственных солей. Измерьте ЭДС гальванического элемента, составленного из двух полуэлементов по схеме: Cu | CuSO4 || FeSO4 | Fe.
С этой целью замените в предыдущем опыте электрод сравнения железным полуэлементом. Сравните опытные данные с теоретически вычисленной ЭДС.
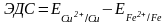
В составленном гальваническом элементе протекает химическая реакция
Fe0 + Cu2+ → Fe2+ + Cu0
На электроде из железа, который погружен в раствор соли, идет реакция окисления атомов железа в ионы (растворение железа).
Fe0 → Fe2+ + 2e.
На медном электроде, погруженном в раствор медного купороса, происходит восстановление ионов металла. Медь – положительный полюс элемента, принимает электроны от железного электрода
(+) Cu | CuSO4 || FeSO4 | Fe (-).
Опыт 2. Электролиз
а) Налейте в электролизер раствор сульфата меди. Опустите в него графитовые электроды и пропустите через раствор электрический ток; опыт проводите несколько минут. Что наблюдается на катоде? Напишите уравнения катодного и анодного процессов. Какой газ выделится на аноде? Поменяйте местами электроды в электролизере и снова пропускайте электрический ток. Что происходит с медью на аноде и какое вещество выделяется на катоде? Напишите уравнения процессов, протекающих при электролизе CuSO4 с медным анодом.
Явление электролиза используется для определения полюсов. Убедитесь в этом на опыте.
б) Возьмите полоску фильтровальной бумаги, положите на предметное стекло, смочите ее раствором NaCl и добавьте 1 - 2 капли фенолфталеина. Концы проводов от медного и железного электродов гальванического элемента плотно приложите к смоченной фильтровальной бумаге на некотором расстоянии друг от друга. У какого полюса появилось красное окрашивание? Объясните химические процессы, протекающие у электродов, написав уравнения реакции.
Опыт 3. Получение цинка электролизом.
На примере катодного осаждения цинка определяют выход цинка по току и расход энергии на единицу массы цинка.
В лабораторный стакан налейте раствор состава: сульфат цинка 1моль/л, серная кислота 1моль/л.
В стакан опустите два графитовых электрода, укрепленных на крышке-диэлектрике на расстоянии 0,5 – 1 см друг от друга. Предварительно определите массу катода. Подключите электролизер к источнику постоянного тока. Электролиз проводите при плотности тока на электродах 500 А/м2 в течении 20-30 мин. В процессе электролиза измерьте напряжение на электролизере. Отключив электролизер, удалите электрод из раствора, осушите его фильтровальной бумагой и определите его массу.
Используя электродные потенциалы, приведите обоснование электродных процессов и запишите их уравнения. Определите количество осажденного металла, количество электричества и соответствующую ему теоретическую массу выделяющегося цинка (m2). Рассчитайте выход цинка по току.
Результаты опыта сведите в таблицу:
Ток, А |
Время электролиза, ч |
Кол-во электричества, А∙ч |
Масса катода, г |
Выход цинка по току, % |
Напряжение на электролизере, В |
Расход энергии, Вт∙ч/кг. |
|||||||||
До опыта |
После опыта |
изменение |
|||||||||||||
m1 |
m2 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
Определите расход энергии на выделение 1 кг цинка.
Расход энергии на (вычисление) электрохимическое получение 1кг металла Wm вычисляется по уравнению
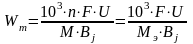 ,
,
где F – постоянная Фарадея (96500К/моль = 26,8 А∙ч/моль);
U – напряжение на электролизере, В;
Bј – выход металла по току, %;
МЭ = М/n – молярная масса эквивалента металла, г/моль;
М – молярная масса металла, г/моль;
n – изменение степени окисления металла или число электронов, принимаемых ионом металла при электроосаждении.
На основании анализа уравнения укажите пути снижения расхода энергии на получение 1 кг цинка.
Вопросы и задачи.
1. Как устроен гальванический элемент?
2. Как устроен стандартный водородный электрод?
3. Какие факторы влияют на потенциал металлического электрода?
4. Как измерить ЭДС гальванического элемента?
5. Что такое электролиз?
6. Какие процессы протекают у катода и анода при электролизе?
7. Чем определяется, какой из возможных процессов окисления-восстановления будет протекать в первую очередь?
8. В чем отличие процессов электролиза с растворимым и нерастворимым анодом?
9. Рассчитайте стандартную ЭДС гальванического элемента Pb | Pb2+ || Zn2+ | Zn по известным значениям стандартных потенциалов электродов.
10. Определите ЭДС гальванического элемента, состоящего из цинка, погруженного в 0,1 М раствор ZnSO4, и никеля, погруженного в 0,5 М раствор NiSO4, приняв, что электролиты полностью диссоциированы.
11. Рассчитайте ток в цепи и массу вещества, которое подверглось растворению при электролизе водного раствора сульфата калия с растворенным анодом, если на катоде выделилось 0,224 л водорода, измеренного при н.у. Время электролиза 1 ч.
Работа № 15.
