
- •Часть I
- •Предисловие
- •Работа №1 Определение молекулярной массы газообразных веществ.
- •Определение эквивалентов.
- •Энергетика химических реакций
- •Скорость химических реакций
- •Химическое равновесие. Смещение химического равновесия.
- •Бесцветный малиновый
- •Растворимость веществ. Концентрация растворов. Приготовление растворов различной концентрации.
- •1. Процентную концентрацию растворов
- •2. Молярную концентрацию раствора
- •3. Нормальную (эквивалентную) концентрацию раствора
- •4. Моляльную концентрацию раствора
- •5. Титр раствора
- •6. Мольную долю растворенного вещества и растворителя в растворе
- •Работа № 7
- •Электролитическая диссоциация.
- •Криоскопическое определение молекулярной массы
- •И степени диссоциации.
- •Водородный показатель среды рН.
- •Гидролиз солей
- •Коллоидные растворы
- •Реакции в растворах электролитов. Произведение растворимости.
- •Комплексные соединения.
- •Окислительно-восстановительные реакции.
- •Электрохимические процессы.
- •Коррозия металлов
- •Значение защитных пленок в процессе коррозии.
- •Определение жесткости и умягчения воды.
- •Химические реакции между веществами в твердой фазе. Изучение мешающего влияния ионов.
- •Металлы побочных подгрупп.
- •Экспериментальная часть.
- •Элементы групп III – VII главных подгрупп.
Гидролиз солей
Цель работы: изучение некоторых свойств водных растворов солей, связанных с реакцией гидролиза.
Гидролизом называется обменная реакция веществ с водой с образованием малодиссоциированного или малорастворимого соединения.
Гидролиз является результатом поляризованного взаимодействия ионов соли с их гидратной оболочкой. Чем значительнее это взаимодействие, тем интенсивнее протекает гидролиз.
Упрощенно сущность процесса гидролиза можно представить следующим образом: катионы К+ связываются в растворе с гидратирующими их молекулами воды донорно-акцепторной связью в аквакомплексы [Kn+(OH2)m]n+. Донором электронов являются атомы кислорода молекул воды, имеющие две свободные электронные пары, акцептором – катионы, имеющие свободные орбитали внешних слоев.

Аквакомплексы также гидратированы [K(OH2)m]∙xH2O, связь между молекулами воды в комплексе и молекулами воды гидратной оболочки – водородная.
Чем больше заряд катиона и чем меньше радиус, тем значительнее будет поляризующее действие Kn+ на Н2О (прочнее связь Kn+– ОН2), тем сильнее поляризуется связь О – Н координированной молекулы воды и тем сильнее водородная связь между координированной молекулой Н2О в комплексе и молекулами воды гидратной оболочки комплекса. Все это может привести к разрыву связи О – Н в координированной молекуле Н2О, к превращению водородной связи – Н … ОН2 в ковалентную с образованием ОН3+ и гидроксо-аквакомплекса по схеме:
 +
ОН2
Н (n-1)+
+
ОН2
Н (n-1)+
 ОН2
Н
Н2О
О
ОН2
Н
Н2О
О
Н2О О Н ……. ОН2 Kn+ (OH2)+OH3+
Kn+ (ОН2)Х – 1 Н2О ОН2
Н2О ОН2 ОН2
ОН2
Анионы Аn- связываются молекулами воды водородной связью. Сильное взаимодействие анионов может привести к полному отрыву протона молекулы воды:
Аn-
…О – Н – О ↔ АН(n
– 1) + ОН-.
+ ОН-.
Взаимодействие аниона с протонами воды тем значительнее, чем больше отрицательный заряд и меньше радиус аниона.
В зависимости от силы поляризующего влияния Kn+ и Аn- на молекулы Н2О будут получаться различные результаты взаимодействие солей с водой.
1. Если катионы и анионы имеют небольшие заряды, значительные радиусы, электронные оболочки инертных газов и не имеют свободных орбиталей для взаимодействия с неподеленными электронными парами молекул воды, то их поляризующее действие на молекулы невелико и взаимодействие соли с водой практически не происходит. Это относится к катионам щелочных и щелочно-земельных металлов и к таким анионам, как Cl-, Br -, I-, NO3-, ClO4-, SO4-. Следовательно, соли сильного основания и сильной кислоты гидролизу не подвергаются. Поэтому растворы таких солей практически нейтральны (рН = 7).
2. Если соль образованна катионами сильного основания и анионами слабой кислоты (S2-, CO32-, CN- и др.), то происходит гидролиз по аниону. Примером может служить процесс взаимодействия NaCO3 c H2O:
CO32- + HOH = HCO3- + OH-.
Так как в растворе появляется избыток гидроксид-ионов, то раствор будет иметь щелочную реакцию среды (рН > 7).
3. Если соль образована катионом слабого основания и анионом сильной кислоты, то происходит гидролиз по катиону. Например:
[Al(OH2)6]3+ + HOH = [Al(OH2)5OH]2+ + OH3-
или Al3+ + HOH = Al(OH)2+ + H+.
Этот наиболее часто встречающийся случай характерен для двух- и трехзарядных катионов (Cu2+, Fe2+, Fe3+, Cr3+, Br3+). Так как в растворе появляется избыток катионов водорода, то раствор будет иметь кислую реакцию (рН < 7). Очевидно, чем слабее основание, тем будет полнее гидролиз.
4. Соль, образованная катионом слабого основания и анионом слабой кислоты, подвергается гидролизу по катиону и по аниону. Например:
NH4+ + CH3COO- + HOH = NH4OH + CH3COOH.
В
зависимости от соотношения констант
диссоциации образующихся при гидролизе
кислоты и основания, растворы солей
этого типа могут иметь слабокислую и
слабощелочную реакцию, т.е. рН 7.
7.
Гидролиз некоторых солей, образованных очень слабыми основаниями и кислотами, является необратимым, например, гидролиз сульфидов и карбонатов Al3+, Cr3+, Fe3+. Эти соединения нельзя получить в водном растворе. При взаимодействии солей Al3+, Cr3+, Fe3+ с растворами щелочных сульфидов и карбонатов в осадок выпадают не сульфиды и карбонаты этих катионов, а их гидроксиды:
2 AlCl3 + 2 Na2S + 6 H2O = 2 Al(OH)3 + 3 H2S + 6 NaCl,
2 CrCl3 + 2 Na2CO3 + 3 H2O = 2 Cr(OH)3 + 3 CO2 + 6 NaCl.
В рассмотренных примерах происходит взаимное усиление гидролиза двух солей (AlCl3 и Na2S или CrCl3 и Na2CO3) и реакция идет до конца.
Если соль содержит однозарядный катион (анион) и многозарядный анион (катион), то возможен ступенчатый гидролиз. Так, образующиеся в результате первой ступени гидролиза по аниону соли могут подвергаться дальнейшему взаимодействию с водой. Однако вторая и последующая ступени гидролиза выражены менее сильно. Например, поскольку ион HCO3- диссоциирует слабее, чем H2CO3, то он и образуется в первую очередь при гидролизе Na2CO3:
Na2CO3 + HOH = NaOH + NaHCO3,
NaHCO3 + HOH = NaOH + H2CO3.
Гидролизом солей слабых многоосновных кислот по 2-ой и 3-ей ступени можно пренебречь.
Количественно гидролиз характеризуется ступенью гидролиза и константой гидролиза Кг.
Степень гидролиза – есть отношение числа молекул, подвергшихся гидролизу, к общему числу молекул: αг = Сг/С, где
Сг – концентрация гидролизованной части вещества,
С – общая концентрация растворенного вещества.
В
случае гидролиза по катиону, очевидно,
Сг = [H+],
 =
=
 .
.
При
гидролизе по аниону
 ,
,
 ,
,
где KH O = [OH-][H+] = 10-14 – ионное произведение воды.
В растворах умеренных концентраций степень гидролиза невелика (0,5-3 %). С образованием раствора, согласно принципу Ле Шателье, степень гидролиза возрастает. Например, при 25 0С для реакции
Na2CO3 + HOH = NaHCO3 + NaOH
при концентрации соли в 0,1 М растворе степень гидролиза αг = 2,7 %, а при концентрации в 0,001 М растворе – αг = 34 %.
Степень гидролиза возрастает также с повышением температуры, т.к. константа диссоциации воды увеличивается с повышением температуры в большей степени, чем константы диссоциации продуктов гидролиза слабых кислот и оснований.
Константа гидролиза. Реакция гидролиза соли КА можно представить уравнением
КА + НОН = КОН + НА.
Константа
равновесия этой реакции равна
 .
.
Так как Н2О в разбавленных растворах можно считать величиной постоянной, то и произведение Кравн∙[H2O] также будет постоянным. Эту величину называют константой гидролиза.

Для гидролиза по аниону это уравнение принимает вид

заменяя
[OH-]
на
 ,
получим
,
получим
 или
или
 ,
где Ккисл
– константа
диссоциации кислоты.
,
где Ккисл
– константа
диссоциации кислоты.
Аналогично
для гидролиза по катиону:

Для
гидролиза по катиону и аниону:

Эти уравнения служат количественным подтверждением сделанного ранее вывода: чем слабее кислота (основание), соль которой (которого) подвергается гидролизу, тем полнее он протекает.
Константа и степень гидролиза связаны между собой соотношением

Если
степень диссоциации α
<< 1, то величиной α
можно пренебречь и формула примет вид
Кг
= С∙α2
или
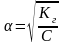 .
Зная вышеприведенные соотношения, можно
вычислить приблизительно рН
раствора гидролизующей соли.
.
Зная вышеприведенные соотношения, можно
вычислить приблизительно рН
раствора гидролизующей соли.
Например, требуется определить рН 0,008 М раствора КСN.
В водном растворе KCN гидролизуется ион CN-.
CN- + HOH = HCN + OH-.
Степень
гидролиза
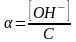 .
.
Так
как
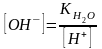 ,
то
,
то
 ,
тогда
,
тогда
 .
.
Но
так как αг=
 =
=
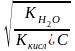 ,
окончательно имеем
,
окончательно имеем

рН = - lg [H+] = - lg 10-11 = 11.
Процесс гидролиза солей в ряде случаев может быть очень сложным. Поэтому простые уравнения реакции гидролиза в общепринятой записи часто является условным. Установить продукты гидролиза можно лишь на основании их аналитического исследования. Содержание различных продуктов гидролиза зависит от условий проведения реакции (концентрация раствора, температура, присутствие других веществ). Имеет значение также длительность процесса, так как равновесие при гидролизе солей многозарядных катионов обычно достигается медленно.
Экспериментальная часть
Опыт 1. Определить характер гидролиза.
Налить в пробирки по 2 - 3 мл растворов хлорида натрия, карбоната натрия, хлорида цинка, сульфата аммония. С помощью растворов индикаторов определить реакцию среды. Объяснить результаты и написать уравнения соответствующих реакций в молекулярной и ионной формах.
Опыт 2. Сравнение степеней гидролиза различных солей.
В две пробирки налить по 2 - 3 мл 0,05 М растворов карбоната натрия и сульфата натрия. Прибавить по 2 - 3 капли растворов индикатора (какого?). Какая соль гидролизуется больше? Пользуясь величинами соответствующих констант диссоциации кислот, вычислить степень гидролиза и рН растворов: КH CO = 4,5∙10-7, КH SO = 1,7∙10-2. Составить уравнения гидролиза.
Опыт 3. Необратимый гидролиз.
К 1 - 2 мл раствора сульфата алюминия добавить такой же объем раствора соды. Какой осадок образуется? Написать уравнение гидролиза в молекулярном и ионном виде.
Опыт 4. Влияние разбавления на гидролиз.
К 1 - 2 мл раствора нитрата висмута прибавить по каплям небольшой объем воды до появления мути. Что происходит? Написать уравнение реакции. Каким способом можно сдвинуть равновесие в сторону уменьшения гидролиза?
Опыт 5. Влияние температуры на гидролиз.
Налить в пробирки по 3 мл 1 н. раствора ацетата натрия, хлорида аммония, сульфата алюминия. Прибавить по 3 - 4 капли универсального индикатора и растворы нагреть почти до кипения. Как изменится цвет индикатора и рН растворов. Написать уравнения реакций гидролиза и объяснить изменение реакции среды при нагревании.
Опыт 6. Растворение веществ в продуктах гидролиза.
Налить в пробирку 3 - 4 мл раствора хлорида цинка. Определить реакцию среды с помощью индикатора. В раствор опустить кусочек цинка и нагреть. Какой газ выделяется? Какова роль нагревания? Написать уравнения реакций.
Форма отчета.
1. Название и цель работы.
2. Уравнения реакций (в молекулярной и ионной формах) для каждого опыта и вывод из него.
Вопросы и задачи.
1. Что такое гидролиз? Какие из перечисленных солей будут подвергаться гидролизу: K2CO3, KCl, Li2SO4, Hg(NO3)2, MgCl2, Cr2(SO4)3, Zn(CH3COO)2, FeSO4? Указать реакцию среды водных растворов этих солей и написать уравнения реакций гидролиза в молекулярной и ионно-молекулярной формах.
2. Как изменится степень гидролиза при разбавлении, при нагревании? Почему?
3. Можно ли в растворах солей, подвергающихся гидролизу, предотвратить гидролиз? Как это сделать?
4. В растворах каких солей (растворы равной концентрации) степень гидролиза будет больше: Be(NO3)2 или Zn(NO3)2? NaCN или NaNO2?
5. Написать ионные и молекулярные уравнения гидролиза сульфата железа (III) и сульфида натрия. Как можно усилить гидролиз этих солей и как ослабить его?
6. При действии на раствор соли Fe3+ карбонатом натрия в осадок выпадает не карбонат железа, а его гидроксид. Как это объяснить?
7. Как сместится равновесие гидролиза следующих солей: ZnSO4, KSbO2, KNO2, AlOHSO4 при добавлении к раствору HCl, KOH, NH4Cl?
Работа № 10
