
- •Изоферменты
- •Реакция
- •Структура
- •Механизм реакции
- •Нокауты генов
- •Обмен кислорода и углекислого газа в тканях
- •Обмен кислорода и углекислого газа в легких
- •6. Кинетика оксигенирования гемоглобина
- •Оксигенирование сопровождается значительными конформационными изменениями в гемоглобине
- •Конформационные изменения в окружении гемогруппы
6. Кинетика оксигенирования гемоглобина
Гемоглобин
связывает четыре молекулы кислорода
на тетрамер (по одной на гем в каждой
субъединице); особенно важным отличием
его от миоглобина является характерная
кривая насыщения кислородом, которая
имеет сигмоидную форму (рис. 6.8). Таким
образом, способность гемоглобина
связывать ![]() зависит
от того, содержатся ли в данном тетрамере
другие молекулы 02.
зависит
от того, содержатся ли в данном тетрамере
другие молекулы 02.
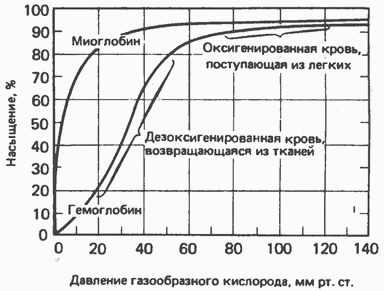
Рис.
6.8. Кривые связывания кислорода
гемоглобином и миоглобином. Парциальное
давление кислорода в артериальной крови
составляет около 100 мм рт. ст., в венозной
крови около 40 мм рт. ст., в капиллярах
кровеносных сосудов активной мышцы—
около 20 мм рт. ст.; минимальное давление,
необходимое для функционирования
ферментов цитохромной системы, равно ![]() мм
рт. ст. Из рисунка видно, что ассоциация
цепей с образованием теграмерной
структуры приводит к существенному
повышению эффективности снабжения
тканей кислородом по сравнению с
мономерными белками. (Изолированные
цепи гемоглобина обладают примерно
таким же сродством к кислороду, что и
миоглобин, и характеризуются аналогичной
гиперболической кривой насыщения.) (Из
работы
Stanbury J. В.,
Wyngaardcn J.B., Fredrickson D. S. (editors): The Metabolic Basis of
Inherited Diseases. 4th
ed. McGraw-Hill, 1978, с изменениями.)
мм
рт. ст. Из рисунка видно, что ассоциация
цепей с образованием теграмерной
структуры приводит к существенному
повышению эффективности снабжения
тканей кислородом по сравнению с
мономерными белками. (Изолированные
цепи гемоглобина обладают примерно
таким же сродством к кислороду, что и
миоглобин, и характеризуются аналогичной
гиперболической кривой насыщения.) (Из
работы
Stanbury J. В.,
Wyngaardcn J.B., Fredrickson D. S. (editors): The Metabolic Basis of
Inherited Diseases. 4th
ed. McGraw-Hill, 1978, с изменениями.)
Если
да, то последующие молекулы 02 присоединяются
легче. Следовательно, для гемоглобина
характерна кинетика кооперативного
связывания, благодаря которой он
связывает максимальное количество 02 в
легких и отдает максимальное количество
02 при тех PQ, которые имеют место в
периферических тканях. Сравните,
например, какие количества кислорода
связываются гемоглобином и миоглобином
в легких, при ![]() мм
рт. ст., и какие в тканях, при
мм
рт. ст., и какие в тканях, при ![]() мм
рт. ст. (рис. 6.8).
мм
рт. ст. (рис. 6.8).
Сродство
гемоглобинов к ![]() характеризуется
величиной
характеризуется
величиной ![]() —значением
—значением ![]() при
котором наблюдается полунасыщение
гемоглобина кислородом. Значение
при
котором наблюдается полунасыщение
гемоглобина кислородом. Значение ![]() у
разных организмов существенно различается,
но во всех случаях оно превышает
значение
у
разных организмов существенно различается,
но во всех случаях оно превышает
значение ![]() в
периферических тканях рассматриваемого
организма. Это хорошо иллюстрирует
фетальный гемоглобин человека (HBF).
Для
в
периферических тканях рассматриваемого
организма. Это хорошо иллюстрирует
фетальный гемоглобин человека (HBF).
Для ![]() мм.
рт. ст., а для
мм.
рт. ст., а для ![]() мм
рт. ст. Благодаря этой разнице гемоглобин
F отбирает кислород у
мм
рт. ст. Благодаря этой разнице гемоглобин
F отбирает кислород у ![]() ,
находящегося в плацентарной крови.
Однако после рождения ребенка HBF
утрачивает свою функцию; обладая более
высоким сродством к 02, он высвобождает
меньшее его количество в тканях.
,
находящегося в плацентарной крови.
Однако после рождения ребенка HBF
утрачивает свою функцию; обладая более
высоким сродством к 02, он высвобождает
меньшее его количество в тканях.
Оксигенирование сопровождается значительными конформационными изменениями в гемоглобине
Связывание
О, сопровождается разрывом солевых
связей, образованных концевыми
карбоксильными группами субъединиц
(рис. 6.9). Это облегчает связывание
следующих молекул ![]() ,
поскольку при этом требуется разрыв
меньшего числа солевых связей. Указанные
изменения заметно влияют на вторичную,
третичную и особенно четвертичную
структуру гемоглобина. При этом
одна
,
поскольку при этом требуется разрыв
меньшего числа солевых связей. Указанные
изменения заметно влияют на вторичную,
третичную и особенно четвертичную
структуру гемоглобина. При этом
одна ![]() -пара
субъединиц поворачивается относительно
другой
-пара
субъединиц поворачивается относительно
другой ![]() -пары,
что приводит к компактизации тетрамера
и повышению сродства гемов к
-пары,
что приводит к компактизации тетрамера
и повышению сродства гемов к ![]() (рис.
6.10 и 6.11)
(рис.
6.10 и 6.11)
Четвертичная
структура частично оксигенированного
гемоглобина описывается как Т-состояние
(от англ. taut — напряжение); полностью
оксигенированному гемоглобину ![]() отвечает
R-состояние (relaxed — релаксированное)
(рис. 6.12). Термины
отвечает
R-состояние (relaxed — релаксированное)
(рис. 6.12). Термины ![]() Т-состояния
используют для характеристики четвертичной
структуры аллостерических ферментов;
меньшим сродством к субстрату обладает
Т-состояние.
Т-состояния
используют для характеристики четвертичной
структуры аллостерических ферментов;
меньшим сродством к субстрату обладает
Т-состояние.
