- •Изоферменты
- •Реакция
- •Структура
- •Механизм реакции
- •Нокауты генов
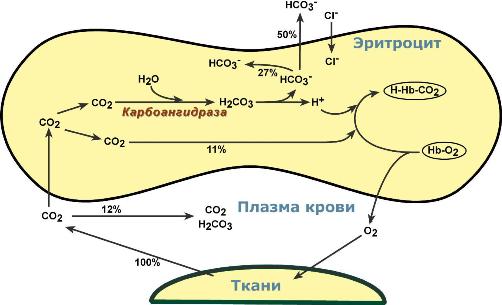
- •Обмен кислорода и углекислого газа в тканях
- •Обмен кислорода и углекислого газа в легких
- •6. Кинетика оксигенирования гемоглобина
- •Оксигенирование сопровождается значительными конформационными изменениями в гемоглобине
- •Конформационные изменения в окружении гемогруппы
1.Особенности Метаболизма в Эритроцитах.
Эритроциты: 1. Зрелые эритроциты лишены ядра, поэтому в клетке не синтезируются белки. Эритроцит почти целиком заполнен гемоглобином. 2. Эритроциты не имеют митохондрий, поэтому в клетке не протекают реакции ЦТК, ЦТД, β-окисления жирных кислот. 3. Основной путь получения энергии – гликолиз, 90% глюкозы в эритроцитах распадается в процессе анаэробного гликолиза. 4. Энергия, поставляемая гликолизом, обеспечивает поддержание целостности плазматической мембраны и работу Na+, K+-АТФазы. 5. Особенностью гликолиза в эритроцитах является наличие шунта, приводящего к образованию 2,3-дифосфоглицерата – одного из регуляторов переноса кислорода. При связывании его с гемоглобином уменьшается сродство гемоглобина к кислороду и облегчается освобождение кислорода из эритроцитов в тканях. Реакция образования 2,3-дифосфоглицерата, отсутствующая в «классическом» гликолизе, называется шунт Раппопорта. 6. 10 % глюкозы распадается в эритроците в пентозофосфатном пути. Образующийся при этом НАДФН обеспечивает восстановление глутатиона и поддерживает его оптимальную концентрацию. Восстановленный глутатион необходим для поддержания в восстановленной форме SH-групп белков; препятствует окислению гемоглобина; предотвращает перекисное окисление липидов мембран. При снижении концентрации восстановленного глутатиона эритроцит быстро «стареет».
2. Метаболизм глюкозы в эритроцитах
Эритроциты лишены митохондрий, поэтому в качестве энергетического материала они могут использовать только глюкозу. В эритроцитах катаболизм глюкозы обеспечивает сохранение структуры и функции гемоглобина, целостность мембран и образование энергии для работы ионных насосов. Глюкоза поступает в эритроциты путём облегчённой диффузии с помощью ГЛЮТ-2. Около 90% поступающей глюкозы используется в анаэробном гликолизе, а остальные 10% - в пентозофосфатном пути.
Конечный продукт анаэробного гликолиза лактат выходит в плазму крови и используется в других клетках, прежде всего гепатоцитах. АТФ, образующийся в анаэробном гликолизе, обеспечивает работу Nа+, К+-АТФ-азы и поддержание самого гликолиза, требующего затраты АТФ в гексокиназной и фосфофруктокиназной реакциях (см. раздел 7).
Важная особенность анаэробного гликолиза в эритроцитах по сравнению с другими клетками - присутствие в них фермента бисфосфоглицератмутазы. Бисфосфоглицератмутаза катализирует образование 2,3-бисфосфоглицерата из 1,3-бисфосфоглицерата (рис. 14-3). Образующийся только в эритроцитах 2,3-бисфосфоглицерат служит важным аллостерическим регулятором связывания кислорода гемоглобином (см. раздел 1).
Глюкоза в эритроцитах используется и в пентозофосфатном пути, окислительный этап которого обеспечивает образование кофермента NADPH, необходимого для восстановления глу-татиона (рис. 14-4).
-
Пентозофосфатный путь: метаболическое значение
Сравнение с гликолизом
Пентозофосфатный путь существенно отличается от гликолиз а. Окисление осуществляется на первой стадии, и в нем участвует не NAD , как в гликолизе, а NADP ; одним из продуктов пентозофосфатного пути является CO2 который в реакциях гликолиза не образуется. Наконец, пентозофосфатный путь не генерирует ATP .
Образование восстановительных эквивалентов
Значение метаболического пути для различных тканей можно оценить по его активности. Пентозофосфатный путь активно протекает в печени, жировой ткани , коре надпочечников ,щитовидной железе , эритроцитах , семенниках и в молочных железах в период лактации; он неактивен в нелактирующей молочной железе и малоактивен в скелетных мышцах . Все ткани, в которых активность данного пути высока, используют в реакциях восстановительного синтезаNADPH , например в реакциях синтеза жирных кислот , стероид ов, аминокислот (с участиемглутаматдегидрогеназы ) или восстановленного глутатион а в эритроцитах. Вероятно, в условиях активного липогенез а или при наличии любой системы, утилизирующей NADPH, возрастает активная деградация глюкозы по пентозофосфатному пути в связи с увеличением отношенияNADP:NADPH . В условиях, которые возникают после приема пищи, может индуцироваться синтезглюкозо-6-фосфатдегидрогеназы и фосфоглюконатдегидрогеназы[6-] .
Образование рибозы
Пентозофосфатный путь поставляет рибозу для синтеза нуклеотидов и синтеза нуклеиновых кислот . Источником рибозы является интермедиат рибозо-5-фосфат , который в реакции с ATPобразует PRPP , используемый в биосинтезе нуклеотидов. Мышечная ткань содержит очень малые количества глюкозо-6-фосфатдегидрогеназы и 6-фосфоглюконатдегидрогеназы. Тем не менее скелетная мышца способна синтезировать рибозу. Вероятно, это осуществляется при обращении неокислительной фазы пентозофосфатного пути, утилизирующей фруктозо-6-фосфат. Таким образом, синтез рибозы может осуществляться в ткани, если в ней протекает часть реакций пентозофосфатного пути.
3. Глутатионредуктаза ) — фермент, восстанавливающий дисульфидную связь окисленного глутатиона GSSG до его сульфгидрильной формы GSH. Восстановление глутатиона происходит за счёт энергии НАДФ-Н, образующегося в пентозном цикле. В таких клетках какэритроциты, которые постоянно подвержены высокому оксидативному стрессу, до 10% потребляемой глюкозы используется на восстановление глутатиона глутатионредуктазой.
Супероксидный радикал (O2−) спонтанно довольно быстро дисмутирует в кислород O2 и пероксид водорода H2O2 (~105M−1 s−1 при pH 7). Тем не менее, супероксид ещё быстрее реагирует с некоторыми другими молекулами-мишенями, такими как оксид азота NO, образуя при этом пероксинитрит. Однако, супероксиддисмутаза обладает самой высокой известной каталитической скоростью реакции (~109 M−1 s−1). Реакция лимитирована только частотой столкновения супероксида с ферментом (т. н. диффузионно-лимитированная реакция), благодаря чему супероксиддисмутаза защищает клетку от повреждающего действия супероксида.
Глутатионпероксидазы (ГП, англ. Glutathione peroxidase, PDB 1GP1, (КФ 1.11.1.9) — семейство ферментов, защищающих организм от окислительного повреждения. Глутатионпероксидазы катализируют восстановление перекисей липидов в соответствующие спирты и восстановление пероксида водородадо воды. Известно несколько генов, кодирующих разные формы глутатионпероксидаз, отличающиеся по локализации в организме. Структурно ферменты данного семейства представляют собой селеносодержащие тетрамерные гликопротеины.
Изоферменты
Существует несколько изоферментов, которые кодируются разными генами. Изоферменты отличаются по локализации в клетке и субстратной специфичности. Глутатионпероксидаза 1 (GPx1) является наиболее распространенной формой фермента, и обнаружена в цитоплазме практически всехтканей млекопитающих, субстратом GPx1 является пероксид водорода. Глутатионпероксидаза 4 (GPx4) имеет большое значение в метаболизме пероксдов липидов; GPx4 также экспрессируется практически во всех клетках млекопитающих на более низких уровнях. Глутатионпероксидаза 2 (GPx2) экспрессируется в кишечнике и является внеклеточным ферментом, GPx3 также является внеклеточным ферментом и в основном встречается в плазме.[1] У человека были идентифицированы восемь изоформ глутатионпероксидазы.
Глутатионпероксидаза, выделенная из эритроцитов быка имеет молекулярную массу около 84 кДа.
Реакция
Примером реакции, катализируемой ферментом глутатионпероксидазой является реакция:
2GSH + H2O2 → GS-SG + 2H2O.
где GSH обозначает восстановленный мономерный глутатион, а GS-SG — дисульфид глутатиона.
Фермент глутатионредуктаза далее восстанавливает окисленный глутатион и завершает цикл:
GS-SG + NADPH + H+ → 2 GSH + NADP+.
Структура
Обнаружено, что относящиеся к млекопитающим GPx1, GPx2, GPx3 и GPx4 являются селеносодержащими ферментами, тогда как GPx6 — селенопротеинчеловека с цистеин-содержащими гомологами у грызунов. GPx1, GPx2 и GPx3 являются гомотетрамерными белками, тогда как GPx4 имеет a мономерную структуру. Поскольку целостность клеточных и внутриклеточных мембран сильно зависит от глутатионпероксидазы, антиоксидантные защитные системы самой глутатионпероксидазы сильно зависят от наличия селена.
Механизм реакции
В активном центре фермента находится остаток аминокислоты селеноцистеина. Атом селена находится в степени окисления −1 и окисляется пероксидом до SeOH. Далее SeOH соединяется с молекулой глутатиона (GSH), образуя Se-SG и далее соединяется с другой молекулой глутатиона. При этом регенерируется Se− и образуется побочный продукт GS-SG.
Нокауты генов
Мыши, нокаутные по гену Gpx1 глутатитонпероксидазы имеют нормальный фенотип, нормальную продолжительность жизни. Эти данные указывают на то, что данный фермент не является критичным для жизнедеятельности. Однако, у мышей, нокаутных по двум копиям гена, преждевремнно развивается катаракта и наблюдаются дефекты в пролиферации вспомогательных мышечных клеток.[1] Однако, мыши нокаутные по гену GPX4 глутатионпероксидазы 4, погибают в течение раннего эмбрионального развития.[1] Существуют данные, свидетельствующие о том, что пониженный уровень глутатионпероксидазы 4 может повышать продолжительность жизни у мышей.[2]
Данные о нокаутах других генов, кодирующих глутатионпероксидазы, отсутствуют.
4.
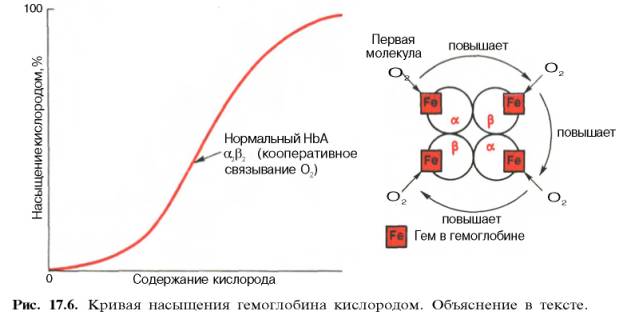
ДЫХАТЕЛЬНАЯ ФУНКЦИЯ КРОВИ. Перенос кислорода кровью Сущность дыхательной функции крови состоит в доставке кислорода от легких к тканям и углекислого газа от тканей к легким (табл. 17.4). Кровь осуществляет дыхательную функцию прежде всего благодаря наличию в ней гемоглобина. Физиологическая функция гемоглобина как переносчика кислорода основана на способности обратимо связывать кислород. Поэтому в легочных капиллярах происходит насыщение крови кислородом, а в тканевых капиллярах, где парциальное давление кислорода резко снижено, осуществляется отдача кислорода тканям. -