
- •Дм. 01 Основные химические понятия и законы Руководство по модулю «Основные химические понятия и законы»
- •Ме 1.1 (Занятие № 2)
- •Руководство по ме «Основные химические понятия и законы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.1 «Составить формулы химических соединений. Применить основные законы химии для составления уравнений химических реакций»
- •Самостоятельная работа
- •Ме 1.2 (Занятие № 3)
- •Руководство по ме «Решение задач»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.2 «Решать задачи»
- •Самостоятельная работа
- •Ме 1.3 (Занятие № 4)
- •Руководство по ме «Зачет № 1»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 01Основные химические понятия и законы»
- •Зачетная работа
- •Ме 2.1 (Занятие № 5)
- •Руководство по ме «Периодический закон и Периодическая система химических элементов д.И. Менделеева»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 2.1 «Понять структуру Периодической таблицы химических элементов. Сделать лабораторную работу «Моделирование построения Периодической таблицы химических элементов»
- •Инструкция
- •Самостоятельная работа
- •Ме 2.2 (Занятие № 6)
- •Руководство по ме «Строение атома»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 03 Строение вещества Руководство по модулю «Строение вещества»
- •Ме 3.1 (Занятие № 7)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.2 (Занятие № 8)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.3 (Занятие № 9)
- •6. Заполняется личный дневник студента. Руководство по ме «Металлическая связь. Дисперсные системы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 04 Вода. Растворы. Электролитическая диссоциация Руководство по модулю «Вода. Растворы. Электролитическая диссоциация»
- •Ме 4.1 (Занятие № 10)
- •Руководство по ме «Растворение как физико - химический процесс»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •3.1 Массовая доля
- •3.2 Молярность раствора
- •Самостоятельная работа
- •Ме 4.2 (Занятие № 11)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Плотность и процентное содержание растворов хлорида натрия.
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •Самостоятельная работа
- •Ме 4.3 (Занятие № 12)
- •Руководство по ме «Классифицировать основные классы неорганических веществ с точки зрения теории электролитической диссоциации. Определять сильные и слабые электролиты»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1) Молекулярное уравнение:
- •3) Сокращенное ионно-молекулярное уравнение:
- •Самостоятельная работа
- •Дм. 05 Классификация неорганических соединений и их свойства Руководство по модулю «Классификация неорганических соединений и их свойства»
- •Ме 5.1 (Занятие № 13)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.2 (Занятие № 14)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.3 (Занятие № 15)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Алгоритм написания уравнений реакций гидролиза солей
- •Самостоятельная работа
- •Ме 5.4 (Занятие № 16)
- •Руководство по ме «Контрольная работа»
- •Руководство по оценке действия «Продемонстрировать освоенные действия за I семестр»
- •Контрольная работа
- •Дм. 06 Химические реакции Руководство по модулю « Химические реакции»
- •Ме 6.1 (Занятие № 17)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 6.2 (Занятие № 18)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.3 (Занятие № 19)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.4 (Занятие № 20)
- •Руководство по ме «Зачет № 2»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 06 Химические реакции»
- •Зачетная работа
- •Дм. 07 Металлы и неметаллы Руководство по модулю «Металлы и неметаллы»
- •Ме 7.1 (Занятие № 21)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.2 (Занятие № 22)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.3 (Занятие № 23)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Пример:
- •Некоторые качественные реакции на анионы и катионы
- •Дм. 08 Основные понятия органической химии и теория строения органических соединений Руководство по модулю «Основные понятия органической химии и теория строения органических соединений»
- •Ме 8.1 (Занятие № 24)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 8.2 (Занятие № 25)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Основные положения теории химического строения а.М. Бутлерова
- •1. Атомы в молекулах соединяются в определенном порядке в соответствии в соответствии с их валентностью. (Углерод четырехвалентен).
- •2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул.
- •3. Свойства веществ зависят от взаимного влияния атомов в молекулах.
- •Дм. 09 Углеводороды и их природные источники Руководство по модулю «Углеводороды и их природные источники»
- •Ме 9.1 (Занятие № 26)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Реакции отщепления (дегидрирование)
- •4. Реакции разложения
- •Ме 9.2 (Занятие № 27)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Задание 3: н аписать уравнения реакций в соответствии со схемой: сн4 с2н4 (- сн2 – сн2)n
- •Ме 9.3 (Занятие № 28)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1.1 Решив задачу, определим молекулярную формулу первого представителя гомологического ряда алкинов – ацетилена. Решение задач на определение молекулярной формулы веществ
- •Ме 9.4 (Занятие № 29)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Дм. 10 Кислородосодержащие органические соединения Руководство по модулю «Кислородосодержащие органические соединения»
- •Ме 10.1 (Занятие № 30)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Одноатомные спирты.
- •Многоатомные спирты
- •Ме 10.2 (Занятие № 31)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.3 (Занятие № 32)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.4 (Занятие № 33)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Реагирует с оксидом серебра (I) в аммиачном растворе (реакция “серебряного зеркала”):
- •4. Специфические свойства.
- •Ме 10.5 (Занятие № 34)
- •Руководство по ме «Зачет № 3»
- •Зачетная работа
- •1)Алканов 2)алкинов
- •3)Алкенов 4)аренов
- •1) Бутан 2) бутен 3) бутин 4) бутанол
- •1)Бензина 2) углеводов
- •3) Бутадиена 4) фенола
- •Дм. 11 Азотсодержащие органические соединения. Полимеры Руководство по модулю «Азотсодержащие органические соединения»
- •Ме 11.1 (Занятие № 35)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Номенклатура аминов.
- •2) Взаимодействие с азотистой кислотой:
- •Важнейшие - аминокислоты общей формулы (таблицу переписать в тетрадь)
- •Задание 3: Составить структурные формулы
- •3. Изучим свойства и способы получения аминокислот Свойства аминокислот:
- •Способы получения аминокислот (все уравнения реакций перенести в тетрадь)
- •Химические свойства
- •Ме 11.2 (Занятие № 36)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Изучим конфигурации белков Структура белков
- •1. В образовании какой структуры принимают участие дисульфидные мостики: а) вторичной, б) первичной, в) третичной.
- •Ме 11.3 (Занятие № 37)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Качественные реакции органических соединений
- •Ме 11.4 (Занятие № 38)
- •Руководство по ме «Итоговый зачет»
- •Руководство по оценке действия «Продемонстрировать освоенные действия курсу «Химия»»
- •Зачетная работа
Контрольная ведомость обучающегося гр. ____________
Дисциплина: Химия (на базе основного общего образования).
Задача урока: Изучить строение и свойства аренов и природные источники углеводородов
ФИО студента __________________________________________
Критерий оценки – студент может самостоятельно выполнить следующие действия |
Да/нет |
Если нет, то что студент должен сделать дополнительно |
Дать определение непредельным углеводородам – аренам |
|
|
Объяснить строение аренов на примере строения молекулы бензола |
|
|
Назвать основные природные источники углеводородов |
|
|
Сделать лабораторную работу № 7 «Ознакомление с коллекцией образцов нефти и продуктов ее переработки» |
|
|
Достижение цели – изучить строение и свойства аренов и природные источники углеводородов (индивидуальное задание) |
|
|
Результат оценки:
|
||
Подписи оценщиков:
|
Дата проведения оценки: |
|
Руководство
по освоению действия МЕ 9.4 «Изучить строение и свойства аренов и природные источники углеводородов»
Освоим действие – Изучить строение и свойства аренов и природные источники углеводородов
Порядок освоения действия:
При освоении действия все определения и уравнения записать в тетрадь.
1. Дадим определение аренам:

Ароматические соединения (арены) — циклические органические соединения, которые имеют в своём составе ароматическую систему связей. Они могут иметь насыщенные или ненасыщенные боковые цепи.
К наиболее важным ароматическим углеводородам относятся бензол С6Н6 и его гомологи: толуол С6Н5СН3, ксилол С6Н4(СН3)2 и др.
Физические свойства
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Химические свойства аренов
I. Реакции окисления
1. Горение (коптящее пламя):
2C6H6 + 15O2 t → 12CO2 + 6H2O + Q
2. Бензол при обычных условиях не обесцвечивает бромную воду и водный раствор марганцовки
3. Гомологи бензола с одной боковой цепью дают бензойную кислоту:
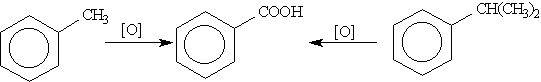
Задание 1: Написать уравнение горения толуола.
2. Галогенирование
C6H6 +3Cl2 hν → C6H6Cl6 (гексахлорциклогексан - гексахлоран)
3. Гидрирование
C6H6 + 3H2 t,Pt или Ni → C6H12 (циклогексан)
4. Полимеризация
n CH=CH2 t,kat → (-CH-CH2-)n
│ │
C6H5 C6H5
стирол полистирол
2. Изучим строение бензола
Каждый из шести атомов углерода в его молекуле находится в состоянии sp2-гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя -связями. Валентные углы между каждой парой -связей равны 120. Таким образом, скелет -связей представляет собой правильный шестиугольник, в котором все атомы углерода и все -связи С С и СН лежат в одной плоскости:

Все связи СС в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф.Кекуле), а все они выровнены (делокализованы ). Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (-скелет) и кружка внутри него, обозначающего делокализованные -связи:

3. Изучим природные источники углеводородов
Задание 2: По данному руководству составить конспект, ответив на опорные вопросы:
1. Что относится к природным углеводородам?
2. Что такое нефть?
3. Способы промышленной переработки нефти.
4. Что такое фракции нефти, перечислить основные фракции нефти.
5. Перечислите продукты, получаемые из мазута.
6. Определение и виды крекинга
7. Продукты, получаемые из попутного газа
Углеводороды являются важнейшим видом сырья для химической промышленности.
Важнейшими природными источниками углеводородов являются: нефть, газ и каменный уголь.
В химическом отношении нефть – это сложная смесь углеводородов различной молекулярной массы. Соотношение парафинов, циклопарафинов и аренов в нефтях в разных месторождениях различны, но циклопарафины составляют важную часть большинства нефтей. Нефть состоит из следующих основных элементов:
Углерод – 82-87 %
Водород – 11-15 %
Азот – 0,01 – 3 %
Кислород, сера – 0,1-2 %.
Всего нефть содержит около 100 различных соединений.
Нефть – это горючая маслянистая жидкость, различающаяся по цвету: от светло - зеленой (почти бесцветной) - до темно-бурой (почти черной), со своеобразным запахом. Она немного легче воды (плотность 0,65 – 0,98 г/см3), в воде не растворяется.
Схема ректификационной колонны по переработке нефти
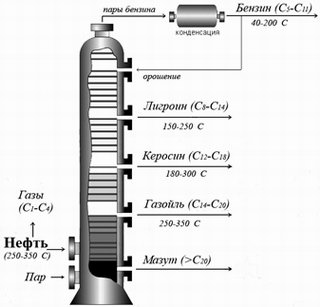
Ректификационные колонны высокие – около 40 метров. Внутри они разделяются горизонтальными перегородками с отверстиями – тарелками. Над отверстиями устанавливаются колпачки. Смесь углеводородных паров из печи поступает в нижнюю часть колонны. Навстречу, неиспарившемуся остатку нефти снизу колонны подается перегретый пар. Этот пар прогревает неиспарившейся остаток и увлекает с собой все легкие углеводороды вверх колонны. В нижнюю часть колонны стекает освобожденный от легких углеводородов тяжелый остаток – мазут.
Фракции, выкипающие до 350оС, отбирают при атмосферном давлении и называют светлыми фракциями. Названия фракциям присваиваются в зависимости от направления их дальнейшего использования.
При атмосферной перегонке получают светлые продукты:
При 40-200оС (начало кипения) – бензиновая фракция, содержит УВ с 5 – 11 атомами углерода, применяется как горючее для автомашин и самолетов с поршневыми двигателями, как растворитель масла, каучука, для очистки тканей.
140-200оС – лигроиновая фракция, содержит у/в с 8-14 атомами углерода, применяется как горючее для тракторов.
180-300оС – керосиновая фракция, содержит у/в с 12-18 атомами углерода, применяется как горючее для тракторов, реактивных двигателей. 250-350оС – получают газойль, содержащий 14-25 атомов углерода – горючее для дизелей.
Фракция, выкипающая выше 350оС является остатком после отбора светлых продуктов и называется мазутом.
Мазут перегоняют под вакуумом, т.к. при снижении давления углеводороды закипают при более низких температурах. Мазут и получаемые из него продукты – темные. В результате получают смазочные масла (автотракторные, авиационные, дизельные и др.), содержащие 20-34 атомов углерода.
Парафин – содержащий 25-40 атомов углерода. Применяется как изоляционный материал, используется в медицине и пищевой промышленности.
Гудрон (асфальт) – содержит боле 30 атомов углерода, используется для покрытия дорог, кровли зданий.
Смешивая твердые и жидкие углеводороды, получают вазелин.
Наиболее ценная фракция перегонки нефти – это бензин. Однако в процессе ректификации его выход составляет не более 18-20 % от массы сырой нефти. Количество бензина, извлекаемое из нефти, не удовлетворяет возрастающего спроса на него.
Можно ли дополнительно получить бензин из нефти?
Можно. Из более крупных молекул других фракций – получают более мелкие, более летучие молекулы, отвечающие составу бензина. Именно эти процессы лежат в основе крекинга.
Крекинг – термическое разложение нефтепродуктов, приводящее к образованию углеводородов с меньшим числом атомов углерода в молекуле.
Крекинг изобрел русский инженер В.Г.Шухов в 1891 году.
Выход бензина из нефти за счет крекинга увеличивается до 70 %.
Различают два вида крекинга.
Термический крекинг
Сырьем для данного крекинга служит мазут. Расщепление молекул углеводородов с длинной углеродной цепью на более короткие происходит под действием высокой температуры (470-550оС).
Каталитический крекинг
Происходит в присутствии катализаторов – природных алюмосиликатов nAI2O3 mSiO2.
Сырьем для крекинга является газойль.
Природный и попутный газы.
Попутный газ является побочным продуктом нефтедобычи. Попутный нефтяной газ является ценным природным источником углеводородов. Он содержит в основном алканы:
СН4 - 63 %
С2Н6 – 10 %
С3Н8 – 11 %
С4Н10 – 2,8 %
С5Н12 – 2,0 %
N2 и др. газы – 9 %.
Попутный нефтяной газ по сравнению с природным более богат по составу различными углеводородами. Разделяя их на фракции, получают:
Сухой газ – содержащий метан и этан, используется для получения ацетилена, водорода, а также в качестве топлива.
Пропан-бутановая смесь – состоящая из пропана и бутана, в сжиженном состоянии широко используется в качестве горючего в быту и в автомобильном транспорте.
Газовый бензин – содержит пентан и гексан. Используется как газовый бензин в качестве топлива внутреннего сгорания для двигателей на Крайнем Севере.
Каменный уголь – представляет собой плотную породу черного или темно-серого цвета с блестящей матовой поверхностью.
Содержит: 75 – 97 % углерода;
1,5 - 5,7 % водорода;
1,5 – 15 % кислорода;
0,5 – 4 % серы;
до 1,5 % азота;
2 – 4,5 % летучих веществ;
4 – 14 % влаги.
Основные направления промышленного использования угля: производство электроэнергии, металлургического кокса, получение при химической переработке разнообразных (до 400 наименований) продуктов.
4. Лабораторная работа № 7 «Ознакомление с коллекцией образцов нефти и продуктов ее переработки»
4.1 Рассмотреть коллекцию образцов нефти и продуктов ее переработки
4.2 Заполнить таблицу:
Легкие продукты перегонки сырой нефти |
Продукты переработки мазута |
Полужидкие и твердые продукты перегонки нефти |
Продукты полимеризации нефтяных газов |
Продукты природных видоизменений нефти |
||
Продукты крекинга |
Продукты пиролиза |
Продукты разгонки
|
||||
1. 2. и т .д. |
|
|
|
|
|
|
5. Проверим достижение цели - изучить строение и свойства аренов и природные источники углеводородов
Задание на дом: Подготовить сообщения на темы:
«Способы переработки каменного угля»
«Дополнительные способы переработки нефти: риформинг и платформинг»
«История ароматических соединений»
