
- •Дм. 01 Основные химические понятия и законы Руководство по модулю «Основные химические понятия и законы»
- •Ме 1.1 (Занятие № 2)
- •Руководство по ме «Основные химические понятия и законы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.1 «Составить формулы химических соединений. Применить основные законы химии для составления уравнений химических реакций»
- •Самостоятельная работа
- •Ме 1.2 (Занятие № 3)
- •Руководство по ме «Решение задач»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.2 «Решать задачи»
- •Самостоятельная работа
- •Ме 1.3 (Занятие № 4)
- •Руководство по ме «Зачет № 1»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 01Основные химические понятия и законы»
- •Зачетная работа
- •Ме 2.1 (Занятие № 5)
- •Руководство по ме «Периодический закон и Периодическая система химических элементов д.И. Менделеева»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 2.1 «Понять структуру Периодической таблицы химических элементов. Сделать лабораторную работу «Моделирование построения Периодической таблицы химических элементов»
- •Инструкция
- •Самостоятельная работа
- •Ме 2.2 (Занятие № 6)
- •Руководство по ме «Строение атома»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 03 Строение вещества Руководство по модулю «Строение вещества»
- •Ме 3.1 (Занятие № 7)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.2 (Занятие № 8)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.3 (Занятие № 9)
- •6. Заполняется личный дневник студента. Руководство по ме «Металлическая связь. Дисперсные системы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 04 Вода. Растворы. Электролитическая диссоциация Руководство по модулю «Вода. Растворы. Электролитическая диссоциация»
- •Ме 4.1 (Занятие № 10)
- •Руководство по ме «Растворение как физико - химический процесс»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •3.1 Массовая доля
- •3.2 Молярность раствора
- •Самостоятельная работа
- •Ме 4.2 (Занятие № 11)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Плотность и процентное содержание растворов хлорида натрия.
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •Самостоятельная работа
- •Ме 4.3 (Занятие № 12)
- •Руководство по ме «Классифицировать основные классы неорганических веществ с точки зрения теории электролитической диссоциации. Определять сильные и слабые электролиты»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1) Молекулярное уравнение:
- •3) Сокращенное ионно-молекулярное уравнение:
- •Самостоятельная работа
- •Дм. 05 Классификация неорганических соединений и их свойства Руководство по модулю «Классификация неорганических соединений и их свойства»
- •Ме 5.1 (Занятие № 13)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.2 (Занятие № 14)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.3 (Занятие № 15)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Алгоритм написания уравнений реакций гидролиза солей
- •Самостоятельная работа
- •Ме 5.4 (Занятие № 16)
- •Руководство по ме «Контрольная работа»
- •Руководство по оценке действия «Продемонстрировать освоенные действия за I семестр»
- •Контрольная работа
- •Дм. 06 Химические реакции Руководство по модулю « Химические реакции»
- •Ме 6.1 (Занятие № 17)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 6.2 (Занятие № 18)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.3 (Занятие № 19)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.4 (Занятие № 20)
- •Руководство по ме «Зачет № 2»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 06 Химические реакции»
- •Зачетная работа
- •Дм. 07 Металлы и неметаллы Руководство по модулю «Металлы и неметаллы»
- •Ме 7.1 (Занятие № 21)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.2 (Занятие № 22)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.3 (Занятие № 23)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Пример:
- •Некоторые качественные реакции на анионы и катионы
- •Дм. 08 Основные понятия органической химии и теория строения органических соединений Руководство по модулю «Основные понятия органической химии и теория строения органических соединений»
- •Ме 8.1 (Занятие № 24)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 8.2 (Занятие № 25)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Основные положения теории химического строения а.М. Бутлерова
- •1. Атомы в молекулах соединяются в определенном порядке в соответствии в соответствии с их валентностью. (Углерод четырехвалентен).
- •2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул.
- •3. Свойства веществ зависят от взаимного влияния атомов в молекулах.
- •Дм. 09 Углеводороды и их природные источники Руководство по модулю «Углеводороды и их природные источники»
- •Ме 9.1 (Занятие № 26)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Реакции отщепления (дегидрирование)
- •4. Реакции разложения
- •Ме 9.2 (Занятие № 27)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Задание 3: н аписать уравнения реакций в соответствии со схемой: сн4 с2н4 (- сн2 – сн2)n
- •Ме 9.3 (Занятие № 28)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1.1 Решив задачу, определим молекулярную формулу первого представителя гомологического ряда алкинов – ацетилена. Решение задач на определение молекулярной формулы веществ
- •Ме 9.4 (Занятие № 29)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Дм. 10 Кислородосодержащие органические соединения Руководство по модулю «Кислородосодержащие органические соединения»
- •Ме 10.1 (Занятие № 30)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Одноатомные спирты.
- •Многоатомные спирты
- •Ме 10.2 (Занятие № 31)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.3 (Занятие № 32)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.4 (Занятие № 33)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Реагирует с оксидом серебра (I) в аммиачном растворе (реакция “серебряного зеркала”):
- •4. Специфические свойства.
- •Ме 10.5 (Занятие № 34)
- •Руководство по ме «Зачет № 3»
- •Зачетная работа
- •1)Алканов 2)алкинов
- •3)Алкенов 4)аренов
- •1) Бутан 2) бутен 3) бутин 4) бутанол
- •1)Бензина 2) углеводов
- •3) Бутадиена 4) фенола
- •Дм. 11 Азотсодержащие органические соединения. Полимеры Руководство по модулю «Азотсодержащие органические соединения»
- •Ме 11.1 (Занятие № 35)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Номенклатура аминов.
- •2) Взаимодействие с азотистой кислотой:
- •Важнейшие - аминокислоты общей формулы (таблицу переписать в тетрадь)
- •Задание 3: Составить структурные формулы
- •3. Изучим свойства и способы получения аминокислот Свойства аминокислот:
- •Способы получения аминокислот (все уравнения реакций перенести в тетрадь)
- •Химические свойства
- •Ме 11.2 (Занятие № 36)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Изучим конфигурации белков Структура белков
- •1. В образовании какой структуры принимают участие дисульфидные мостики: а) вторичной, б) первичной, в) третичной.
- •Ме 11.3 (Занятие № 37)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Качественные реакции органических соединений
- •Ме 11.4 (Занятие № 38)
- •Руководство по ме «Итоговый зачет»
- •Руководство по оценке действия «Продемонстрировать освоенные действия курсу «Химия»»
- •Зачетная работа
Контрольная ведомость обучающегося гр. ____________
Дисциплина: Химия (на базе основного общего образования).
Задача урока: Изучить строение, свойства и способы получения алкинов
ФИО студента __________________________________________
Критерий оценки – студент может самостоятельно выполнить следующие действия |
Да/нет |
Если нет, то что студент должен сделать дополнительно |
Дать определение непредельным углеводородам – алкинам |
|
|
Объяснить строение алкинов на примере строения молекулы ацетилена |
|
|
Объяснить способы получения алкинов |
|
|
Составить уравнения реакций, доказывающие свойства алкинов |
|
|
Достижение цели – изучить строение, свойства и способы получения алкинов (индивидуальное задание) |
|
|
Результат оценки:
|
||
Подписи оценщиков:
|
Дата проведения оценки: |
|
Руководство
по освоению действия МЕ 9.3 «Изучить строение, свойства и способы получения алкинов»
Освоим действие – Изучить строение, свойства и способы получения алкинов
Порядок освоения действия:
1. Дадим определением алкинам
 Алкины
(иначе
ацетиленовые
углеводороды)
–
непредельные углеводороды, молекулы
которых содержат одну тройную углерод
- углеродную связь.
Алкины
(иначе
ацетиленовые
углеводороды)
–
непредельные углеводороды, молекулы
которых содержат одну тройную углерод
- углеродную связь.
1.1 Решив задачу, определим молекулярную формулу первого представителя гомологического ряда алкинов – ацетилена. Решение задач на определение молекулярной формулы веществ
Алгоритм:
1. 3аписать условие задачи.
2. Найти: Мr, М, m неизвестного вещества по данной относительной плотности: М = 2DH2, М = 29Dвозд.
3. Определить (n) атомов каждого элемента по формулам продуктов реакции, используя
n = m/M.
4. Определить простейшую формулу вещества: CxHyOz, откуда X:Y:Z = = nC:nH:nO
5. Найти молекулярную формулу вещества: (CxHyOz)n; n = M/MCxHyOz.
Пример:
При сгорании газообразного углеводорода массой 8,4 г образовался оксид углерода (IV) массой 26,4 г и вода массой 10,8 г. Относительная плотность данного вещества по водороду равна 21. Определите молекулярную формулу.
Дано: Решение:
mCxHy = 8,8 г |
mCO2 = 26,4 г |
mH2O = 10,8 г |
D H2 = 21 |
CxHy - ? |
1.
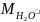 = 18 г/моль
= 18 г/моль
МCxHy = 2 × 21 = 42 г/моль.
2 . Определим nCO2 и nH2O, используя: n = m/M
nCO2 = 26,4 г / 44 г/моль = 0,6 моль, ==> nC = 0,6 моль
nH2O = 10,8 г / 18 г/моль = 0,6 моль, ==> nH =1,2 моль.
3. Находим простейшую формулу
СхНу:
x
: y
= nC
: nH
= 0,6 : 0,12 или 1: 2, ==> CH2,
где
 = 14 г/моль
= 14 г/моль
4. Определим молекулярную формулу n = M/MCxHy; n = 42/14 = 3, ==> (СН2)3 или C3H6.
2-й способ:
1. Мr(СxНy) = D H2, Мr = 2 × 21 = 42 г/моль.
2. а) m(С) = (26,4 г × 12) /44 = 7,2 г;
б) m(H) = (10,8 × 2) /18 = 1,2 г.
3. а) n(С) = 7,2 г /12 г/моль = 0,6 моль;
б) n(Н) = 1,2 г /1 г/моль = 1,2 моль.
4. а) 0,6: 1,2 = 1: 2, СН2 - простейшая формула;
б) 42 > 14 в 3 раза, ==> C3H6 - истинная формула вещества.
Ответ: C3H6.
Задание 1:
Задача: При сжигании углеводорода (УВ) массой 5,2 г выделилось 17,6г углекислого газа и 3,6 г воды. Относительная плотность этого вещества по водороду 13. Найдите молекулярную формулу УВ.
Среди указанных веществ выберите вещество, которое является ответом, и запишите в тетрадь
СН3 – СН3
СН2 = СН2
СН ≡ СН
Мы определили молекулярную и структурную формулу ацетилена С2Н2.
Класс алкинов еще называют – ацетиленовые углеводороды.
Общая формула алкинов: СnH2n-2
Названия алкинов образуются от названий соответствующих алканов с заменой суффикса – ан на суффикс – ин. В конце названия ставится номер атома углерода, от которого отходит тройная связь.
Отсчет атомов углерода ведется с того конца углеродной цепи, к которому ближе тройная связь.
Пример:
CH3–C≡CH пропин
CH3–C≡C–CH3 бутин – 2
CH3–CH2–CH2–C≡CH пентин - 1
2. Изучим строение ацетилена:
Углеродные атомы в молекуле ацетилена находятся в состоянии sp-гибридизации. Это означает, что каждый атом углерода обладает двумя гибридными sp-орбиталями, оси которых расположены на одной линии под углом 180° друг к другу, а две p-орбитали остаются негибридными.

По одной из двух гибридных орбиталей каждого атома углерода взаимно перекрываются, приводя к образованию s- связи между атомами углерода. Каждая оставшаяся гибридная орбиталь перекрывается с s- орбиталью атома водорода, образуя сигма - связь С–Н.
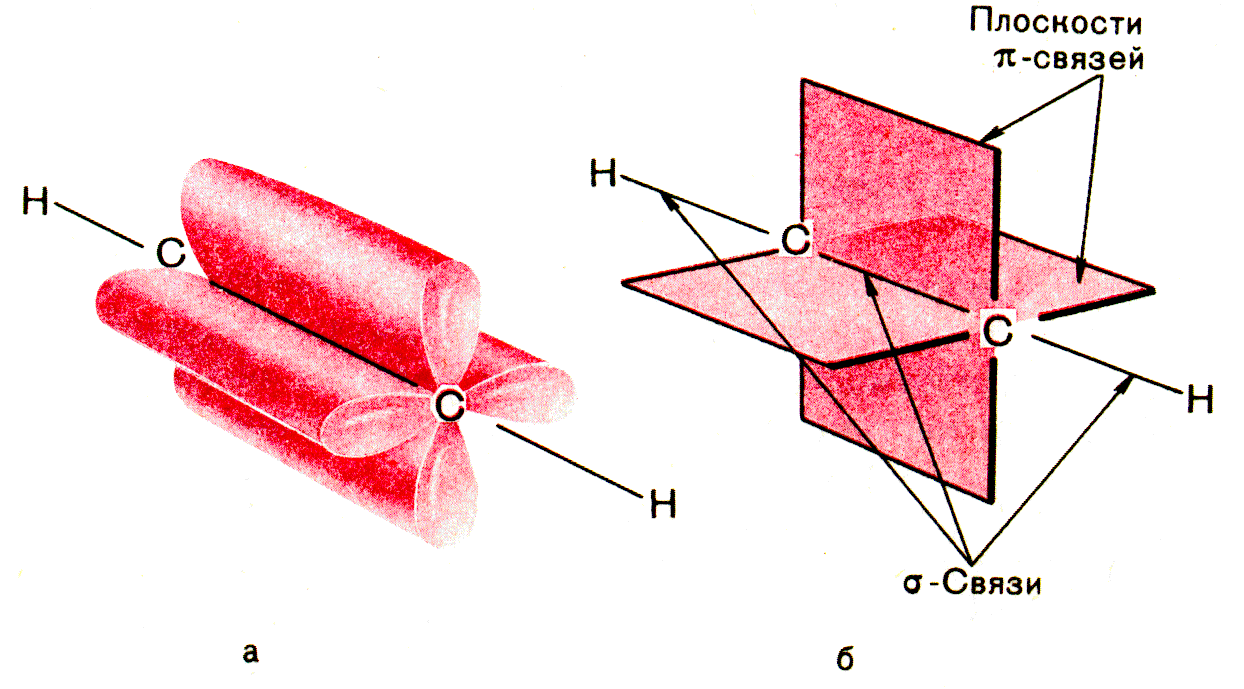 Схематическое
изображение строения молекулы ацетилена
(ядра атомов углерода и водорода на
одной прямой, две p-
связи между атомами углерода находятся
в двух взаимно перпендикулярных
плоскостях)
Схематическое
изображение строения молекулы ацетилена
(ядра атомов углерода и водорода на
одной прямой, две p-
связи между атомами углерода находятся
в двух взаимно перпендикулярных
плоскостях)
3. Изучим способы получения алкинов (все реакции записать в тетрадь)
1) Промышленный способ - карбидный
При
действии на карбид кальция воды
образуется гидроксид
кальция
и ацетилен:
![]()
![]()
2) Пиролиз углеводородов
Суть способа заключается в пропускании над специальной огнеупорной насадкой смеси природного газа с воздухом, который сгорая, поднимает температуру до 1500 °C. Затем на насадке происходит пиролиз метана:
![]()
3) Дегидрирование алканов
CH3 – CH3 ↔ 2H2 + CH º CH
4. Изучим свойства алкинов
Физические свойства. Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных условиях алкины С2Н2-С4Н6 – газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов.
Химические свойства:
1) Горение
2 С2Н2 + 5О2 4СО2 + 2Н2О
В присутствии перманганата калия ацетилен легко окисляется до щавелевой кислоты (обесцвечивание раствора KMnO4 является качественной реакцией на наличие тройной связи).
3C2H2 + 8KMnO4 + 4H2O → 3HOOC-COOH + +8MnO2 + 8KOH
2) Гидротация (Реакция Кучерова)
Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена):
( реакция
записана в структурном виде)
реакция
записана в структурном виде)
С 2Н2 + Н2О СН3СНО (этаналь или уксусный альдегид) (реакция записана в молекулярном виде)
3) Гидрирование
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая p-связь), а затем алканов (разрывается вторая p-связь):
![]()
где R и R, - углеводородные радикалы или атомы водорода (в случае ацетилена)
4) Галогенирование
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая p-связь разрывается труднее, чем вторая):

Алкины обесцвечивают бромную воду (качественная реакция).
5. Полимеризация
5.1 Димеризация под действием водно-аммиачного раствора CuCl:
![]()
5.2 Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
![]()
Задание 2: Написать уравнения реакций:
а) Гидрирования ацетилена (2 стадии)
б) Взаимодействия ацетилена с хлором (2 стадии)
в) Горение пропина
5. Проверим достижение цели - изучить строение, свойства и способы получения алкинов
Выполните самостоятельную работу:
Вариант 1:
1. Написать уравнения реакций по следующей схеме
С2Н4 -4→ С2Н5ОН
↑3
СаС2 -1→ С2Н2 -2→ С6Н6
↓5
СН3СОН
2. В углеводороде массовая доля углерода равна 84%. Относительная плотность паров углеводорода по воздуху равна 3,45. Определите формулу углеводорода.
Вариант 2:
1. Составьте структурные формулы:
а) 3,3 – диметил – 4,5 – дихлорпентин -1
б) 2,5,5 – триэтилоктин – 3
в) 1 - бром – 3,4,5 – триметилгексин - 1
2. Массовая доля углерода в углеводороде составляет 83,33%. Плотность паров углеводорода по водороду равна 36. Определите формулу.
Вариант 3:
1. Напишите уравнения реакций по схеме:
С аСО3 СаО СаС2 С2Н2 СН3СНО
2. Массовая доля углерода в углеводороде составляет 85,7%. Плотность паров углеводорода по воздуху равна 1,931. Определите формулу.
Вариант 4:
1. Напишите уравнения реакций по схеме:
М етан ацетилен этилен этан углекислый газ
2. Какой объем ацетилена (н.у.) необходимо затратить для получения бензола массой 39 г?
