
- •Дм. 01 Основные химические понятия и законы Руководство по модулю «Основные химические понятия и законы»
- •Ме 1.1 (Занятие № 2)
- •Руководство по ме «Основные химические понятия и законы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.1 «Составить формулы химических соединений. Применить основные законы химии для составления уравнений химических реакций»
- •Самостоятельная работа
- •Ме 1.2 (Занятие № 3)
- •Руководство по ме «Решение задач»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.2 «Решать задачи»
- •Самостоятельная работа
- •Ме 1.3 (Занятие № 4)
- •Руководство по ме «Зачет № 1»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 01Основные химические понятия и законы»
- •Зачетная работа
- •Ме 2.1 (Занятие № 5)
- •Руководство по ме «Периодический закон и Периодическая система химических элементов д.И. Менделеева»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 2.1 «Понять структуру Периодической таблицы химических элементов. Сделать лабораторную работу «Моделирование построения Периодической таблицы химических элементов»
- •Инструкция
- •Самостоятельная работа
- •Ме 2.2 (Занятие № 6)
- •Руководство по ме «Строение атома»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 03 Строение вещества Руководство по модулю «Строение вещества»
- •Ме 3.1 (Занятие № 7)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.2 (Занятие № 8)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.3 (Занятие № 9)
- •6. Заполняется личный дневник студента. Руководство по ме «Металлическая связь. Дисперсные системы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 04 Вода. Растворы. Электролитическая диссоциация Руководство по модулю «Вода. Растворы. Электролитическая диссоциация»
- •Ме 4.1 (Занятие № 10)
- •Руководство по ме «Растворение как физико - химический процесс»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •3.1 Массовая доля
- •3.2 Молярность раствора
- •Самостоятельная работа
- •Ме 4.2 (Занятие № 11)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Плотность и процентное содержание растворов хлорида натрия.
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •Самостоятельная работа
- •Ме 4.3 (Занятие № 12)
- •Руководство по ме «Классифицировать основные классы неорганических веществ с точки зрения теории электролитической диссоциации. Определять сильные и слабые электролиты»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1) Молекулярное уравнение:
- •3) Сокращенное ионно-молекулярное уравнение:
- •Самостоятельная работа
- •Дм. 05 Классификация неорганических соединений и их свойства Руководство по модулю «Классификация неорганических соединений и их свойства»
- •Ме 5.1 (Занятие № 13)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.2 (Занятие № 14)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.3 (Занятие № 15)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Алгоритм написания уравнений реакций гидролиза солей
- •Самостоятельная работа
- •Ме 5.4 (Занятие № 16)
- •Руководство по ме «Контрольная работа»
- •Руководство по оценке действия «Продемонстрировать освоенные действия за I семестр»
- •Контрольная работа
- •Дм. 06 Химические реакции Руководство по модулю « Химические реакции»
- •Ме 6.1 (Занятие № 17)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 6.2 (Занятие № 18)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.3 (Занятие № 19)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.4 (Занятие № 20)
- •Руководство по ме «Зачет № 2»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 06 Химические реакции»
- •Зачетная работа
- •Дм. 07 Металлы и неметаллы Руководство по модулю «Металлы и неметаллы»
- •Ме 7.1 (Занятие № 21)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.2 (Занятие № 22)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.3 (Занятие № 23)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Пример:
- •Некоторые качественные реакции на анионы и катионы
- •Дм. 08 Основные понятия органической химии и теория строения органических соединений Руководство по модулю «Основные понятия органической химии и теория строения органических соединений»
- •Ме 8.1 (Занятие № 24)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 8.2 (Занятие № 25)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Основные положения теории химического строения а.М. Бутлерова
- •1. Атомы в молекулах соединяются в определенном порядке в соответствии в соответствии с их валентностью. (Углерод четырехвалентен).
- •2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул.
- •3. Свойства веществ зависят от взаимного влияния атомов в молекулах.
- •Дм. 09 Углеводороды и их природные источники Руководство по модулю «Углеводороды и их природные источники»
- •Ме 9.1 (Занятие № 26)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Реакции отщепления (дегидрирование)
- •4. Реакции разложения
- •Ме 9.2 (Занятие № 27)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Задание 3: н аписать уравнения реакций в соответствии со схемой: сн4 с2н4 (- сн2 – сн2)n
- •Ме 9.3 (Занятие № 28)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1.1 Решив задачу, определим молекулярную формулу первого представителя гомологического ряда алкинов – ацетилена. Решение задач на определение молекулярной формулы веществ
- •Ме 9.4 (Занятие № 29)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Дм. 10 Кислородосодержащие органические соединения Руководство по модулю «Кислородосодержащие органические соединения»
- •Ме 10.1 (Занятие № 30)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Одноатомные спирты.
- •Многоатомные спирты
- •Ме 10.2 (Занятие № 31)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.3 (Занятие № 32)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.4 (Занятие № 33)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Реагирует с оксидом серебра (I) в аммиачном растворе (реакция “серебряного зеркала”):
- •4. Специфические свойства.
- •Ме 10.5 (Занятие № 34)
- •Руководство по ме «Зачет № 3»
- •Зачетная работа
- •1)Алканов 2)алкинов
- •3)Алкенов 4)аренов
- •1) Бутан 2) бутен 3) бутин 4) бутанол
- •1)Бензина 2) углеводов
- •3) Бутадиена 4) фенола
- •Дм. 11 Азотсодержащие органические соединения. Полимеры Руководство по модулю «Азотсодержащие органические соединения»
- •Ме 11.1 (Занятие № 35)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Номенклатура аминов.
- •2) Взаимодействие с азотистой кислотой:
- •Важнейшие - аминокислоты общей формулы (таблицу переписать в тетрадь)
- •Задание 3: Составить структурные формулы
- •3. Изучим свойства и способы получения аминокислот Свойства аминокислот:
- •Способы получения аминокислот (все уравнения реакций перенести в тетрадь)
- •Химические свойства
- •Ме 11.2 (Занятие № 36)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Изучим конфигурации белков Структура белков
- •1. В образовании какой структуры принимают участие дисульфидные мостики: а) вторичной, б) первичной, в) третичной.
- •Ме 11.3 (Занятие № 37)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Качественные реакции органических соединений
- •Ме 11.4 (Занятие № 38)
- •Руководство по ме «Итоговый зачет»
- •Руководство по оценке действия «Продемонстрировать освоенные действия курсу «Химия»»
- •Зачетная работа
Контрольная ведомость обучающегося гр. ____________
Дисциплина: Химия (на базе основного общего образования).
Задача урока:. Усвоить основные понятия органической химии
ФИО студента __________________________________________
Критерий оценки – студент может самостоятельно выполнить следующие действия |
Да/нет |
Если нет, то что студент должен сделать дополнительно |
Изучить различия и сходство между органическими и неорганическими веществами |
|
|
Вспомнить особенности строения атома углерода |
|
|
Понять основы химического строения молекул органических веществ |
|
|
Достижение цели – усвоить основные понятия органической химии (индивидуальное задание) |
|
|
Результат оценки:
|
||
Подписи оценщиков:
|
Дата проведения оценки: |
|
Руководство
по освоению действия МЕ 8.1 «Усвоить основные понятия органической химии»
Освоим действие – Усвоить основные понятия органической химии
Порядок освоения действия:
1. Изучим различия и сходство между органическими и неорганическими веществами
Еще в древности все вещества, встречающиеся на Земле, делили на две большие группы. К одной группе относили древесину, уксус, спирт, масло, т. е вещества растительного и животного происхождения. Их химики сейчас называют органическими. В другую группу входили соль, серебро, золото, сера, сода, медь это, как теперь известно, – неорганические вещества. Помочь разгадать «тайну» органических веществ удалось А. Лавуазье, который обнаружил, что при прокаливании «минеральных тел» образуются соединения разнообразного состава, а при сжигании «растительных и животных» веществ выделяются чаще всего два продукта – оксид углерода (IV) и вода.
Задание 1. Запишите химические формулы углекислого газа и воды. Какие элементы, входят в состав этих соединений? Какой вывод можно сделать о составе органических веществ? Какие элементы обязательно образуют органические вещества? Ответы на вопросы запишите в тетрадь.
Запишите в тетрадь таблицу 1.
Таблица 1. Различие между органическими и неорганическими соединениями
Органические |
Неорганические |
Количество известных органических соединений исчисляется миллионами |
Количество известных неорганических соединений исчисляется сотнями тысяч |
В состав органических веществ входят: углерод, водород, кислород, реже – азот. Фосфор. Сера, галогены |
Состав неорганических веществ представлен большинством химических элементов периодической системы. |
Большинство химических связей в органических веществах имеет ковалентный характер |
Большинство химических связей имеет ионный характер |
Все органические вещества неустойчивы (выше 400оС) нагреванию |
Многие неорганические соединения устойчивы к сильному нагреванию |
Наряду с некоторыми неорганическими веществами, образуют живую часть Земли (биосферу) |
Образуют неживую часть Земли (гидросферу, литосферу, атмосферу) |
Органическая химия – химия соединений углерода.
Задание 2. Руководствуясь составом органических веществ, выберите органические вещества из предложенного перечня:
С Б К У Р А Е Х Ю М А Г Л Д CO2, HCl, CH3COOH, CaCO3, C7H8, C3H8, KNO3, C2H5NH2, CO, CH3COONH2 , СН2Сl, Na2CO3, C6H12, H2CO3.
Из букв, соответствующих правильным ответам, составьте название органического вещества, входящего в состав большинства продуктов растительного происхождения:
2. Вспомним особенности строения атома углерода
Ядро атома углерода состоит из 12 нуклонов (6 протонов и 6 нейтронов). На относительно большом расстоянии от ядра расположена ближайшая к нему орбиталь, образованная двумя спаренными электронами, – первый энергетический уровень. На втором энергетическом уровне находятся четыре электрона.
При химическом взаимодействии атом переходит в возбужденное состояние. Два электрона сферической внешней орбитали получают дополнительную энергию в виде квантов, изменяют форму своего облака и образуют новые орбитали в форме объемных восьмерок. Таким образом, на внешнем электронном уровне образуются четыре орбитали, одинаковые по форме и энергии (гибридизованные орбитали).
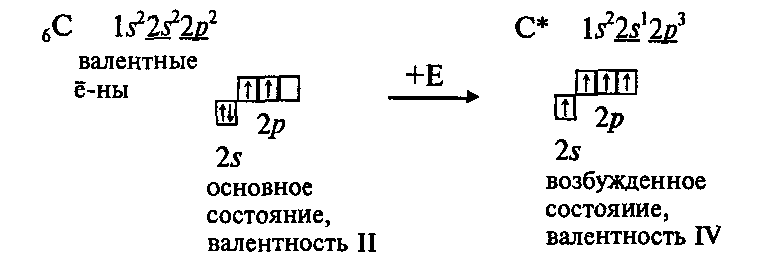
Таким образом, углерод принимает валентность, равную 4, что характерно для этого атома во всех органических соединениях.
3. Изучим основы химического строения молекул органических веществ
Атомы углерода могут соединяться друг с другом. Число связей равно валентности элемента в данном соединении. Углерод образует цепи разной длины (от 1 до 100 атомов), разной формы (линейной, разветвленной, циклической), углерод может образовывать простые, двойные, тройные связи, соединяться с различными элементами.
3.1 Как называется порядок соединения атомов в молекуле?
П орядок
соединения атомов называется химическим
строением. Формулы,
показывающие порядок соединения атомов,
называются структурными формулами.
орядок
соединения атомов называется химическим
строением. Формулы,
показывающие порядок соединения атомов,
называются структурными формулами.
Предположим, структурная формула состоит из 4 –х атомов углерода. Как они могут соединиться в пространстве:

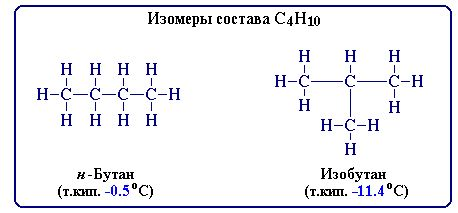
Мы построили изомеры, отличающиеся строением углеродной цепи или, как говорят, углеродного скелета.

Итак, изомеры – это вещества, имеющие одинаковый состав, но разное строение, а, следовательно, и разные свойства.
Изомерию, обусловленную разным строением углеродной цепи, называют структурной.
Задание 3. Укажите, какие из веществ являются изомерами, запишите их в конспект:
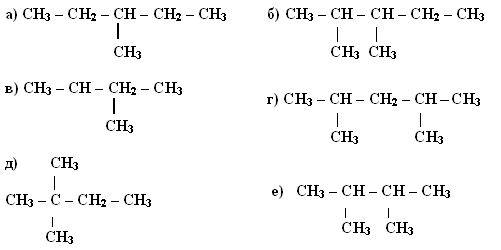
Обоснуйте свой выбор (запишите молекулярные формулы изомеров).
 3.2 Многообразие
и многочисленность органических веществ
объясняется также явлением «гомология».
3.2 Многообразие
и многочисленность органических веществ
объясняется также явлением «гомология».
Вещества, сходные по строению и по свойствам, но отличающиеся друг от друга на группу атомов СН2 – гомологическую разность, называются гомологами.
Задание 4. Среди перечисленных веществ найти гомологи, запишите их в конспект:
4. Проверим достижение цели - усвоить основные понятия органической химии
Выполните самостоятельную работу:
Вариант 1:
1. Составить возможные структурные формулы, состоящие из пяти атомов углерода
Вариант 2:
1. Составить возможные структурные формулы, состоящие из шести атомов углерода
Вариант 3:
1. Составить возможные структурные формулы, состоящие из семи атомов углерода
Вариант 4:
1. Составить возможные структурные формулы, состоящие из восьми атомов углерода
