
- •Дм. 01 Основные химические понятия и законы Руководство по модулю «Основные химические понятия и законы»
- •Ме 1.1 (Занятие № 2)
- •Руководство по ме «Основные химические понятия и законы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.1 «Составить формулы химических соединений. Применить основные законы химии для составления уравнений химических реакций»
- •Самостоятельная работа
- •Ме 1.2 (Занятие № 3)
- •Руководство по ме «Решение задач»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.2 «Решать задачи»
- •Самостоятельная работа
- •Ме 1.3 (Занятие № 4)
- •Руководство по ме «Зачет № 1»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 01Основные химические понятия и законы»
- •Зачетная работа
- •Ме 2.1 (Занятие № 5)
- •Руководство по ме «Периодический закон и Периодическая система химических элементов д.И. Менделеева»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 2.1 «Понять структуру Периодической таблицы химических элементов. Сделать лабораторную работу «Моделирование построения Периодической таблицы химических элементов»
- •Инструкция
- •Самостоятельная работа
- •Ме 2.2 (Занятие № 6)
- •Руководство по ме «Строение атома»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 03 Строение вещества Руководство по модулю «Строение вещества»
- •Ме 3.1 (Занятие № 7)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.2 (Занятие № 8)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.3 (Занятие № 9)
- •6. Заполняется личный дневник студента. Руководство по ме «Металлическая связь. Дисперсные системы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 04 Вода. Растворы. Электролитическая диссоциация Руководство по модулю «Вода. Растворы. Электролитическая диссоциация»
- •Ме 4.1 (Занятие № 10)
- •Руководство по ме «Растворение как физико - химический процесс»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •3.1 Массовая доля
- •3.2 Молярность раствора
- •Самостоятельная работа
- •Ме 4.2 (Занятие № 11)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Плотность и процентное содержание растворов хлорида натрия.
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •Самостоятельная работа
- •Ме 4.3 (Занятие № 12)
- •Руководство по ме «Классифицировать основные классы неорганических веществ с точки зрения теории электролитической диссоциации. Определять сильные и слабые электролиты»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1) Молекулярное уравнение:
- •3) Сокращенное ионно-молекулярное уравнение:
- •Самостоятельная работа
- •Дм. 05 Классификация неорганических соединений и их свойства Руководство по модулю «Классификация неорганических соединений и их свойства»
- •Ме 5.1 (Занятие № 13)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.2 (Занятие № 14)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.3 (Занятие № 15)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Алгоритм написания уравнений реакций гидролиза солей
- •Самостоятельная работа
- •Ме 5.4 (Занятие № 16)
- •Руководство по ме «Контрольная работа»
- •Руководство по оценке действия «Продемонстрировать освоенные действия за I семестр»
- •Контрольная работа
- •Дм. 06 Химические реакции Руководство по модулю « Химические реакции»
- •Ме 6.1 (Занятие № 17)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 6.2 (Занятие № 18)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.3 (Занятие № 19)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.4 (Занятие № 20)
- •Руководство по ме «Зачет № 2»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 06 Химические реакции»
- •Зачетная работа
- •Дм. 07 Металлы и неметаллы Руководство по модулю «Металлы и неметаллы»
- •Ме 7.1 (Занятие № 21)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.2 (Занятие № 22)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.3 (Занятие № 23)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Пример:
- •Некоторые качественные реакции на анионы и катионы
- •Дм. 08 Основные понятия органической химии и теория строения органических соединений Руководство по модулю «Основные понятия органической химии и теория строения органических соединений»
- •Ме 8.1 (Занятие № 24)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 8.2 (Занятие № 25)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Основные положения теории химического строения а.М. Бутлерова
- •1. Атомы в молекулах соединяются в определенном порядке в соответствии в соответствии с их валентностью. (Углерод четырехвалентен).
- •2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул.
- •3. Свойства веществ зависят от взаимного влияния атомов в молекулах.
- •Дм. 09 Углеводороды и их природные источники Руководство по модулю «Углеводороды и их природные источники»
- •Ме 9.1 (Занятие № 26)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Реакции отщепления (дегидрирование)
- •4. Реакции разложения
- •Ме 9.2 (Занятие № 27)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Задание 3: н аписать уравнения реакций в соответствии со схемой: сн4 с2н4 (- сн2 – сн2)n
- •Ме 9.3 (Занятие № 28)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1.1 Решив задачу, определим молекулярную формулу первого представителя гомологического ряда алкинов – ацетилена. Решение задач на определение молекулярной формулы веществ
- •Ме 9.4 (Занятие № 29)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Дм. 10 Кислородосодержащие органические соединения Руководство по модулю «Кислородосодержащие органические соединения»
- •Ме 10.1 (Занятие № 30)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Одноатомные спирты.
- •Многоатомные спирты
- •Ме 10.2 (Занятие № 31)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.3 (Занятие № 32)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.4 (Занятие № 33)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Реагирует с оксидом серебра (I) в аммиачном растворе (реакция “серебряного зеркала”):
- •4. Специфические свойства.
- •Ме 10.5 (Занятие № 34)
- •Руководство по ме «Зачет № 3»
- •Зачетная работа
- •1)Алканов 2)алкинов
- •3)Алкенов 4)аренов
- •1) Бутан 2) бутен 3) бутин 4) бутанол
- •1)Бензина 2) углеводов
- •3) Бутадиена 4) фенола
- •Дм. 11 Азотсодержащие органические соединения. Полимеры Руководство по модулю «Азотсодержащие органические соединения»
- •Ме 11.1 (Занятие № 35)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Номенклатура аминов.
- •2) Взаимодействие с азотистой кислотой:
- •Важнейшие - аминокислоты общей формулы (таблицу переписать в тетрадь)
- •Задание 3: Составить структурные формулы
- •3. Изучим свойства и способы получения аминокислот Свойства аминокислот:
- •Способы получения аминокислот (все уравнения реакций перенести в тетрадь)
- •Химические свойства
- •Ме 11.2 (Занятие № 36)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Изучим конфигурации белков Структура белков
- •1. В образовании какой структуры принимают участие дисульфидные мостики: а) вторичной, б) первичной, в) третичной.
- •Ме 11.3 (Занятие № 37)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Качественные реакции органических соединений
- •Ме 11.4 (Занятие № 38)
- •Руководство по ме «Итоговый зачет»
- •Руководство по оценке действия «Продемонстрировать освоенные действия курсу «Химия»»
- •Зачетная работа
Руководство по освоению действия ме 1.2 «Решать задачи»
Освоим действие – решать задачи на нахождение относительной молекулярной массы, определение массовой доли химических элементов в сложном веществе
Порядок освоения действия:
1. Вспомнить порядок действий по определению молекулярной массы вещества.
Порядок действий:
1. Определим, из каких элементов состоит вещество
2. Определим количество элементов, из которых состоит вещество
3. По таблице химических элементов Д.И. Менделеева определяем атомные массы элементов, из которых состоит вещество
4. Определим молярную массу вещества, сложив атомные массы элементов с учетом индексов.
Пример: Определить относительную молекулярную массу молекулы воды Н2О
1.Молекула воды состоит из атомов водорода и кислорода
2. В молекулу воды входят два атома водорода и один атом кислорода.
3. Атомная масса водорода 1 а.е.м.; кислорода – 15,999, округляем до целого значения числа - 16 а.е.м.
4.
Проводим сложение: Мr(Н2О)
= 2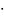 1
+ 16 = 18, а молярная масса воды 18 г/моль
1
+ 16 = 18, а молярная масса воды 18 г/моль
Задание № 1: Определить относительную молекулярную массу молекул: фосфорной кислоты Н3РО4; гидроксида натрия NaOH; карбоната калия К2СО3
2.Учимся определять массовую долю элементов, входящих в вещество по известной химической формуле
Массовая доля элемента (wЭ) в общей массе сложного вещества - это отношение массы, приходящейся на этот элемент (то есть массы части), к массе всего вещества (то есть к массе целого).
wЭ
=
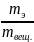 (1.2.1)
(1.2.1)
Массовая доля элемента - это доля от единицы или от 100%. В сложном веществе wэ всегда меньше единицы (или меньше 100%).
Порядок действий:
1. Определяем относительную молекулярную массу вещества
2. Проводим вычисления по формуле 1.2.1
Пример: Определить массовую долю элементов, входящих в молекулу воды Н2О
Мr(Н2О) = 2 1 + 16 = 18
wн
=
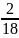 = 0,11 или 11%
= 0,11 или 11%
wо
=
 0,89 или 89%
0,89 или 89%
Задание № 2: Определить массовую долю элементов в молекулах: фосфорной кислоты Н3РО4; гидроксида натрия NaOH; карбоната калия К2СО3
3. Учимся определять массу вещества, участвующего в реакции
Правила решения задач:
Сначала записываем числовые данные из условия задачи – массу вещества, или объем газа. Затем выясняем, что нужно определить в той задаче, и записываем вопрос под условием задачи.
Определяем количества веществ, массы или объемы которых даны в условии задачи.
Записываем уравнение реакции, о которой сказано в условии задачи и расставляем в нем коэффициенты.
Вычисленное количество вещества записываем над формулой этого вещества в уравнении реакции.
Учитывая коэффициенты, определяем количества тех веществ, массы или объемы которых нужно определить в данной задаче.
По найденным количествам веществ рассчитываем массы или объемы этих веществ.
Проверяем, на все ли поставленные вопросы условия задачи найдены ответы.
Записываем ответы задачи.
Пример: В реакцию с соляной кислотой вступило 13 г цинка. Определите массы израсходованной кислоты и полученной соли.
Дано:
m (Zn)
= 13 г
(Zn)
= 13 г
m (HCl) - ?;
m (ZnCl2) -?
Решение:
1. Находим количество вещества цинка, разделив его массу на молярную массу:
n(Zn) = m : M = 13 г : 65 г/моль = 0,2 моль
2. Вносим эту величину в уравнение реакции и с ее помощью определяем количества всех указанных в задаче веществ (с учетом коэффициентов):
0,2 моль 0,4 моль 0,2 моль 0,2 моль
Zn + 2HCl = ZnCl2 + Н2
3. Далее расчеты по формулам:
m(HCl) = M n = 36,5 г/моль 0,4 моль = 14,6 г
m(ZnCl2) = M n = 136 г/моль 0,2 моль = 27,2 г
Задание № 3: Решить задачу: Определите массу оксида углерода (IV), образующуюся в результате полного сгорания 24 г углерода, а также массу израсходованного при этом кислорода.
4. Учимся определять объем вещества, участвующего в реакции
(алгоритм решения приведен выше)
Пример: В реакцию с соляной кислотой вступило 13 г цинка. Определите объем выделившегося водорода (н.у.)
Дано:
m (Zn) = 13 г
V (H2) - ?;
Решение:
1. Находим количество вещества цинка, разделив его массу на молярную массу:
n(Zn) = m : M = 13 г : 65 г/моль = 0,2 моль
2. Вносим эту величину в уравнение реакции и с ее помощью определяем количества всех указанных в задаче веществ (с учетом коэффициентов):
0,2 моль 0,4 моль 0,2 моль 0,2 моль
Zn + 2HCl = ZnCl2 + Н2
3. Т.к. в условии задачи дано указание на н.у. (нормальные условия), то пользуемся формулой
V
= Vм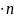
Vм = 22,4 л/моль
V (H2) = 22,4 л/моль 0,2 моль = 4,48 л
Задание № 4: Решить задачу: Определите объем оксида углерода (IV), образующийся в результате полного сгорания 24 г углерода, а также объем израсходованного при этом кислорода.
5.Проверим достижение цели - уметь решать задачи на нахождение относительной молекулярной массы и массовой доли химических элементов в сложном веществе
Выполните самостоятельную работу.
