
- •Дм. 01 Основные химические понятия и законы Руководство по модулю «Основные химические понятия и законы»
- •Ме 1.1 (Занятие № 2)
- •Руководство по ме «Основные химические понятия и законы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.1 «Составить формулы химических соединений. Применить основные законы химии для составления уравнений химических реакций»
- •Самостоятельная работа
- •Ме 1.2 (Занятие № 3)
- •Руководство по ме «Решение задач»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.2 «Решать задачи»
- •Самостоятельная работа
- •Ме 1.3 (Занятие № 4)
- •Руководство по ме «Зачет № 1»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 01Основные химические понятия и законы»
- •Зачетная работа
- •Ме 2.1 (Занятие № 5)
- •Руководство по ме «Периодический закон и Периодическая система химических элементов д.И. Менделеева»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 2.1 «Понять структуру Периодической таблицы химических элементов. Сделать лабораторную работу «Моделирование построения Периодической таблицы химических элементов»
- •Инструкция
- •Самостоятельная работа
- •Ме 2.2 (Занятие № 6)
- •Руководство по ме «Строение атома»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 03 Строение вещества Руководство по модулю «Строение вещества»
- •Ме 3.1 (Занятие № 7)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.2 (Занятие № 8)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.3 (Занятие № 9)
- •6. Заполняется личный дневник студента. Руководство по ме «Металлическая связь. Дисперсные системы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 04 Вода. Растворы. Электролитическая диссоциация Руководство по модулю «Вода. Растворы. Электролитическая диссоциация»
- •Ме 4.1 (Занятие № 10)
- •Руководство по ме «Растворение как физико - химический процесс»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •3.1 Массовая доля
- •3.2 Молярность раствора
- •Самостоятельная работа
- •Ме 4.2 (Занятие № 11)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Плотность и процентное содержание растворов хлорида натрия.
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •Самостоятельная работа
- •Ме 4.3 (Занятие № 12)
- •Руководство по ме «Классифицировать основные классы неорганических веществ с точки зрения теории электролитической диссоциации. Определять сильные и слабые электролиты»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1) Молекулярное уравнение:
- •3) Сокращенное ионно-молекулярное уравнение:
- •Самостоятельная работа
- •Дм. 05 Классификация неорганических соединений и их свойства Руководство по модулю «Классификация неорганических соединений и их свойства»
- •Ме 5.1 (Занятие № 13)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.2 (Занятие № 14)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.3 (Занятие № 15)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Алгоритм написания уравнений реакций гидролиза солей
- •Самостоятельная работа
- •Ме 5.4 (Занятие № 16)
- •Руководство по ме «Контрольная работа»
- •Руководство по оценке действия «Продемонстрировать освоенные действия за I семестр»
- •Контрольная работа
- •Дм. 06 Химические реакции Руководство по модулю « Химические реакции»
- •Ме 6.1 (Занятие № 17)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 6.2 (Занятие № 18)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.3 (Занятие № 19)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.4 (Занятие № 20)
- •Руководство по ме «Зачет № 2»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 06 Химические реакции»
- •Зачетная работа
- •Дм. 07 Металлы и неметаллы Руководство по модулю «Металлы и неметаллы»
- •Ме 7.1 (Занятие № 21)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.2 (Занятие № 22)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.3 (Занятие № 23)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Пример:
- •Некоторые качественные реакции на анионы и катионы
- •Дм. 08 Основные понятия органической химии и теория строения органических соединений Руководство по модулю «Основные понятия органической химии и теория строения органических соединений»
- •Ме 8.1 (Занятие № 24)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 8.2 (Занятие № 25)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Основные положения теории химического строения а.М. Бутлерова
- •1. Атомы в молекулах соединяются в определенном порядке в соответствии в соответствии с их валентностью. (Углерод четырехвалентен).
- •2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул.
- •3. Свойства веществ зависят от взаимного влияния атомов в молекулах.
- •Дм. 09 Углеводороды и их природные источники Руководство по модулю «Углеводороды и их природные источники»
- •Ме 9.1 (Занятие № 26)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Реакции отщепления (дегидрирование)
- •4. Реакции разложения
- •Ме 9.2 (Занятие № 27)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Задание 3: н аписать уравнения реакций в соответствии со схемой: сн4 с2н4 (- сн2 – сн2)n
- •Ме 9.3 (Занятие № 28)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1.1 Решив задачу, определим молекулярную формулу первого представителя гомологического ряда алкинов – ацетилена. Решение задач на определение молекулярной формулы веществ
- •Ме 9.4 (Занятие № 29)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Дм. 10 Кислородосодержащие органические соединения Руководство по модулю «Кислородосодержащие органические соединения»
- •Ме 10.1 (Занятие № 30)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Одноатомные спирты.
- •Многоатомные спирты
- •Ме 10.2 (Занятие № 31)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.3 (Занятие № 32)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.4 (Занятие № 33)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Реагирует с оксидом серебра (I) в аммиачном растворе (реакция “серебряного зеркала”):
- •4. Специфические свойства.
- •Ме 10.5 (Занятие № 34)
- •Руководство по ме «Зачет № 3»
- •Зачетная работа
- •1)Алканов 2)алкинов
- •3)Алкенов 4)аренов
- •1) Бутан 2) бутен 3) бутин 4) бутанол
- •1)Бензина 2) углеводов
- •3) Бутадиена 4) фенола
- •Дм. 11 Азотсодержащие органические соединения. Полимеры Руководство по модулю «Азотсодержащие органические соединения»
- •Ме 11.1 (Занятие № 35)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Номенклатура аминов.
- •2) Взаимодействие с азотистой кислотой:
- •Важнейшие - аминокислоты общей формулы (таблицу переписать в тетрадь)
- •Задание 3: Составить структурные формулы
- •3. Изучим свойства и способы получения аминокислот Свойства аминокислот:
- •Способы получения аминокислот (все уравнения реакций перенести в тетрадь)
- •Химические свойства
- •Ме 11.2 (Занятие № 36)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Изучим конфигурации белков Структура белков
- •1. В образовании какой структуры принимают участие дисульфидные мостики: а) вторичной, б) первичной, в) третичной.
- •Ме 11.3 (Занятие № 37)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Качественные реакции органических соединений
- •Ме 11.4 (Занятие № 38)
- •Руководство по ме «Итоговый зачет»
- •Руководство по оценке действия «Продемонстрировать освоенные действия курсу «Химия»»
- •Зачетная работа
Контрольная ведомость обучающегося гр. ____________
Дисциплина: Химия (на базе основного общего образования).
Задача урока:. Иметь понятие об электрохимическом ряде напряжений металлов, о металлургии, сплавах черных и цветных
ФИО студента __________________________________________
Критерий оценки – студент может самостоятельно выполнить следующие действия |
Да/нет |
Если нет, то что студент должен сделать дополнительно |
Вспомнить основные свойства металлов |
|
|
Изучить строение электрохимического ряда напряжений металлов |
|
|
Вспомнить основы металлургии, сплавы черные и цветные |
|
|
Научиться проводить качественные реакции на ионы железа |
|
|
Изучить структуры серого и белого чугуна |
|
|
Достижение цели – иметь понятие об электрохимическом ряде напряжений металлов, о металлургии, сплавах черных и цветных (индивидуальное задание) |
|
|
Результат оценки:
|
||
Подписи оценщиков:
|
Дата проведения оценки: |
|
Руководство
по освоению действия МЕ 7.1 «Иметь понятие об электрохимическом ряде напряжений металлов, о металлургии, сплавах черных и цветных»
Освоим действие – Иметь понятие об электрохимическом ряде напряжений металлов, о металлургии, сплавах черных и цветных
Порядок освоения действия:
1. Вспомним основные свойства металлов
Все основные свойства металлов условно можно подразделить на следующие группы: химические, физические и механические.
Механические свойства характеризуют способность металлов и сплавов сопротивляться действию приложенных к ним нагрузок, а механические характеристики выражают эти свойства количественно.
Основными механическими свойствами металлов являются; прочность, пластичность (или вязкость), твердость, ударная вязкость, износоустойчивость и др.
К физическим свойствам металлов относят удельный вес, температуру плавления, цвет, электропроводность, теплопроводность, теплоемкость, расширяемость при нагревании, магнитные свойства и некоторые другие.
В химическом отношении все металлы характеризуются сравнительной легкостью отдачи валентных электронов и способностью образовывать положительно заряженные ионы. Следовательно, металлы в свободном состоянии являются восстановителями.
Характерными свойствами для металлов являются следующие: Атомы металлов способны при химических реакциях отдавать валентные электроны превращаться в «+» ионы, т. е. металлы, являются восстановителями.
Реагируют с галогенами
Кислородом
Серой.
Электроотрицательность этих неметаллов велика, по сравнению с металлами
Восстановление неметаллов
Реакции с галогенами и кислородом воздуха протекают с различными скоростями и при различных температурах с разными металлами.
Многие металлы образуют на поверхности оксидную пленку, которая защищает их от дальнейшего окисления. 2Мg + О2 = 2МgО 4Аl + ЗО2 = 2А12О3 2К + Сl2 = 2КСl Менее энергично металлы взаимодействуют с серой, образуя сульфиды: Сu + S = СuS Fе + S = FеS Трудно вступают в реакцию с азотом и фосфором: ЗМg + N2 = Мg3N2 (нитрид магния) ЗСа + 2Р = Са3Р2 (фосфид кальция) Активные металлы взаимодействуют с водородом: Са + Н2 = СаН2 (гидрид кальция) Взаимодействие с водой Активные металлы (щелочные металлы) взаимодействуют с водой при обычных условиях с образованием гидроксидов и выделением водорода: 2Nа + 2Н2О == 2NаОН + Н2 Са + 2Н2О = Са(ОН)2 + Н2 2Аl + 6Н2O = 2Аl(ОН)3 + ЗН2
Задание № 1: Написать уравнения реакций взаимодействия калия с водой; магния с кислородом; алюминия с серной кислотой.
2. Изучим строение электрохимического ряда напряжений металлов
Восстановительная способность различных металлов неодинакова и определяется положением в электрохимическом ряду напряжения металлов:
Li K Rb Cs Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb Н Cu Hg Ag Pt Au
Металлы размещены в порядке убывания их восстановительных свойств и усиления окислительных свойств их ионов.
Металлы, находящиеся в ряду напряжений левее водорода, способны вытеснить водород из кислот.
Задание № 2: Пользуясь электрохимическим рядом напряжения допишите реакции, прохождение которых возможно:
а ) Сu + HCl
б ) Zn + Fe2(SO4)3
в ) Ag + H2 SO4
г ) Al + HNO3
д ) Ca + AlPO4
3. Вспомним основы металлургии, сплавы черные и цветные
Металлургия (от греч. Metallurgeo - добываю руду, обрабатываю металлы), область науки, техники и отрасль промышленности, включающие производство металлов из природного сырья (в частности, руд) и др. металлсодержащих продуктов (в том числе из отходов производств металлических материалов, сплавов и изделий), получение сплавов, обработку металлов в горячем и холодном состоянии, сварку. а также нанесение покрытий из металлов.
Сплавы — сложные материалы, получаемые путем сплавления одного металла с другими металлами или неметаллами.
Наиболее распространенными металлическими материалами в промышленности являются сплавы железа с углеродом — стали и чугуны. Такие сплавы получили наименование черные металлы.
К наиболее важным цветным металлам относятся алюминий, медь, магний, никель, титан и мягкие металлы - олово, свинец и цинк. В сплавах часто используются такие металлы, как сурьма, висмут, кадмий, ртуть, кобальт, хром, молибден, вольфрам и ванадий.
Сплавы на основе меди: латунь (Cu + Zn), бронза (Cu + Sn + Al + Mn и т.д.), мельхиор (Cu + Ni), нейзильбер (Cu + Ni + Zn). Дюралюминий (Al + Cu + Mn).
4. Учимся определять наличие ионов Fe2+ и Fe3+ в растворе их солей
Задания:
1. Провести качественные реакции на ионы железа.
2. Результаты работы оформить в таблице.
№ п/п |
Исходные вещества (формулы) |
Наблюдения |
Уравнения реакций ( в молекулярной и ионной формах) |
Выводы |
Вещества:
Растворы сульфата железа (II), хлорида железа (III), роданида калия (KCNS) , гексацианоферрата калия ( К3Fe(CN)6 ).
Соли железа (II) являются восстановителями. На воздухе в присутствии воды они постепенно окисляются в соли железа (III). Качественной реакцией на ионы железа (II) является реакция с комплексной солью – гексацианоферрат калия. При взаимодействии ее с солями железа (II) образуется темно - синий осадок (турнбулева синь).
2 К3[ Fe(CN)6] + 3FeSO4 Fe3[Fe(CN)6]2 + 3К2SO4
Ионы железа (III) можно открыть с помощью тиоционата (роданида) калия KCNS, например:
F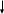 eCl3
+ 3KCNS = Fe(CNS)3
+ 3KCl
eCl3
+ 3KCNS = Fe(CNS)3
+ 3KCl
Опыт 1: В 2 мл раствора сульфата железа (II) внесите 2-3 капли раствора гексацианоферрата калия. Опишите свои наблюдения.
Опыт 2: В пробирку налейте 1 -2 мл раствора хлорида железа (III) и добавьте раствор роданида калия.
5. Выполним лабораторную работу № 4 «Изучить структуры серого и белого чугуна»
Все до задания 6 записать в конспект:
Классификация чугуна осуществляется по следующим признакам:
по состоянию углерода -- свободный или связанный;
по форме включений графита -- пластинчатый, вермикулярный, шаровидный, хлопьевидный;
по типу структуры металлической основы (матрицы) - ферритный, перлитный; имеются также чугуны со смешанной структурой: например феррито-перлитные;
по химическому составу - нелегированные чугуны (общего назначения) и легированные чугуны (специального назначения).
В зависимости от формы выделения углерода в чугуне различают:
белый чугун, в котором весь углерод находится в связанном состоянии в виде цементита Fe3C;
- половинчатый чугун, в котором основное количество углерода (более 0,8 %) находится в виде цементита;
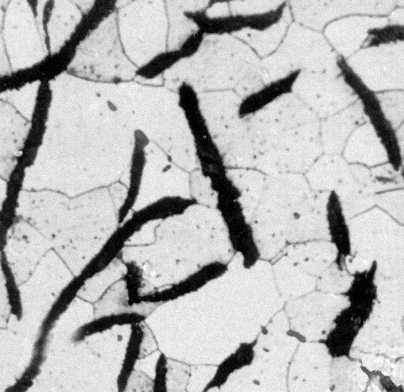
серый чугун, в котором весь углерод или его большая часть находится в свободном состоянии в виде пластинчатого графита; и т.д.
Структура белого чугуна (зарисовать в конспект)
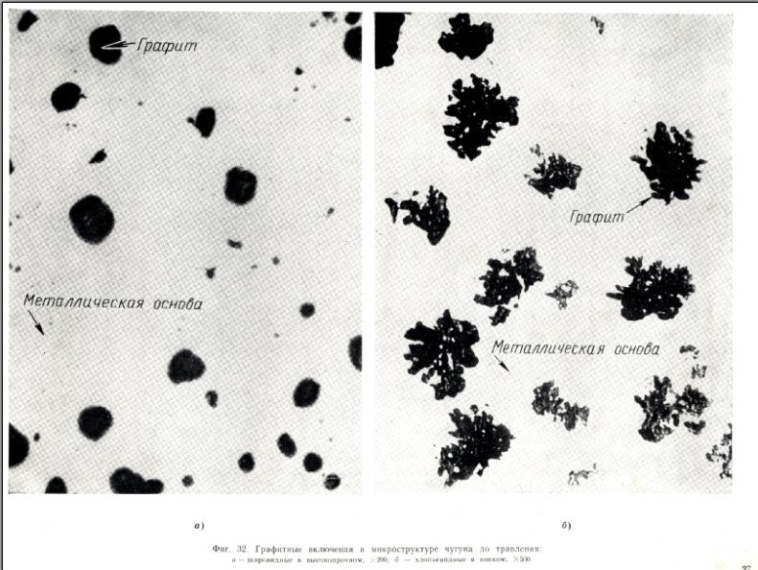
Структура серого чугуна (зарисовать в конспект)
6. Проверим достижение цели - иметь понятие об электрохимическом ряде напряжений металлов, о металлургии, сплавах черных и цветных
Выполните самостоятельную работу:
Вариант 1:
1. Сколько литров водорода (н. у.) потребуется для восстановления 6,4 г меди из оксида меди (II)?
2. Написать уравнения взаимодействия:
а) натрия с серной кислотой
б) цинка с азотной кислотой
3. На смесь алюминия и меди массой 6 грамм подействовали соляной кислотой. При этом выделился газ объемом 3,36 л (нормальные условия). Определите массовые доли металлов в смеси.
Вариант 2:
1. Написать уравнения взаимодействия:
а) железа (II) с соляной кислотой
б) цинка с нитратом серебра
2. Сколько граммов сульфида железа(II) образуется при взаимодействии 5,6 г железа с избытком серы?
3. Какой объем водорода (н.у.) выделится при взаимодействии 137 г цинка, содержащего 5 % примесей, с соляной кислотой?
Вариант 3:
1. Написать уравнения взаимодействия:
а) магния с соляной кислотой
б) бария с нитратом меди
2. Какой объем оксида углерода(II) (н.у.) потребуется для восстановления 4 г оксида железа(III)?
3. Смесь порошком железа (II) и меди массой 10 г обработали раствором соляной кислоты, при этом выделился газ объемом 2, 24 л. Определите массовые доли металлов в смеси.
Вариант 4:
1. Определите массу цинка, необходимого для взаимодействия с раствором, который содержит 19,6 г серной кислоты.
2. Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
С а Са(ОН)2 СаСО3
3. Определите массу алюминия, который потребуется для получения 78 г хрома из оксида хрома(III) алюминотермическим методом (восстановление алюминием).
