
- •Дм. 01 Основные химические понятия и законы Руководство по модулю «Основные химические понятия и законы»
- •Ме 1.1 (Занятие № 2)
- •Руководство по ме «Основные химические понятия и законы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.1 «Составить формулы химических соединений. Применить основные законы химии для составления уравнений химических реакций»
- •Самостоятельная работа
- •Ме 1.2 (Занятие № 3)
- •Руководство по ме «Решение задач»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.2 «Решать задачи»
- •Самостоятельная работа
- •Ме 1.3 (Занятие № 4)
- •Руководство по ме «Зачет № 1»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 01Основные химические понятия и законы»
- •Зачетная работа
- •Ме 2.1 (Занятие № 5)
- •Руководство по ме «Периодический закон и Периодическая система химических элементов д.И. Менделеева»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 2.1 «Понять структуру Периодической таблицы химических элементов. Сделать лабораторную работу «Моделирование построения Периодической таблицы химических элементов»
- •Инструкция
- •Самостоятельная работа
- •Ме 2.2 (Занятие № 6)
- •Руководство по ме «Строение атома»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 03 Строение вещества Руководство по модулю «Строение вещества»
- •Ме 3.1 (Занятие № 7)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.2 (Занятие № 8)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.3 (Занятие № 9)
- •6. Заполняется личный дневник студента. Руководство по ме «Металлическая связь. Дисперсные системы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 04 Вода. Растворы. Электролитическая диссоциация Руководство по модулю «Вода. Растворы. Электролитическая диссоциация»
- •Ме 4.1 (Занятие № 10)
- •Руководство по ме «Растворение как физико - химический процесс»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •3.1 Массовая доля
- •3.2 Молярность раствора
- •Самостоятельная работа
- •Ме 4.2 (Занятие № 11)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Плотность и процентное содержание растворов хлорида натрия.
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •Самостоятельная работа
- •Ме 4.3 (Занятие № 12)
- •Руководство по ме «Классифицировать основные классы неорганических веществ с точки зрения теории электролитической диссоциации. Определять сильные и слабые электролиты»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1) Молекулярное уравнение:
- •3) Сокращенное ионно-молекулярное уравнение:
- •Самостоятельная работа
- •Дм. 05 Классификация неорганических соединений и их свойства Руководство по модулю «Классификация неорганических соединений и их свойства»
- •Ме 5.1 (Занятие № 13)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.2 (Занятие № 14)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.3 (Занятие № 15)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Алгоритм написания уравнений реакций гидролиза солей
- •Самостоятельная работа
- •Ме 5.4 (Занятие № 16)
- •Руководство по ме «Контрольная работа»
- •Руководство по оценке действия «Продемонстрировать освоенные действия за I семестр»
- •Контрольная работа
- •Дм. 06 Химические реакции Руководство по модулю « Химические реакции»
- •Ме 6.1 (Занятие № 17)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 6.2 (Занятие № 18)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.3 (Занятие № 19)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.4 (Занятие № 20)
- •Руководство по ме «Зачет № 2»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 06 Химические реакции»
- •Зачетная работа
- •Дм. 07 Металлы и неметаллы Руководство по модулю «Металлы и неметаллы»
- •Ме 7.1 (Занятие № 21)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.2 (Занятие № 22)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.3 (Занятие № 23)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Пример:
- •Некоторые качественные реакции на анионы и катионы
- •Дм. 08 Основные понятия органической химии и теория строения органических соединений Руководство по модулю «Основные понятия органической химии и теория строения органических соединений»
- •Ме 8.1 (Занятие № 24)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 8.2 (Занятие № 25)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Основные положения теории химического строения а.М. Бутлерова
- •1. Атомы в молекулах соединяются в определенном порядке в соответствии в соответствии с их валентностью. (Углерод четырехвалентен).
- •2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул.
- •3. Свойства веществ зависят от взаимного влияния атомов в молекулах.
- •Дм. 09 Углеводороды и их природные источники Руководство по модулю «Углеводороды и их природные источники»
- •Ме 9.1 (Занятие № 26)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Реакции отщепления (дегидрирование)
- •4. Реакции разложения
- •Ме 9.2 (Занятие № 27)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Задание 3: н аписать уравнения реакций в соответствии со схемой: сн4 с2н4 (- сн2 – сн2)n
- •Ме 9.3 (Занятие № 28)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1.1 Решив задачу, определим молекулярную формулу первого представителя гомологического ряда алкинов – ацетилена. Решение задач на определение молекулярной формулы веществ
- •Ме 9.4 (Занятие № 29)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Дм. 10 Кислородосодержащие органические соединения Руководство по модулю «Кислородосодержащие органические соединения»
- •Ме 10.1 (Занятие № 30)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Одноатомные спирты.
- •Многоатомные спирты
- •Ме 10.2 (Занятие № 31)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.3 (Занятие № 32)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.4 (Занятие № 33)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Реагирует с оксидом серебра (I) в аммиачном растворе (реакция “серебряного зеркала”):
- •4. Специфические свойства.
- •Ме 10.5 (Занятие № 34)
- •Руководство по ме «Зачет № 3»
- •Зачетная работа
- •1)Алканов 2)алкинов
- •3)Алкенов 4)аренов
- •1) Бутан 2) бутен 3) бутин 4) бутанол
- •1)Бензина 2) углеводов
- •3) Бутадиена 4) фенола
- •Дм. 11 Азотсодержащие органические соединения. Полимеры Руководство по модулю «Азотсодержащие органические соединения»
- •Ме 11.1 (Занятие № 35)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Номенклатура аминов.
- •2) Взаимодействие с азотистой кислотой:
- •Важнейшие - аминокислоты общей формулы (таблицу переписать в тетрадь)
- •Задание 3: Составить структурные формулы
- •3. Изучим свойства и способы получения аминокислот Свойства аминокислот:
- •Способы получения аминокислот (все уравнения реакций перенести в тетрадь)
- •Химические свойства
- •Ме 11.2 (Занятие № 36)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Изучим конфигурации белков Структура белков
- •1. В образовании какой структуры принимают участие дисульфидные мостики: а) вторичной, б) первичной, в) третичной.
- •Ме 11.3 (Занятие № 37)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Качественные реакции органических соединений
- •Ме 11.4 (Занятие № 38)
- •Руководство по ме «Итоговый зачет»
- •Руководство по оценке действия «Продемонстрировать освоенные действия курсу «Химия»»
- •Зачетная работа
Контрольная ведомость обучающегося гр. ____________
Дисциплина: Химия (на базе основного общего образования).
Задача урока: По окончанию занятия вы должны решать задачи на определение скорости химических реакций. Понимать сущность реакций ионного обмена
ФИО студента __________________________________________
Критерий оценки – студент может самостоятельно выполнить следующие действия |
Да/нет |
Если нет, то что студент должен сделать дополнительно |
Давать определение скорости химической реакции |
|
|
Решать задачи на определение скорости химической реакции |
|
|
Сделать лабораторную работу «Реакции ионного обмена» |
|
|
Достижение цели – Решать задачи на определение скорости химических реакций. Понимать сущность реакций ионного обмена (индивидуальное задание) |
|
|
Результат оценки:
|
||
Подписи оценщиков:
|
Дата проведения оценки: |
|
Руководство
по освоению действия МЕ 6.3 «Решать задач на определение скорости химических реакций. Проводить и доказывать уравнениями реакций реакции ионного обмена»
Освоим действие – Решать задач на определение скорости химических реакций
Проводить и доказывать уравнениями реакций реакции ионного обмена
Порядок освоения действия:
1. Дадим определение скорости химической реакции
Скорость химической реакции
(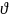 )
характеризуется изменением концентрации
реагирующих веществ (моль/л или моль/см3)
в единицу времени (сек., мин., ч.).
)
характеризуется изменением концентрации
реагирующих веществ (моль/л или моль/см3)
в единицу времени (сек., мин., ч.).
=
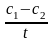 моль/л • с
моль/л • с
Для гомогенной (однородной) системы скорость химической реакции измеряется количеством веществ, вступивших в реакцию или образовавшихся в результате реакции за единицу времени в единице объема системы. Для гетерогенной системы скорость химической реакции измеряется количеством веществ, вступивших в реакцию или образовавшихся в результате реакции за единицу времени на единице поверхности раздела фаз.
Факторы, влияющие на скорость химической реакции
1) Природа реагирующих веществ (характер связи в молекулах реагентов);
2) Концентрация реагентов;
3) Температура;
4) Катализатор;
5) Давление (для газов);
6) Излучение (ИК-, УФ-, рентгеновское, радиоактивное и др.);
7) Площадь поверхности раздела фаз (для гетерогенных реакций).
1). Зависимость скорости химической реакции от концентрации реагирующих веществ определяется законом действующих масс:
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ с учетом их коэффициентов.
mA + nB = C
= к [а]m [В]n – кинетическое уравнение реакции,
где к - константа скорости (величина постоянная для данной реакции), m и n - коэффициенты уравнения реакции.
Пример:
Составим кинетическое уравнение реакции окисления оксида азота (II) до оксида азота (III)
4NO + O2 = 2N2O3
= k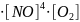
Задание № 1: Составить кинетические уравнения для следующих реакций:
1). 2NO + O2 = 2NO2
2). Zn + 2HCl = H2↑ + ZnCl2
3). 4Al + 3O2 = 2Al2O3
2. Учимся решать задачи на определение скорости реакции
Пример:
Задача. Определить во сколько раз увеличиться скорость реакции образования воды из простых веществ при увеличении концентрации водорода в два раза.
Д ано: Решение:
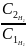 = 2 1.
Записываем уравнение получения воды
из простых веществ:
= 2 1.
Записываем уравнение получения воды
из простых веществ:
2Н2 + О2 = 2Н2О
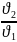 = ?
= ?
2. В соответствие с законом действующих масс определяем выражение для скорости первой реакции
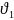 = k
= k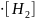 2•[O2]
2•[O2]
3. Т.к.
концентрация водорода увеличилась, то
выражение для
 будет следующим:
будет следующим:
= k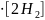 2•[O2]
2•[O2]
4. Запишем математическое выражение для отношения скоростей:
=
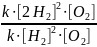 =
=
 = 4
= 4
Ответ: Скорость реакции увеличится в 4 раза.
Задание № 2. Задача. Определить во сколько раз увеличиться скорость реакции образования аммиака (NH3) из простых веществ при увеличении концентрации водорода в три раза.
2). Зависимость скорости реакции от температуры определяется правилом Вант - Гоффа. При повышении температуры на 10° скорость реакции увеличивается в 2- 4 раза.
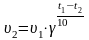 ,
где
,
где
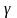 - температурный коэффициент скорости
реакции.
- температурный коэффициент скорости
реакции.
Пример:
Задача. Определить, как возрастет скорость реакции при повышении температуры с 20 до 50°С, если температурный коэффициент равен 3.
Д ано: Решение:
t1 = 20oC Согласно правила Вант – Гоффа
t2 = 50oC
=
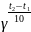
= ? = 33 = 27
Ответ: Скорость реакции увеличится в 27 раз.
Задание № 3. Задача. Определить, как возрастет скорость реакции при повышении температуры с 30 до 70°С, если температурный коэффициент равен 2.
Делаем лабораторную работу «Реакции ионного обмена»
Цель работы: Научиться выполнять лабораторные опыты по проведению реакций ионного обмена, составлять молекулярные, полные и сокращенные ионные уравнения необратимых реакций.
Задания:
1. Провести качественные реакции на сульфат-, карбонат- ионы, ионы железа и меди.
2. Описать наблюдения и составить уравнения проведенных реакций.
3. Результаты лабораторной работы оформите в виде таблицы.
№ п/п |
Исходные вещества (формулы) |
Наблюдения |
Уравнения реакций ( в молекулярной и ионной формах) |
Выводы |
Оборудование:
Штатив с пробирками.
Вещества:
Растворы карбоната, гидроксида натрия; хлорида бария; сульфата железа (II); сульфата меди; серной кислоты.
Ход работы:
Опыт 1: Налейте в пробирку 1 мл раствора карбоната натрия и столько же раствора серной кислоты (осторожно!).
Опыт 2: Налейте в пробирку 1- 2 мл раствора хлорида бария и столько же раствора серной кислоты.
Опыт 3: Налейте в пробирку 1 - 2 мл раствора сульфата железа и столько же раствора гидроксида натрия.
Опыт 4: Налейте в пробирку 1 - 2 мл раствора сульфата меди и столько же раствора гидроксида натрия.
4. Проверим достижение цели - решать задачи на определение скорости химических реакций. Понимать сущность реакций ионного обмена
Выполните самостоятельную работу:
Вариант 1:
1. Написать уравнения в молекулярной и ионных формах между:
а) соляной кислотой и нитратом серебра
б) нитратом бария и серной кислотой
Вариант 2.
1.Написать данные уравнения в полной и сокращенной ионной формах:
а) CuSO4 + BaCl2 = BaSO4↓ + CuCl2
б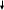 )
Na2CO3
+ BaCl2
= BaCO3 +
2NaCl
)
Na2CO3
+ BaCl2
= BaCO3 +
2NaCl
Вариант 3.
1. Написать уравнения в молекулярной и ионных формах между:
а) карбонатом калия и азотной кислотой
б) гидроксидом натрия и сульфатом меди (II)
Вариант 4.
1. Написать данные уравнения в полной и сокращенной ионной формах:
б) FeCl3 + 3 NaOH = Fe(OH)3 + 3 NaCl
в) BaCl2 + K2SO4 = BaSO4 + 2 KCl
