
- •Дм. 01 Основные химические понятия и законы Руководство по модулю «Основные химические понятия и законы»
- •Ме 1.1 (Занятие № 2)
- •Руководство по ме «Основные химические понятия и законы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.1 «Составить формулы химических соединений. Применить основные законы химии для составления уравнений химических реакций»
- •Самостоятельная работа
- •Ме 1.2 (Занятие № 3)
- •Руководство по ме «Решение задач»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.2 «Решать задачи»
- •Самостоятельная работа
- •Ме 1.3 (Занятие № 4)
- •Руководство по ме «Зачет № 1»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 01Основные химические понятия и законы»
- •Зачетная работа
- •Ме 2.1 (Занятие № 5)
- •Руководство по ме «Периодический закон и Периодическая система химических элементов д.И. Менделеева»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 2.1 «Понять структуру Периодической таблицы химических элементов. Сделать лабораторную работу «Моделирование построения Периодической таблицы химических элементов»
- •Инструкция
- •Самостоятельная работа
- •Ме 2.2 (Занятие № 6)
- •Руководство по ме «Строение атома»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 03 Строение вещества Руководство по модулю «Строение вещества»
- •Ме 3.1 (Занятие № 7)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.2 (Занятие № 8)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.3 (Занятие № 9)
- •6. Заполняется личный дневник студента. Руководство по ме «Металлическая связь. Дисперсные системы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 04 Вода. Растворы. Электролитическая диссоциация Руководство по модулю «Вода. Растворы. Электролитическая диссоциация»
- •Ме 4.1 (Занятие № 10)
- •Руководство по ме «Растворение как физико - химический процесс»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •3.1 Массовая доля
- •3.2 Молярность раствора
- •Самостоятельная работа
- •Ме 4.2 (Занятие № 11)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Плотность и процентное содержание растворов хлорида натрия.
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •Самостоятельная работа
- •Ме 4.3 (Занятие № 12)
- •Руководство по ме «Классифицировать основные классы неорганических веществ с точки зрения теории электролитической диссоциации. Определять сильные и слабые электролиты»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1) Молекулярное уравнение:
- •3) Сокращенное ионно-молекулярное уравнение:
- •Самостоятельная работа
- •Дм. 05 Классификация неорганических соединений и их свойства Руководство по модулю «Классификация неорганических соединений и их свойства»
- •Ме 5.1 (Занятие № 13)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.2 (Занятие № 14)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.3 (Занятие № 15)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Алгоритм написания уравнений реакций гидролиза солей
- •Самостоятельная работа
- •Ме 5.4 (Занятие № 16)
- •Руководство по ме «Контрольная работа»
- •Руководство по оценке действия «Продемонстрировать освоенные действия за I семестр»
- •Контрольная работа
- •Дм. 06 Химические реакции Руководство по модулю « Химические реакции»
- •Ме 6.1 (Занятие № 17)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 6.2 (Занятие № 18)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.3 (Занятие № 19)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.4 (Занятие № 20)
- •Руководство по ме «Зачет № 2»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 06 Химические реакции»
- •Зачетная работа
- •Дм. 07 Металлы и неметаллы Руководство по модулю «Металлы и неметаллы»
- •Ме 7.1 (Занятие № 21)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.2 (Занятие № 22)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.3 (Занятие № 23)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Пример:
- •Некоторые качественные реакции на анионы и катионы
- •Дм. 08 Основные понятия органической химии и теория строения органических соединений Руководство по модулю «Основные понятия органической химии и теория строения органических соединений»
- •Ме 8.1 (Занятие № 24)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 8.2 (Занятие № 25)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Основные положения теории химического строения а.М. Бутлерова
- •1. Атомы в молекулах соединяются в определенном порядке в соответствии в соответствии с их валентностью. (Углерод четырехвалентен).
- •2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул.
- •3. Свойства веществ зависят от взаимного влияния атомов в молекулах.
- •Дм. 09 Углеводороды и их природные источники Руководство по модулю «Углеводороды и их природные источники»
- •Ме 9.1 (Занятие № 26)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Реакции отщепления (дегидрирование)
- •4. Реакции разложения
- •Ме 9.2 (Занятие № 27)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Задание 3: н аписать уравнения реакций в соответствии со схемой: сн4 с2н4 (- сн2 – сн2)n
- •Ме 9.3 (Занятие № 28)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1.1 Решив задачу, определим молекулярную формулу первого представителя гомологического ряда алкинов – ацетилена. Решение задач на определение молекулярной формулы веществ
- •Ме 9.4 (Занятие № 29)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Дм. 10 Кислородосодержащие органические соединения Руководство по модулю «Кислородосодержащие органические соединения»
- •Ме 10.1 (Занятие № 30)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Одноатомные спирты.
- •Многоатомные спирты
- •Ме 10.2 (Занятие № 31)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.3 (Занятие № 32)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.4 (Занятие № 33)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Реагирует с оксидом серебра (I) в аммиачном растворе (реакция “серебряного зеркала”):
- •4. Специфические свойства.
- •Ме 10.5 (Занятие № 34)
- •Руководство по ме «Зачет № 3»
- •Зачетная работа
- •1)Алканов 2)алкинов
- •3)Алкенов 4)аренов
- •1) Бутан 2) бутен 3) бутин 4) бутанол
- •1)Бензина 2) углеводов
- •3) Бутадиена 4) фенола
- •Дм. 11 Азотсодержащие органические соединения. Полимеры Руководство по модулю «Азотсодержащие органические соединения»
- •Ме 11.1 (Занятие № 35)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Номенклатура аминов.
- •2) Взаимодействие с азотистой кислотой:
- •Важнейшие - аминокислоты общей формулы (таблицу переписать в тетрадь)
- •Задание 3: Составить структурные формулы
- •3. Изучим свойства и способы получения аминокислот Свойства аминокислот:
- •Способы получения аминокислот (все уравнения реакций перенести в тетрадь)
- •Химические свойства
- •Ме 11.2 (Занятие № 36)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Изучим конфигурации белков Структура белков
- •1. В образовании какой структуры принимают участие дисульфидные мостики: а) вторичной, б) первичной, в) третичной.
- •Ме 11.3 (Занятие № 37)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Качественные реакции органических соединений
- •Ме 11.4 (Занятие № 38)
- •Руководство по ме «Итоговый зачет»
- •Руководство по оценке действия «Продемонстрировать освоенные действия курсу «Химия»»
- •Зачетная работа
3.1 Массовая доля
Массовая доля растворенного вещества в растворе ω, % это – отношение массы вещества к массе раствора:
![]()
Пример: Нальем в стакан 150г воды и растворим в ней 50г сахара. Какой станет масса раствора?
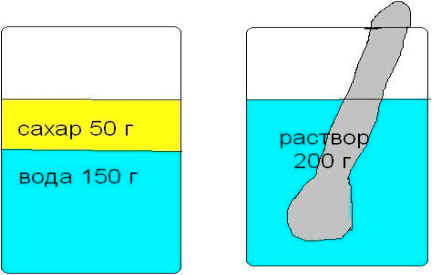
Введем следующие обозначения:
mраствора = 50г + 150г = 200г – масса общая.
mвещества.= 50г – масса чистого вещества.
Определим массовую долю сахара в растворе:
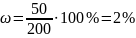
Пример: Определить массовую долю хлорида кальция, если 10 г его растворены в 130 мл воды.
Дано:
m (CaCl2) = 10 г
V воды = 130 мл
- ?
Решение:
Плотность воды 1г/мл, тогда m(H2O) = 130 г.
mр-ра = m(H2O) + mрастворенного вещества = 130 + 10 = 140 г
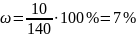
Задание № 1: Задача. Сколько граммов гидроксида натрия содержится в растворе массой 250 г с массовой долей NaOH 20%.
3.2 Молярность раствора
Молярность раствора– число молей растворенного вещества в одном литре раствора.
Единица измерения моль/л или М
С
=

Пример: Сколько граммов Na2СО3 содержится в 0,1 М растворе объемом 200 мл?
Дано:
С = 0,1 М
Vр-ра = 200 мл = 0,2 л
m(Na2СО3) -?
Решение:
С
=
 Из этой формулы, выведем
Из этой формулы, выведем
m
= C V
V
М (Na2СО3) = 2 23 + 12 + 3 16 = 106 г/моль
m(Na2СО3)
= 0,1
 = 2,12 г
= 2,12 г
Задание № 2: Задача. Раствор объемом 500 мл содержит гидроксид калия массой 14 г. Определить молярную концентрацию этого раствора.
4. Проверим достижение цели - Определить растворение как физико-химический процесс. Знать классификацию растворов
Выполните самостоятельную работу.
Самостоятельная работа
Вариант №1
Решить задачи.
1. Сколько соли надо растворить в воде массой 2 кг, чтобы получить раствор с массовой долей 20%?
2.Раствор объемом 0,75л содержит хлорид калия массой 4.4 г. Чему равна молярная концентрация раствора?
Вариант №2
Решить задачи.
1. Определите молярную концентрацию раствора Н3РО4, в 500 мл которого содержится 9,8 г фосфорной кислоты.
2. Сколько соли надо добавить к воде массой 350 г для приготовления раствора с массой долей соли 30%?
Вариант №3
Решить задачи.
1. Рассчитайте массу соляной кислоты, содержащейся в растворе объемом 0,25 л, где молярная концентрация кислоты равна 1 моль/л.
2. Сколько граммов нитрата калия надо растворить в воде массой 150 г, чтобы получить раствор с массовой долей соли 5%.
Вариант №2
Решить задачи.
1. Медный купорос массой 50 г растворили в воде массой 350г. Какова массовая доля (в %) соли в растворе.
2. Определите молярную концентрацию раствора азотной кислоты массой 6,3 г в растворе плотностью 1,25 кг/л.
Ме 4.2 (Занятие № 11)
Тема урока: Решение задач на определение концентрации растворов
Цель: Решить задачи на определение концентрации растворов. Готовить растворы заданной концентрации
Методы: Работа в парах, самостоятельное изучение теории.
Материальные ресурсы: руководство по модульной единице (МЕ), руководство по текущей оценке МЕ, описание элементарных действий, практическая работа, самостоятельная работа, учебник (Ерохин Ю.М. Химия. – М., 2003, Глава 6, § 1)
Последовательность видов учебной деятельности:
1. Вступительное слово преподавателя (краткое представление порядка изучения модульной единицы, план текущей оценки, ведение личного дневника, сбор свидетельств для портфолио, оценка по МЕ).
2. Студенты формируют пары по 2 человека, сидящие за одной партой, знакомятся с руководством по МЕ.
3. В парах осваивают действие в указанном порядке, оценивают освоение действия друг другом, для этого по мере освоения этапов действия в индивидуальных ведомостях необходимо сделать отметки «Да» или «Нет».
4. После достижения цели, для получения оценки за урок студенты выполняют индивидуальное задание (самостоятельную работу), которое проверяется и оценивается преподавателем.
5. Преподаватель проверяет работы и выставляет каждому за урок оценку.
6. Заполняется личный дневник студента.
Руководство по МЕ «Решение задач на определение концентрации растворов»
Задача - По окончанию занятия вы должны решать задачи на определение концентрации растворов. Готовить растворы заданной концентрации
Действие – Решить задачи на определение концентрации растворов. Готовить растворы заданной концентрации
Порядок освоения действия:
1. Решить задачи на определение концентрации растворов
2. Сделать практическую работу «Приготовление раствора заданной концентрации»
3. Достижение цели – решать задачи на определение концентрации растворов. Готовить растворы заданной концентрации
Продолжительность 40 мин.
Руководство по оценке действия «Решить задачи на определение концентрации растворов. Готовить растворы заданной концентрации»
Работая в паре, вы должны оценить освоение действия друг другом, для этого по мере освоения этапов действия в индивидуальных ведомостях необходимо сделать отметки «Да» или «Нет».
После достижения цели, для получения оценки за урок необходимо выполнить индивидуальное задание, которое предварительно проверяется и оценивается партнером, а затем, окончательно – преподавателем:
Выполнили правильно все задания – отлично освоили действие;
Выполнили правильно практическую работу и 1 задание – хорошо освоили действие;
Выполнили правильно задания – удовлетворительно освоили действие;
Выполнили менее двух заданий – не освоили действие.
Продолжительность 20 минут.
Ведение личного дневника студента.
Запишите в тетради свои впечатления о занятии:
1. Что вы освоили за урок?
2. Что вам не понятно?
3. Что осваивалось легко?
4. Что осваивалось тяжело?
5. Каких знаний вам не хватало?
Чтобы вам проще было оценить результаты урока, попробуйте ответить на контрольные вопросы:
1. Основные способы определения концентрации растворов?
2. Что такое молярная концентрация, единицы ее измерения?
3. Что такое массовая доля вещества в растворе?
Продолжительность 10 мин.
Домашнее задание.
1. Повторить материал, знаний которого вам не хватило при освоении действия.
2. Сборник задач и упражнений по химии. Ерохин Ю.М., Фролов В.И. Сборник задач и упражнений по химии (с дидактическим материалом): учеб. пособие для студентов средн. проф. завед. – М., 2004, стр. 72. № 2, стр.73 № 20)
