
- •Дм. 01 Основные химические понятия и законы Руководство по модулю «Основные химические понятия и законы»
- •Ме 1.1 (Занятие № 2)
- •Руководство по ме «Основные химические понятия и законы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.1 «Составить формулы химических соединений. Применить основные законы химии для составления уравнений химических реакций»
- •Самостоятельная работа
- •Ме 1.2 (Занятие № 3)
- •Руководство по ме «Решение задач»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.2 «Решать задачи»
- •Самостоятельная работа
- •Ме 1.3 (Занятие № 4)
- •Руководство по ме «Зачет № 1»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 01Основные химические понятия и законы»
- •Зачетная работа
- •Ме 2.1 (Занятие № 5)
- •Руководство по ме «Периодический закон и Периодическая система химических элементов д.И. Менделеева»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 2.1 «Понять структуру Периодической таблицы химических элементов. Сделать лабораторную работу «Моделирование построения Периодической таблицы химических элементов»
- •Инструкция
- •Самостоятельная работа
- •Ме 2.2 (Занятие № 6)
- •Руководство по ме «Строение атома»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 03 Строение вещества Руководство по модулю «Строение вещества»
- •Ме 3.1 (Занятие № 7)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.2 (Занятие № 8)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.3 (Занятие № 9)
- •6. Заполняется личный дневник студента. Руководство по ме «Металлическая связь. Дисперсные системы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 04 Вода. Растворы. Электролитическая диссоциация Руководство по модулю «Вода. Растворы. Электролитическая диссоциация»
- •Ме 4.1 (Занятие № 10)
- •Руководство по ме «Растворение как физико - химический процесс»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •3.1 Массовая доля
- •3.2 Молярность раствора
- •Самостоятельная работа
- •Ме 4.2 (Занятие № 11)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Плотность и процентное содержание растворов хлорида натрия.
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •Самостоятельная работа
- •Ме 4.3 (Занятие № 12)
- •Руководство по ме «Классифицировать основные классы неорганических веществ с точки зрения теории электролитической диссоциации. Определять сильные и слабые электролиты»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1) Молекулярное уравнение:
- •3) Сокращенное ионно-молекулярное уравнение:
- •Самостоятельная работа
- •Дм. 05 Классификация неорганических соединений и их свойства Руководство по модулю «Классификация неорганических соединений и их свойства»
- •Ме 5.1 (Занятие № 13)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.2 (Занятие № 14)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.3 (Занятие № 15)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Алгоритм написания уравнений реакций гидролиза солей
- •Самостоятельная работа
- •Ме 5.4 (Занятие № 16)
- •Руководство по ме «Контрольная работа»
- •Руководство по оценке действия «Продемонстрировать освоенные действия за I семестр»
- •Контрольная работа
- •Дм. 06 Химические реакции Руководство по модулю « Химические реакции»
- •Ме 6.1 (Занятие № 17)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 6.2 (Занятие № 18)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.3 (Занятие № 19)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.4 (Занятие № 20)
- •Руководство по ме «Зачет № 2»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 06 Химические реакции»
- •Зачетная работа
- •Дм. 07 Металлы и неметаллы Руководство по модулю «Металлы и неметаллы»
- •Ме 7.1 (Занятие № 21)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.2 (Занятие № 22)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.3 (Занятие № 23)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Пример:
- •Некоторые качественные реакции на анионы и катионы
- •Дм. 08 Основные понятия органической химии и теория строения органических соединений Руководство по модулю «Основные понятия органической химии и теория строения органических соединений»
- •Ме 8.1 (Занятие № 24)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 8.2 (Занятие № 25)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Основные положения теории химического строения а.М. Бутлерова
- •1. Атомы в молекулах соединяются в определенном порядке в соответствии в соответствии с их валентностью. (Углерод четырехвалентен).
- •2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул.
- •3. Свойства веществ зависят от взаимного влияния атомов в молекулах.
- •Дм. 09 Углеводороды и их природные источники Руководство по модулю «Углеводороды и их природные источники»
- •Ме 9.1 (Занятие № 26)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Реакции отщепления (дегидрирование)
- •4. Реакции разложения
- •Ме 9.2 (Занятие № 27)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Задание 3: н аписать уравнения реакций в соответствии со схемой: сн4 с2н4 (- сн2 – сн2)n
- •Ме 9.3 (Занятие № 28)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1.1 Решив задачу, определим молекулярную формулу первого представителя гомологического ряда алкинов – ацетилена. Решение задач на определение молекулярной формулы веществ
- •Ме 9.4 (Занятие № 29)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Дм. 10 Кислородосодержащие органические соединения Руководство по модулю «Кислородосодержащие органические соединения»
- •Ме 10.1 (Занятие № 30)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Одноатомные спирты.
- •Многоатомные спирты
- •Ме 10.2 (Занятие № 31)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.3 (Занятие № 32)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.4 (Занятие № 33)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Реагирует с оксидом серебра (I) в аммиачном растворе (реакция “серебряного зеркала”):
- •4. Специфические свойства.
- •Ме 10.5 (Занятие № 34)
- •Руководство по ме «Зачет № 3»
- •Зачетная работа
- •1)Алканов 2)алкинов
- •3)Алкенов 4)аренов
- •1) Бутан 2) бутен 3) бутин 4) бутанол
- •1)Бензина 2) углеводов
- •3) Бутадиена 4) фенола
- •Дм. 11 Азотсодержащие органические соединения. Полимеры Руководство по модулю «Азотсодержащие органические соединения»
- •Ме 11.1 (Занятие № 35)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Номенклатура аминов.
- •2) Взаимодействие с азотистой кислотой:
- •Важнейшие - аминокислоты общей формулы (таблицу переписать в тетрадь)
- •Задание 3: Составить структурные формулы
- •3. Изучим свойства и способы получения аминокислот Свойства аминокислот:
- •Способы получения аминокислот (все уравнения реакций перенести в тетрадь)
- •Химические свойства
- •Ме 11.2 (Занятие № 36)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Изучим конфигурации белков Структура белков
- •1. В образовании какой структуры принимают участие дисульфидные мостики: а) вторичной, б) первичной, в) третичной.
- •Ме 11.3 (Занятие № 37)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Качественные реакции органических соединений
- •Ме 11.4 (Занятие № 38)
- •Руководство по ме «Итоговый зачет»
- •Руководство по оценке действия «Продемонстрировать освоенные действия курсу «Химия»»
- •Зачетная работа
Контрольная ведомость обучающегося гр. ____________
Дисциплина: Химия (на базе основного общего образования).
Задача урока:. Определять тип химической связи. Классифицировать и делать дисперсные системы
ФИО студента __________________________________________
Критерий оценки – студент может самостоятельно выполнить следующие действия |
Да/нет |
Если нет, то что студент должен сделать дополнительно |
Определить механизм образования металлической связи |
|
|
Объяснить состав смесей |
|
|
Классифицировать дисперсные системы |
|
|
Сделать лабораторную работу «Приготовление суспензии карбоната кальция в воде» |
|
|
Решать задачи на определение объемной и массовой доли компонентов смеси, массовой доля примесей |
|
|
Достижение цели – определять тип химической связи. Классифицировать и делать дисперсные системы (индивидуальное задание) |
|
|
Результат оценки:
|
||
Подписи оценщиков:
|
Дата проведения оценки: |
|
Руководство
по освоению действия МЕ 2.1 «Определять тип химической связи. Классифицировать и делать дисперсные системы»
Освоим действие – Определять тип химической связи. Классифицировать и делать дисперсные системы
Порядок освоения действия:
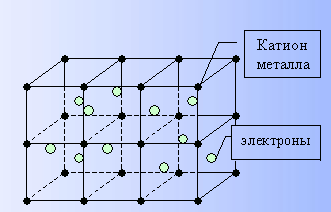
1. Изучим механизм образования металлической связи
Металлическая связь существует в металлах в твердом и в жидком состоянии.
В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов (1-3 электрона) и низкую энергию ионизации (отрыва электрона). Поэтому валентные электроны слабо удерживаются в атоме, легко отрываются и имеют возможность перемещаться по всему кристаллу. В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные ионы, а часть валентных электронов, свободно перемещаясь в объеме кристаллической решетки, образует «электронный газ», обеспечивающий связь между атомами металла.
Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью.
Металлическая
связь возникает за счет обобществления
атомами валентных электронов. Электроны,
осуществляющие связь, перемещаются по
всему куску металла. Этим определяются
общие признаки металлов: металлический
блеск, хорошая проводимость теплоты и
электричества, ковкость, пластичность
и т. д.
Пример: Определить характер химической связи в хлориде алюминия.
№ п/п |
Последовательность действий |
Выполнение действий |
1. |
Запишите формулу вещества. |
AlCl3 |
2. |
По таблице электроотрицательностей элементов (табл. 1 ) найти электроотрицательности элементов алюминия и хлора1[1]. |
Электроотрицательность Al = 1,5 Электроотрицательность хлора равна 3,0 |
3. |
Найти разность электроотрицательностей |
3,0-1,5=1,5 |
4. |
Воспользовавшись правилом: Если разница электроотрицательностей связи больше 1,3 связи могут считаться ионными, определить характер связи. |
Данная связь относится к ионной связи |
Задание № 1 Определить характер химической связи в молекуле аммиака NH3
2
Чистые вещества - вещества, не изменяющие своих физических свойств и не разделяющиеся на два или более других веществ.
. Изучим состав смесей
Смеси бывают: - однородные (или гомогенные), у которых происходит дробление всех составляющих веществ до отдельных молекул и до ионов (частицы смеси нельзя обнаружить оптическими средствами) - неоднородные (или гетерогенные разного состава), частицы которых могут быть обнаружены оптическими средствами
3. Изучим, что такое «дисперсные системы» и научимся их классифицировать
Дисперсные системы - гетерогенные системы из двух или большего числа фаз с сильно развитой поверхностью раздела между ними.
В дисперсных системах различают дисперсную фазу (мелкораздробленное вещество) и дисперсионную среду (однородное вещество, в котором распределена дисперсная фаза). Все дисперсные системы отличаются друг от друга прежде всего размерами частиц, т.е. степенью дисперсности (раздробленности). Например, в тумане дисперсная фаза - частички жидкости, дисперсионная среда - воздух; в молоке - дисперсная фаза - частички жира, дисперсионная среда - жидкость и т. д. К дисперсным двухфазным системам относятся: - истинные (или обычные) растворы; - коллоидные растворы ; - суспензии ; - эмульсии.
Суспензии - дисперсные системы, в которых дисперсной фазой является твердое вещество (измельченное до тонкого порошка с размером частиц 10-7 - 10-5 м), равномерно распределенное в виде мельчайших частиц в жидкой дисперсионной среде во взвешенном состоянии, причем твердое вещество практически нерастворимо в жидкости.
Задание № 2: Приведите примеры суспензий.
Эмульсии - дисперсные системы, в которых дисперсные фаза и среда являются взаимно не смешивающимися жидкостями (или иначе - это неоднородная система, состоящая из капель жидкости, распределенных между молекулами другой жидкости). Размер частиц в эмульсиях- (10-7-10-5 м).
Задание № 3: Приведите примеры эмульсий.
4. Выполним лабораторную работу «Приготовление суспензии карбоната кальция в воде»
Цель: Научится приготавливать суспензии и эмульсии.
Вещества: Карбонат кальция СаСО2 (мел), растительное масло, вода.
Ход работы:
1. Налейте в две пробирки по 1 мл воды
1.1 Добавьте в одну из них 1 г истолченного мела, слегка размешайте. Обратите внимание на процесс, происходящий в пробирке. Поставьте пробирку в штатив и через 1-2 мин. отметьте изменения, произошедшие в пробирке.
1.2 В другую пробирку добавьте 0,5 мл растительного масла. Обратите внимание на процесс, происходящий в пробирке. Поставьте пробирку в штатив и через 1-2 мин. отметьте изменения, произошедшие в пробирке.
2. Таблицу перечертите в тетрадь. Результаты работы занесите в таблицу.
№ опыта |
Исходные вещества |
Наблюдения |
Выводы |
|
|
|
|
|
|
|
|
5. Учимся решать задачи на определение объемной и массовой доли компонентов смеси, массовой доля примесей
Массовой долей компонента в системе (ωв) называют безразмерную физическую величину равную отношению массы компонента (mв ) к общей массе системы

Объемная доля компонента в системе (φ) – безразмерная величина равная отношению приведенного объема компонента к общему объему системы (V):
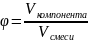
Пример: Задача. Определить массовую и объемную долю углекислого газа массой 25 г в воздухе объемом 1 м3 при н.у.
Д ано:
m (CО2) = 25 г
Vвоздуха = 1 м3 = 1000 л
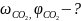
Решение:
Молярная масса воздуха 29 г/моль.
Согласно закона Авагадро 1 моль любого газа при н.у. занимает объем 22,4 л
Определим количество моль воздуха
n =

Определим массу 1 м3 воздуха
m = 45 22,4 = 1008 г
Определим массовую долю углекислого газа
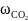 =
=
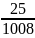 = 0,03 или 3%
= 0,03 или 3%
Определим молярную массу углекислого газа
М (СО2) = 44г/моль
Определим количество моль СО2
n =
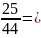 0,6 моль
0,6 моль
Определим объем данного количества углекислого газа
V (CO2) = 0,6 22,4 = 13,44 л
Определим объемную долю углекислого газа
 =
=
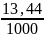 = 0,013 или 1,3%
= 0,013 или 1,3%
Задача. Определить массу химически активного карбида кальция, если в 160 г технического карбида кальция содержится 8 % примесей.
Дано:
m (CаС2 техн.) = 160 г
прим. = 8 %
m (CaC2) - ?
Решение:
Процентное содержание чистого СаС2
100% – 8% = 92%
mчистого
(CaC2)
=
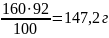
6. Проверим достижение цели - определять тип химической связи. Классифицировать и делать дисперсные системы
Выполните самостоятельную работу.
