
- •Дм. 01 Основные химические понятия и законы Руководство по модулю «Основные химические понятия и законы»
- •Ме 1.1 (Занятие № 2)
- •Руководство по ме «Основные химические понятия и законы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.1 «Составить формулы химических соединений. Применить основные законы химии для составления уравнений химических реакций»
- •Самостоятельная работа
- •Ме 1.2 (Занятие № 3)
- •Руководство по ме «Решение задач»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.2 «Решать задачи»
- •Самостоятельная работа
- •Ме 1.3 (Занятие № 4)
- •Руководство по ме «Зачет № 1»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 01Основные химические понятия и законы»
- •Зачетная работа
- •Ме 2.1 (Занятие № 5)
- •Руководство по ме «Периодический закон и Периодическая система химических элементов д.И. Менделеева»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 2.1 «Понять структуру Периодической таблицы химических элементов. Сделать лабораторную работу «Моделирование построения Периодической таблицы химических элементов»
- •Инструкция
- •Самостоятельная работа
- •Ме 2.2 (Занятие № 6)
- •Руководство по ме «Строение атома»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 03 Строение вещества Руководство по модулю «Строение вещества»
- •Ме 3.1 (Занятие № 7)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.2 (Занятие № 8)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.3 (Занятие № 9)
- •6. Заполняется личный дневник студента. Руководство по ме «Металлическая связь. Дисперсные системы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 04 Вода. Растворы. Электролитическая диссоциация Руководство по модулю «Вода. Растворы. Электролитическая диссоциация»
- •Ме 4.1 (Занятие № 10)
- •Руководство по ме «Растворение как физико - химический процесс»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •3.1 Массовая доля
- •3.2 Молярность раствора
- •Самостоятельная работа
- •Ме 4.2 (Занятие № 11)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Плотность и процентное содержание растворов хлорида натрия.
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •Самостоятельная работа
- •Ме 4.3 (Занятие № 12)
- •Руководство по ме «Классифицировать основные классы неорганических веществ с точки зрения теории электролитической диссоциации. Определять сильные и слабые электролиты»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1) Молекулярное уравнение:
- •3) Сокращенное ионно-молекулярное уравнение:
- •Самостоятельная работа
- •Дм. 05 Классификация неорганических соединений и их свойства Руководство по модулю «Классификация неорганических соединений и их свойства»
- •Ме 5.1 (Занятие № 13)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.2 (Занятие № 14)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.3 (Занятие № 15)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Алгоритм написания уравнений реакций гидролиза солей
- •Самостоятельная работа
- •Ме 5.4 (Занятие № 16)
- •Руководство по ме «Контрольная работа»
- •Руководство по оценке действия «Продемонстрировать освоенные действия за I семестр»
- •Контрольная работа
- •Дм. 06 Химические реакции Руководство по модулю « Химические реакции»
- •Ме 6.1 (Занятие № 17)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 6.2 (Занятие № 18)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.3 (Занятие № 19)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.4 (Занятие № 20)
- •Руководство по ме «Зачет № 2»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 06 Химические реакции»
- •Зачетная работа
- •Дм. 07 Металлы и неметаллы Руководство по модулю «Металлы и неметаллы»
- •Ме 7.1 (Занятие № 21)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.2 (Занятие № 22)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.3 (Занятие № 23)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Пример:
- •Некоторые качественные реакции на анионы и катионы
- •Дм. 08 Основные понятия органической химии и теория строения органических соединений Руководство по модулю «Основные понятия органической химии и теория строения органических соединений»
- •Ме 8.1 (Занятие № 24)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 8.2 (Занятие № 25)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Основные положения теории химического строения а.М. Бутлерова
- •1. Атомы в молекулах соединяются в определенном порядке в соответствии в соответствии с их валентностью. (Углерод четырехвалентен).
- •2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул.
- •3. Свойства веществ зависят от взаимного влияния атомов в молекулах.
- •Дм. 09 Углеводороды и их природные источники Руководство по модулю «Углеводороды и их природные источники»
- •Ме 9.1 (Занятие № 26)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Реакции отщепления (дегидрирование)
- •4. Реакции разложения
- •Ме 9.2 (Занятие № 27)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Задание 3: н аписать уравнения реакций в соответствии со схемой: сн4 с2н4 (- сн2 – сн2)n
- •Ме 9.3 (Занятие № 28)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1.1 Решив задачу, определим молекулярную формулу первого представителя гомологического ряда алкинов – ацетилена. Решение задач на определение молекулярной формулы веществ
- •Ме 9.4 (Занятие № 29)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Дм. 10 Кислородосодержащие органические соединения Руководство по модулю «Кислородосодержащие органические соединения»
- •Ме 10.1 (Занятие № 30)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Одноатомные спирты.
- •Многоатомные спирты
- •Ме 10.2 (Занятие № 31)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.3 (Занятие № 32)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.4 (Занятие № 33)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Реагирует с оксидом серебра (I) в аммиачном растворе (реакция “серебряного зеркала”):
- •4. Специфические свойства.
- •Ме 10.5 (Занятие № 34)
- •Руководство по ме «Зачет № 3»
- •Зачетная работа
- •1)Алканов 2)алкинов
- •3)Алкенов 4)аренов
- •1) Бутан 2) бутен 3) бутин 4) бутанол
- •1)Бензина 2) углеводов
- •3) Бутадиена 4) фенола
- •Дм. 11 Азотсодержащие органические соединения. Полимеры Руководство по модулю «Азотсодержащие органические соединения»
- •Ме 11.1 (Занятие № 35)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Номенклатура аминов.
- •2) Взаимодействие с азотистой кислотой:
- •Важнейшие - аминокислоты общей формулы (таблицу переписать в тетрадь)
- •Задание 3: Составить структурные формулы
- •3. Изучим свойства и способы получения аминокислот Свойства аминокислот:
- •Способы получения аминокислот (все уравнения реакций перенести в тетрадь)
- •Химические свойства
- •Ме 11.2 (Занятие № 36)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Изучим конфигурации белков Структура белков
- •1. В образовании какой структуры принимают участие дисульфидные мостики: а) вторичной, б) первичной, в) третичной.
- •Ме 11.3 (Занятие № 37)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Качественные реакции органических соединений
- •Ме 11.4 (Занятие № 38)
- •Руководство по ме «Итоговый зачет»
- •Руководство по оценке действия «Продемонстрировать освоенные действия курсу «Химия»»
- •Зачетная работа
Контрольная ведомость обучающегося гр. ____________
Дисциплина: Химия (на базе основного общего образования).
Задача урока:. Изучить характеристики и механизмы образования ковалентной связи
ФИО студента __________________________________________
Критерий оценки – студент может самостоятельно выполнить следующие действия |
Да/нет |
Если нет, то что студент должен сделать дополнительно |
Определить механизм образования ковалентной связи |
|
|
Давать характеристики ковалентной связи |
|
|
Составлять структурные (графические) формулы химических соединений |
|
|
Достижение цели – изучить характеристики и механизмы образования ковалентной связи (индивидуальное задание) |
|
|
Результат оценки:
|
||
Подписи оценщиков:
|
Дата проведения оценки: |
|
Руководство
по освоению действия МЕ 2.1 «Изучить характеристики и механизмы образования ковалентной связи»
Освоим действие – Изучить характеристики и механизмы образования ковалентной связи
Порядок освоения действия:
1. Изучим механизм образования ковалентной связи
Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода:
Н + Н = Н2;
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным 1 s-электроном. При сближении атомов до определенного расстояния происходит частичное перекрывание их электронных облаков (орбиталей) . В результате между центрами обоих ядер возникает молекулярное двухэлектронное облако, обладающее максимальной электронной плотностью в пространстве между ядрами; увеличение же плотности отрицательного заряда благоприятствует сильному возрастанию сил притяжения между ядрами и молекулярным облаком.
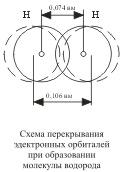
Ковалентная связь это связь, возникающая между атомами за счет образования общих электронных пар
Различают две разновидности ковалентной связи: неполярную и полярную.
В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, или электронное облако связи, распределяется в пространстве симметрично относительно ядер обоих атомов. Примером являются двухатомные молекулы, состоящие из атомов одного элемента: Н2, Сl2, О2, N2, F2 и др., в которых электронная пара в одинаковой мере принадлежит обоим атомам.
В случае полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрицательностью. Примером могут служить молекулы летучих неорганических соединений: НСl, Н2О, Н2S, NН3 и др.
Пример:
Образование молекулы НСl можно представить схемой
Н.+ .Сl: = Н :Cl:
Электронная пара смещена к атому хлора, так как относительная электроотрицательность атома хлора (2,83) больше, чем атома водорода (2,1).
1.1 Различают два механизма образования ковалентной связи: ковалентная связь образуется не только за счет перекрывания одноэлектронных облаков, - это обменный механизм образования ковалентной связи.
Возможен и другой механизм ее образования - донорно-акцепторный. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого атома.
Пример:
Рассмотрим в качестве примера
механизм образования иона аммония ![]() .
.
В молекуле аммиака атом азота имеет неподеленную пару электронов двухэлектронное облако):
|
У иона водорода свободна (не заполнена) 1s-орбиталь, что можно обозначить как □H+.
При образовании иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, т.е. оно превращается в молекулярное электронное облако. А значит, возникает четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой
|
+ □H+ → |
|
З
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (т.е. предоставляющий свободную орбиталь), называется акцептором.
аряд иона водорода становится общим (он делокализован, т.е. рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежащее азоту, становится общим с водородом
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным. Образованная таким путем ковалентная связь называется донорно-акцепторной или координационной связью.

2. Изучим характеристики ковалентной связи
Важными количественными характеристиками ковалентной связи являются кратность, энергия связи, ее длина, насыщенность и направленность.
Кратность (одинарная, полуторная, двойная, тройная).
Насыщаемость – это способность атомов образовывать определённое и ограниченное число связей.
Энергия связи – энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов. Энергия связи характеризует ее прочность.
Длина связи – расстояние между центрами связанных атомов. Чем меньше длина, тем прочнее химическая связь.
Направленность – связь образуется в направлении наибольшего перекрывания облаков.
3. Учимся составлять структурные (графические) формулы химических соединений
Взаимную связь атомов в молекулах отражают их графические изображения.
Правила:
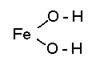
1. Для написания графических изображений оснований записывают атом металла, с которым связаны гидроксильные группы, причем водородный атом соединяется с атомом металла через кислород.
Например:
NaOH Na - O - H
Fe(OH)2
2. В бескислородных кислотах атом неметалла связан с водородом.
Например:
HCl H – Cl
H 2S Н S Н
3. Для кислородсодержащих кислот можно использовать следующий алгоритм (на примере серной кислоты):
3.1 Записывается центральный атом, от названия которого исходит название кислоты. Так, в серной кислоте центральным атомом является сера:
S
3.2 Обращаем внимание на основность кислоты, которой соответствует число гидроксильных групп. По одну сторону от центрального атома записываются гидроксильные группы, в которых водород связан с ним через кислород. Так, в двухосновной серной кислоте записываем две гидроксильные группы по левую сторону от атома серы:
![]()
3.3 После написания гидроксильных групп считаем число атомов каждого элемента в написанной гидроксильной форме и получаем формулу H2SO2, где до молекулярной формулы серной кислоты H2SO4 недостает двух атомов кислорода. Их записываем по правую сторону от центрального атома и соединяем атомы серы и кислорода связями, число которых соответствует валентности элементов. Так, если написать графическую формулу
![]() ,
,
атом кислорода будет соответствовать двухвалентному состоянию, но сера в серной кислоте шестивалентная, а в приведенном графическом изображении она оказывается четырехвалентной. Поэтому верное графическое изображение будет:
![]()
Задание № 1: Написать графическое изображение азотной, азотистой, фосфорной и угольной кислот
4. Для написания графических формул солей необходимо написать структурную формулу кислоты.
Так, например, для нитрата натрия и сульфата кальция:
4.1 Записываем структурные изображения, соответственно, азотной и серной кислот:
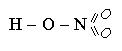 и
и
В названных солях NaNO3 и CaSO4 металл полностью замещает водород в кислотах.
4.2 Поэтому графические изображения азотной и сернистой кислот представим без атомов водорода
![]() и
и
![]()
4.3 Вместо водорода записываем атом металла, заместившего его с количеством связей согласно валентности металла. Натрий одновалентен, кальций двухвалентен. Тогда графические изображения нитрата натрия и сульфата кальция будут выглядеть следующим образом:
![]() и
и
![]()
4.4 Если соль имеет несколько кислотных остатков, то алгоритм остается вышеприведенный с учетом написания соответствующего количества формул кислоты. Например, нитрат алюминия Al(NO3)3:
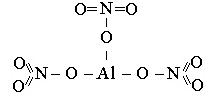
Задание № 2: Составить графические формулы: оксида натрия; оксида фосфора (V), сульфата бария, гидроксида железа (III), иодоводородной кислоты.
4. Проверим достижение цели - Изучить характеристики и механизмы образования ковалентной связи
Выполните самостоятельную работу.

