
- •Дм. 01 Основные химические понятия и законы Руководство по модулю «Основные химические понятия и законы»
- •Ме 1.1 (Занятие № 2)
- •Руководство по ме «Основные химические понятия и законы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.1 «Составить формулы химических соединений. Применить основные законы химии для составления уравнений химических реакций»
- •Самостоятельная работа
- •Ме 1.2 (Занятие № 3)
- •Руководство по ме «Решение задач»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 1.2 «Решать задачи»
- •Самостоятельная работа
- •Ме 1.3 (Занятие № 4)
- •Руководство по ме «Зачет № 1»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 01Основные химические понятия и законы»
- •Зачетная работа
- •Ме 2.1 (Занятие № 5)
- •Руководство по ме «Периодический закон и Периодическая система химических элементов д.И. Менделеева»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство по освоению действия ме 2.1 «Понять структуру Периодической таблицы химических элементов. Сделать лабораторную работу «Моделирование построения Периодической таблицы химических элементов»
- •Инструкция
- •Самостоятельная работа
- •Ме 2.2 (Занятие № 6)
- •Руководство по ме «Строение атома»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 03 Строение вещества Руководство по модулю «Строение вещества»
- •Ме 3.1 (Занятие № 7)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.2 (Занятие № 8)
- •Руководство по ме «Виды химической связи»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 3.3 (Занятие № 9)
- •6. Заполняется личный дневник студента. Руководство по ме «Металлическая связь. Дисперсные системы»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Дм. 04 Вода. Растворы. Электролитическая диссоциация Руководство по модулю «Вода. Растворы. Электролитическая диссоциация»
- •Ме 4.1 (Занятие № 10)
- •Руководство по ме «Растворение как физико - химический процесс»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •3.1 Массовая доля
- •3.2 Молярность раствора
- •Самостоятельная работа
- •Ме 4.2 (Занятие № 11)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Плотность и процентное содержание растворов хлорида натрия.
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •Самостоятельная работа
- •Ме 4.3 (Занятие № 12)
- •Руководство по ме «Классифицировать основные классы неорганических веществ с точки зрения теории электролитической диссоциации. Определять сильные и слабые электролиты»
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1) Молекулярное уравнение:
- •3) Сокращенное ионно-молекулярное уравнение:
- •Самостоятельная работа
- •Дм. 05 Классификация неорганических соединений и их свойства Руководство по модулю «Классификация неорганических соединений и их свойства»
- •Ме 5.1 (Занятие № 13)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.2 (Занятие № 14)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 5.3 (Занятие № 15)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Алгоритм написания уравнений реакций гидролиза солей
- •Самостоятельная работа
- •Ме 5.4 (Занятие № 16)
- •Руководство по ме «Контрольная работа»
- •Руководство по оценке действия «Продемонстрировать освоенные действия за I семестр»
- •Контрольная работа
- •Дм. 06 Химические реакции Руководство по модулю « Химические реакции»
- •Ме 6.1 (Занятие № 17)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Самостоятельная работа
- •Ме 6.2 (Занятие № 18)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.3 (Занятие № 19)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 6.4 (Занятие № 20)
- •Руководство по ме «Зачет № 2»
- •Руководство по оценке действия «Продемонстрировать освоенные действия по дм 06 Химические реакции»
- •Зачетная работа
- •Дм. 07 Металлы и неметаллы Руководство по модулю «Металлы и неметаллы»
- •Ме 7.1 (Занятие № 21)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.2 (Занятие № 22)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 7.3 (Занятие № 23)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Пример:
- •Некоторые качественные реакции на анионы и катионы
- •Дм. 08 Основные понятия органической химии и теория строения органических соединений Руководство по модулю «Основные понятия органической химии и теория строения органических соединений»
- •Ме 8.1 (Занятие № 24)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 8.2 (Занятие № 25)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Основные положения теории химического строения а.М. Бутлерова
- •1. Атомы в молекулах соединяются в определенном порядке в соответствии в соответствии с их валентностью. (Углерод четырехвалентен).
- •2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул.
- •3. Свойства веществ зависят от взаимного влияния атомов в молекулах.
- •Дм. 09 Углеводороды и их природные источники Руководство по модулю «Углеводороды и их природные источники»
- •Ме 9.1 (Занятие № 26)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Реакции отщепления (дегидрирование)
- •4. Реакции разложения
- •Ме 9.2 (Занятие № 27)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Задание 3: н аписать уравнения реакций в соответствии со схемой: сн4 с2н4 (- сн2 – сн2)n
- •Ме 9.3 (Занятие № 28)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1.1 Решив задачу, определим молекулярную формулу первого представителя гомологического ряда алкинов – ацетилена. Решение задач на определение молекулярной формулы веществ
- •Ме 9.4 (Занятие № 29)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Дм. 10 Кислородосодержащие органические соединения Руководство по модулю «Кислородосодержащие органические соединения»
- •Ме 10.1 (Занятие № 30)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Одноатомные спирты.
- •Многоатомные спирты
- •Ме 10.2 (Занятие № 31)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.3 (Занятие № 32)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Ме 10.4 (Занятие № 33)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •1. Реагирует с оксидом серебра (I) в аммиачном растворе (реакция “серебряного зеркала”):
- •4. Специфические свойства.
- •Ме 10.5 (Занятие № 34)
- •Руководство по ме «Зачет № 3»
- •Зачетная работа
- •1)Алканов 2)алкинов
- •3)Алкенов 4)аренов
- •1) Бутан 2) бутен 3) бутин 4) бутанол
- •1)Бензина 2) углеводов
- •3) Бутадиена 4) фенола
- •Дм. 11 Азотсодержащие органические соединения. Полимеры Руководство по модулю «Азотсодержащие органические соединения»
- •Ме 11.1 (Занятие № 35)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Номенклатура аминов.
- •2) Взаимодействие с азотистой кислотой:
- •Важнейшие - аминокислоты общей формулы (таблицу переписать в тетрадь)
- •Задание 3: Составить структурные формулы
- •3. Изучим свойства и способы получения аминокислот Свойства аминокислот:
- •Способы получения аминокислот (все уравнения реакций перенести в тетрадь)
- •Химические свойства
- •Ме 11.2 (Занятие № 36)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •2. Изучим конфигурации белков Структура белков
- •1. В образовании какой структуры принимают участие дисульфидные мостики: а) вторичной, б) первичной, в) третичной.
- •Ме 11.3 (Занятие № 37)
- •Контрольная ведомость обучающегося гр. ____________
- •Руководство
- •Качественные реакции органических соединений
- •Ме 11.4 (Занятие № 38)
- •Руководство по ме «Итоговый зачет»
- •Руководство по оценке действия «Продемонстрировать освоенные действия курсу «Химия»»
- •Зачетная работа
Контрольная ведомость обучающегося гр. ____________
Дисциплина: Химия (на базе основного общего образования).
Задача урока:. Объяснять строение атома.
Записывать электронные формулы атома. Давать характеристику химическому элементу по его положению в Периодической таблице
ФИО студента __________________________________________
Критерий оценки – студент может самостоятельно выполнить следующие действия |
Да/нет |
Если нет, то что студент должен сделать дополнительно |
Объяснить строение атома |
|
|
Записывать электронные формулы атомов |
|
|
Давать характеристику элемента по его положению в Периодической таблице |
|
|
Достижение цели – уметь давать полную характеристику элементу по его положению в Периодической таблице (индивидуальное задание) |
|
|
Результат оценки:
|
||
Подписи оценщиков:
|
Дата проведения оценки: |
|
Руководство
по освоению действия МЕ 2.1 «Объяснять строение атома.
Записывать электронные формулы атома. Давать характеристику химическому элементу по его положению в Периодической таблице»
Освоим действие – Дать характеристику химическому элементу по его положению в Периодической таблице
Порядок освоения действия:
1. Изучим строение атома.
Атом
является сложной системой, в состав
которой входят определенные частицы.
Английский физик Э. Резерфорд предложил
ядерную (планетарную) модель строения
атома. Основные положения ядерной модели
атома.
1. Атом имеет форму шара, в
центре которого находится ядро.
2.
Ядро имеет очень маленький размер
(диаметр атома 10-10
м, диаметр ядра ~10-15
м).
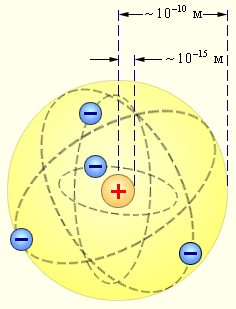 3.
Ядро имеет положительный заряд.
4.
Почти вся масса атома находится в ядре.
5. Вокруг ядра движутся электроны.
6. Электроны движутся вокруг ядра,
как планеты вокруг Солнца.
3.
Ядро имеет положительный заряд.
4.
Почти вся масса атома находится в ядре.
5. Вокруг ядра движутся электроны.
6. Электроны движутся вокруг ядра,
как планеты вокруг Солнца.
Атом состоит из ядра и электронов (они имеют отрицательный заряд). В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
Ядро атома – сложная частица. В ядре сосредоточена почти вся масса атома. Поскольку химический элемент – совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают следующие его координаты:
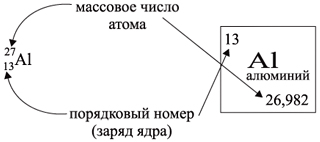
По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
Протон p имеет массу 1 (1,0073 а. е. м.) и заряд +1. Нейтрон n заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.).
Заряд ядра определяют протоны. Причем число протонов равно (по величине) заряду ядра атома, т.е. порядковому номеру.
Число нейтронов N определяют по разности между величинами: «масса ядра» А и «порядковый номер» Z. Так, для атома алюминия:
N = А – Z = 27 –13 = 14n,
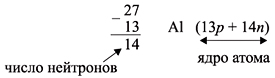
Задание 1 Определите состав ядер атомов, если химический элемент находится в:
а) 3-м периоде, VII группе, главной подгруппе;
б) 4-м периоде, IV группе, побочной подгруппе;
в) 5-м периоде, I группе, главной подгруппе.
Состояние электрона в атоме характеризуется четырьмя квантовыми числами.
Квантовые числа для электрона в атоме:
главное квантовое число |
n |
орбитальное квантовое число |
l |
магнитное квантовое число |
ml |
спиновое квантовое число |
ms |
Э
Совокупность состояний электрона в атоме с одним и тем же значением n называют энергетическим уровнем. Число уровней, на которых находятся электроны в основном состоянии атома, совпадает с номером периода, в котором располагается элемент. Номера этих уровней обозначают цифрами: 1, 2, 3,... (реже - буквами K, L, M, ...).
нергетические уровни и подуровни
Энергетический подуровень - совокупность энергетических состояний электрона в атоме, характеризующихся одними и теми же значениями квантовых чисел n и l. Подуровни обозначают буквами: s, p, d, f..
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делят на четыре типа (семейства).
1. s-Элементы: заполняется электронами s-подуровень внешнего уровня. К ним относятся первые два элемента каждого периода.
2. р-Элементы: заполняется электронами р-подуровень внешнего уровня. Это последние 6 элементов каждого периода (кроме первого и седьмого).
3. d-Элементы: заполняется электронами d-подуровень второго снаружи уровня, а на внешнем уровне остается один или два электрона (у Pd — нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s- и р-элементами (их также называют переходными элементами).
4. f-Элементы: заполняется электронами f-подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Это лантаноиды и актиноиды.
В периодической системе s-элементов 14, р-элементов 30, d-элементов 35, f-элементов 28. Элементы одного типа имеют ряд общих химических свойств.
Орбиталь |
Кол-во положений в пространстве |
Максимальное количество электронов |
s |
1 |
2 |
p |
3 |
6 |
d |
5 |
10 |
f |
7 |
14 |
2. Учимся записывать электронные формулы атомов
Порядковый номер элемента в Периодической таблице – количество протонов в ядре атома. Количество протонов равно количеству электронов
Электронная формула элемента с порядковым номером 7 (это элемент азот, имеющий символ “N”) выглядит так:
1s22s22p3
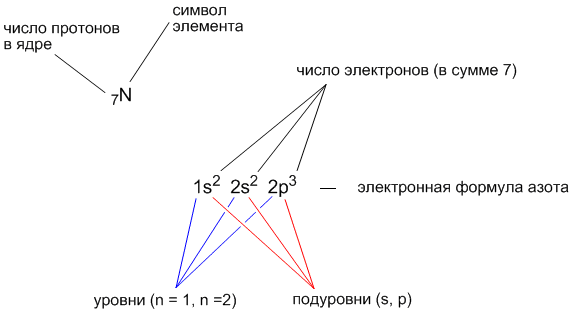
Последовательность заполнения орбиталей определяется шкалой энергии Клечковского:
Период |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Орбиталь |
1s |
2s2p |
3s3p |
4s3d 4p |
5s4d5p |
6s4f5d6p |
7s5f6d7p |
Пример:
Электронная формула атома водорода (порядковый номер 1) 1Н 1s1
Электронная формула атома магния (порядковый номер 12) 12Mg 1s22s22p63s2
Электронная формула атома ванадия (порядковый номер 23) 23V 1s2 2s22p6 3s23p64s23d3
Задание № 2: Составить электронные формулы атомов кремния, скандия, железа.
3. Изучим последовательность характеристики элемента по его положению в Периодической таблице
План характеристики элемента по его положению в Периодической таблице.
а) Положение в периодической таблице (порядковый номер; период, ряд; группа, подгруппа; атомная масса).
б) Строение атома (заряд ядра; состав ядра - количество протонов p11, нейтронов n01 и электронов ē; написать формулу электронной конфигурации; по числу и характеру валентных электронов определить тип элемента).
в) Формулы и химический характер соединений (высшего оксида и гидроксида; водородных соединений).
Пример:
Дать характеристику элементу скандию по его положению в периодической таблице.
а) Порядковый номер элемента Z = 21; 4 период; 3 группа, побочная подгруппа. Атомная масса – 45.
б) Порядковый номер элемента Z = 21 обозначает: заряд ядра атома элемента (скандия): 6521Sc – +21; число протонов p11: 21Sc – 21 p11; число электронов ē: 21Sc – 21ē; число нейтронов n01 = Ar – Z = 45 – 21 = 24 – 24n10
Электронная формула атома скандия 21Sc 1s2 2s22p6 3s23p64s23d1
Скандий – d- элемент.
в) Формула высшего оксида – Sc2O3, гидроксида – Sc(OH)3 обладают слабыми основными свойствами. Соединений с водородом не образует.
Задание № 2: Дать характеристику по положению в Периодической таблице следующим элементам: натрий, хром, медь, мышьяк, бром.
4. Проверим достижение цели - Объяснять строение атома.
Записывать электронные формулы атома. Давать характеристику химическому элементу по его положению в Периодической таблице
Выполните самостоятельную работу.
