
- •Содержание
- •Глоссарий 7
- •Конспект лекционных занятий
- •3. Практические занятия
- •4. Лабораторные занятия
- •5. Самостоятельная работа студентов
- •7 Экзаменационные вопросы 181
- •8 Технические средства обучения 182
- •Список рекомендуемой литературы 182
- •1. Глоссарий
- •2 Конспект лекционных занятий модуль 1 Лекция № 1. Перспективы развития технологии органических веществ (2 часа)
- •0,5 О2 носн2-сн2он
- •О носн2-сн2nh2
- •Лекция № 2. Физико-химические основы термического крекинга
- •Лекция № 3. Физико-химические основы каталитического крекинга
- •Лекция № 4. Физико-химические основы каталитического риформинга
- •Лекция № 5. Физико-химические основы гидрогенизационных процессов
- •Лекция № 7. Химизм и механизм технологических процессов переработки нефтяных газов
- •Лекция № 8 Технологическое оборудование и технологическое оформление основных аппаратов процессов переработки органических веществ
- •Лекция № 10 Теоретические основы очистки нефтяных фракций
- •Лекция № 11 Адсорбционные и каталитические методы очистки
- •Лекция № 12 Очистка с применением избирательных растворителей
- •Лекция № 13 Депарафинизация масел и дизельных фракций
- •3. Практические занятия
- •Практическое занятие №1
- •Тема: Расчетные методы определения физико-химических свойств
- •И состава нефти и нефтепродуктов
- •Задачи для решения
- •Практическое занятие №2 Тема: Расчетные методы вычисления материального баланса процесса термического крекинга
- •Составление материального баланса
- •Задачи для решения
- •Практическое занятие №3 Тема: Составление материального баланса процесса каталитического крекинга
- •Задачи для решения
- •Практическое занятие №4 Тема: Составление материального баланса процесса каталитического риформинга
- •Задачи для решения
- •Практическое занятие №5 Тема: Расчетные методы вычисления материального баланса гидрогенизационных процессов
- •Задачи для решения
- •Практическое занятие №6 Тема: Расчетные методы вычисления материального баланса процесса полимеризационных процессов
- •Задачи для решения
- •Практическое занятие №7 Тема: Задачи и упражнения по составлению уравнений химических реакций, протекающих при алкилировании и изомеризации с указанием механизма ее протекания
- •Задачи для решения
- •Практическое занятие №8 Тема: Технологический расчет основных аппаратов установок переработки органических веществ
- •Число тарелок
- •Практическое занятие №9 Тема: Приближенные методы построения линии однократного испарения (ои)
- •Задачи для решения
- •Практическое занятие №10 Тема: Решение задач по теоретическим основам процесса очистки нефтяных фракций
- •Задачи для решения
- •Практическое занятие №11 Тема: Решение задач по депарафинизации нефтяных фракций
- •Задачи для решения
- •Практическое занятие №12 Тема: Решение задач по закономерностям получения гомогенных растворов
- •Задачи для решения
- •4. Лабораторные занятия лабораторная работа №1 Тема: Термический крекинг (пиролиз) углеводородов и составление материального баланса опыта
- •Описание установки и методика проведения работы
- •Лабораторная работа №2 Тема: Каталитический крекинг углеводородов и составление материального баланса опыта
- •Проведение работы
- •Оформление результатов работы
- •Методика проведения эксперимента
- •Приготовление алюмохромового оксидного катализатора
- •Методика выполнения работы
- •Лабораторная работа №5 Тема: Полукоксование
- •Описание установки и методика проведения работы
- •Лабораторная работа №6 Аппараты установок термических и каталитических процессов. Тема: Методы разделения и анализа продуктов реакций
- •Методика проведения работы
- •Методика проведения работы
- •Лабораторная работа №7 Тема: Разгонка нефти на ректификационном аппарате
- •Лабораторная работа №8 Тема: Очистка сырой нефти от влаги и механических примесей
- •Определение сухого остатка
- •Методика определения
- •Прокаленный остаток
- •Методика определения
- •Лабораторная работа №9 Тема: Депарафинизация бензиновой фракции карбамидным методом
- •Методика определения
- •Лабораторная работа №10 Тема: Адсорбционная очистка масляных дистиллятов
- •Порядок выполнения работ
- •5. Самостоятельная работа студентов под руководством преподавателей (срсп) срсп №1. Реакционная способность органических соединений. Электронные эффекты
- •Срсп № 2. Классификация органических реакций
- •Срсп № 3. Характеристика основных механизмов реакций органических соединений
- •Срсп № 4. Образование пироуглерода и сажи
- •Срсп №5. Термические превращения углеводородов в жидкой фазе
- •Срсп №6. Процесс коксования нефтяного сырья
- •Срсп №7. Кислотный катализ
- •Реакции карбкатионов
- •Срсп №8. Классификация каталитических реакций и катализаторов
- •Энергия активации каталитической реакции
- •Срсп №9. Кинетика газофазных реакций в присутствии твердых катализаторов
- •Срсп №10. Теоретические основы подготовки и переработки газообразного сырья
- •6. Самостоятельная работа студентов срс
- •7 Экзаменационные вопросы
- •8 Технические средства обучения
- •Список рекомендуемой литературы
- •9.1 Основная литература
- •9.2 Дополнительная литература
Лекция № 3. Физико-химические основы каталитического крекинга
• Назначение процесса каталитического крекинга
• Превращения алканов
• Превращения циклоалканов
• Превращения алкенов
• Превращения аренов
• Катализаторы каталитического крекинга
Крекинг нефтяного сырья в присутствии катализаторов называется каталитическим крекингом. Применение катализатора в крекинг процессе вносит значительные изменения как в механизм протекающих превращений углеводородов, так и в состав получаемых продуктов. Преимущества каталитического крекинга заключается, во-первых, в том, что в результате общего ускорения процесса удается несколько снизить температуру крекинга и проводить процесс при низком давлении; во-вторых, и это главное, селективное действие катализатора ускоряет такие реакции, которые приводят к накоплению в крекинг-бензине ароматических, изопарафиновых и изоолефиновых углеводородов, обладающих большими октановыми числами.
Процесс проводят в паровой фазе при 450-525оС под давлением не выше 0,15 МПа в присутствии алюмосиликатного катализатора.
В условиях каталитического крекинга наряду с крекингом углеводородов протекают реакции алкилирования, изомеризации, полимеризации, гидрирования и деалкилирования.
Все реакции при каталитическом крекинге протекают по цепному карбкатионному механизму.
Превращения алканов. Часть молекул алканов подвергается вначале термическому крекингу. Образующиеся олефины присоединяют протоны, находящиеся на катализаторе, и превращаются в карбкатионы:
RCH=CH2 + H+A- RC+НCH3 + A-
Образовавшийся ион карбония отрывает гидрид-ион от молекулы алкана:
RC+НCH3 + СН3СН2СН2СН2СН2СН2СН3
RCН2CH3 + СН3СН2СН2СН2СН2СН2С+Н2
Далее реакция развивается по цепному пути.
Карбкатион может разложиться (по -правилу):
СН3СН2СН2СН2СН2СН2С+Н2 СН3СН2СН2СН2С+Н2 + СН2=СН2
Однако высокая скорость изомеризации ионов приводит к тому, что этилена образуется очень мало.
Изомеризация происходит как путем перемещения гидрид-иона, так и при перемещении метиланиона. В первом случае образующиеся вторичные ионы сохраняют прямую углеводородную цепь. Тепло, выделяющееся при изомеризации, затрачивается на расщепление. Превращение протекает по схеме:
 СН3СН2СН2СН2СН2СН2С+Н2
СН3СН2СН2СН2СН2СН2С+Н2
С Н3СН2СН2СН2СН2С+НСН3 СН3СН2СН2С+Н2 + СН2=СН–СН3
СН3СН2СН2СН2С+НСН2СН3 СН3СН2С+Н2 + СН3СН2СН=СН2
Изомеризация карбкатиона с перемещением метиланиона дает продукты с разветвлением углеводородного скелета:
С
 Н3СН2СН2СН2С+НСН2СН3
СН3СН2СН2СН2СН(СН3)С+Н2
Н3СН2СН2СН2С+НСН2СН3
СН3СН2СН2СН2СН(СН3)С+Н2
СН3СН2С+Н2 + СН2=С(СН3)2 СН3СН2СН2СН2С+(СН3)СН3
Чередование изотермической изомеризации и эндотермического -распада продолжается до образования карбкатионов, содержащих 3-5 атомов углерода. Тепловой эффект изомеризации этих ионов уже не компенсирует затрат тепла на расщепление. Поэтому карбкатионы С3-С5 после изомеризации отрывают гидрид-ион от молекулы исходного углеводорода:
СН3СН2С+Н2 СН3С+НСН3
СН3С+НСН3 + СН3СН2СН2СН2СН2СН2СН3
СН3СН2СН3 + СН3СН2СН2СН2СН2СН2С+Н2
Затем весь цикл реакций повторяется. Обрыв цепи происходит при встрече карбкатиона с анионом катализатора:
СН3СН2С+Н2 + А- СН3СН2СН2А
Скорость каталитического крекинга на 1-2 порядка выше скорости их термического крекинга.
Превращение циклоалканов. Скорость каталитического крекинга циклоалканов близка к скорости крекинга алканов с равным числом атомов углерода и увеличивается при наличии третичного атома углерода.
За счет высокой температуры возникает небольшое количество алкенов, которые, присоединяя протон от катализатора, превращаются в карбкатионы. Образовавшиеся ионы карбония отрывают гидрид-ион от молекулы нафтена. Отщепление гидрид-иона от третичного углеродного атома протекает легче, чем от вторичного, поэтому глубина крекинга возрастает с увеличением числа заместителей в кольце.
СН3 СН3 СН3 СН3


С троение молекулы…
СН3 СН3 СН3
Распад циклогексильного иона может происходить двумя путями:
с разрывом кольца и 2) без разрыва кольца.
При разрыве С–С-связи образуется алкенильный ион, который легко изомеризуется в ион аллильного типа:
R
+ R
 СН2=ССН2СН2СН2С+Н2
СН2=ССН2СН2СН2С+Н2
CH2=CRCH2CH2CH2C+H2 CH2=CRC+HCH2CH2CH3
Последний может расщепиться по -правилу, оторвать гидрид-ион от исходного углеводорода или передать протон молекуле алкена или катализатору.
При крекинге по этому пути из циклогексана образуются алкены и диены.
Циклогексильный ион отщепляет протон превращается в циклоалкен:
R R
+
-H+
Этот путь энергетически выгоднее, чем распад по С–С-связи (1-путь).
Циклоалкены крекируются быстрее, чем циклоалканы, со значительным выходом аренов.
Выход аренов достигает 25% и более от продуктов превращения циклогексанов, а газы крекинга циклоалканов содержат повышенное количество водорода, по сравнению с газами крекинга алканов.
Наблюдается также изомеризация циклогексанов в циклопентаны и обратно:
+ С+Н2 СН3

 +
+
Циклопентаны в условиях каталитического крекинга более устойчивы, чем циклогексаны. При наличии длинных боковых цепей в молекуле циклоалкана возможны изомеризация боковой цепи и деалкилирование молекулы.
Превращение алкенов. Скорость каталитического крекинга алкенов на 2-3 порядка выше скорости крекинга соответствующих алканов, что объясняется легкостью образования из алкенов карбкатионов:
СН2=СНСН2СН3 + Н+ СН3С+НСН2СН3 + 724 кДж/моль
Кроме образования низших алканов и алкенов каталитический крекинг алкенов приводит к образованию циклоалканов и аренов:
СН2=СНС+Н2 + СН2=С(СН3)СН3
СН3
СН2=СНСН2СН2С+(СН3)СН3 + СН3
Далее может произойти изомеризация в шестичленный цикл и превращение в арен.
Превращение аренов. Незамещенные арены в условиях каталитического крекинга устойчивы. Метилзамещенные арены реагируют со скоростью, близкой к алканам. Алкилпроизводные аренов, содержащие 2 и более атомов углерода в боковой цепи, крекируются примерно с такой же скоростью, что и алкены. Основной реакцией алкилпроизводных аренов является деалкилирование. Это объясняется большим сродством ароматического кольца к протону, чем к алкильному иону:
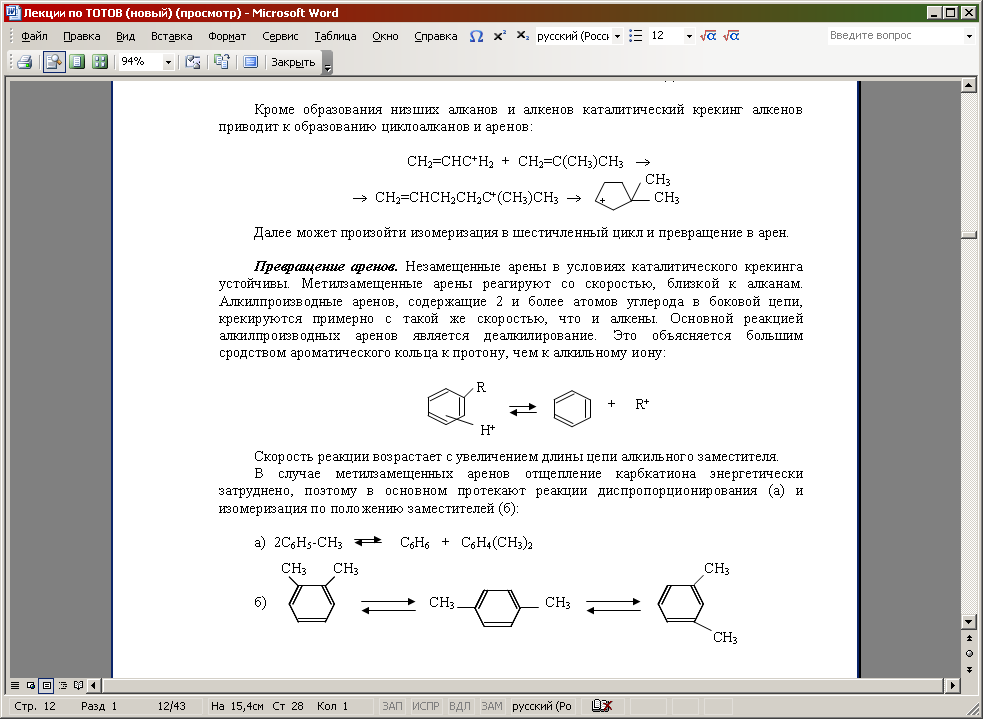
Cкорость реакции возрастает с увеличением длины цепи алкильного заместителя.
В случае метилзамещенных аренов отщепление карбкатиона энергетически затруднено, поэтому в основном протекают реакции диспропорционирования (а) и изомеризация по положению заместителей (б):
а ) 2С6Н5-СН3 С6Н6 + С6Н4(СН3)2
Полициклические арены прочно сорбируются на катализаторе и подвергаются постепенной деструкции и перераспределению водорода с образованием кокса.
Катализаторы каталитического крекинга.
До недавнего времени катализаторами в процессах каталитического крекинга применялись аморфные природные и синтетические алюмосиликаты, содержащие в среднем 10-25% А12О3, 80-75% SiO2 и некоторое количество воды, а в виде примесей Fe2O3, MgO, CaO, Na2O. Выход бензина при использовании синтетических катализаторов достигает 34-36 мас.%.
В настоящее время природные алюмосиликаты практически полностью вытеснены синтетическими, также аморфными веществами. Синтетические кристаллические алюмосиликатные катализаторы содержат в своем составе цеолиты.
Цеолитами называются природные и искусственные алюмосиликаты, обладающие чрезвычайно тонкопористой структурой. Они представляют собой водные алюмосиликаты натрия, кальция и других металлов, т.е. это соли алюмокремниевых кислот: например, цеолит под индексом 13Х–Na86 [(AlO2)86 (SiO2)108] 267H2O. Все цеолиты имеют кристаллическое строение с четко выраженной структурой. Их общее свойство – наличие мельчайших полостей, сообщающихся между собой через поры. Число полостей в кристалле цеолита очень велико. Их общий объем может достигать половины всего объема кристалла. Но в отличие от других адсорбентов (АУ, силикагель, А12О3 и др.) размер пор у цеолитов очень мал и все поры имеют одинаковый диаметр. Для разных типов синтетических цеолитов размер пор колеблется от 0,3 до 1,3 нм. Следовательно поры цеолита могут пропускать в полости кристалла и адсорбировать молекулы только определенного размера, не превышающие диаметра пор данного цеолита. Поэтому их называют молекулярными ситами.
Синтетические цеолиты выпускаются трех типов А, Х, У. Цеолиты типа А имеют поры 0,3-0,5 нм и применяются для осушки и очистки углеводородных газов от углекислого газа и сероводорода, а также для адсорбции и отделения нормальных алканов из их смеси с углеводородами других классов. Цеолиты типа Х имеют размер пор 0,8-1,3 нм, а типа У – 0,8-0,9 нм. Цеолиты Х и У нашли большое применение в производстве ка тализаторов.
Цеолиты имеют малую механическую прочность и в чистом виде в качестве промышленного катализатора не используются. Обычно они вводятся в количестве 5-10% в аморфную алюмосиликатную матрицу, которая обладает достаточно прочной структурой. Использование цеолит-содержащих катализаторов позволяет увеличить выход бензина до 45-47% без ухудшения других показателей процесса. Цеолитсодержащие катализаторы более устойчивы к действию ядов и высокой температуре.
Контрольные вопросы
Сущность процесса каталитического крекинга.
Понятие о катализаторах и катализе.
Синтез высокооктановых компонентов топлива.
Литература
1. Магарил Р.З. Теоретические основы химических процессов переработки нефти. Л.: Химия, 1985. -279 с.
Ахметов С.А. Технология глубокой переработки нефти и газа. – Уфа: «Гилем», 2002. – 672 с.
Технология переработки нефти Ч. 1. /Под редакцией О.Ф.Глаголевой, В.М.Капустина/. – М.: Химия, 2005, 400 с.
