
- •Содержание
- •Глоссарий 7
- •Конспект лекционных занятий
- •3. Практические занятия
- •4. Лабораторные занятия
- •5. Самостоятельная работа студентов
- •7 Экзаменационные вопросы 181
- •8 Технические средства обучения 182
- •Список рекомендуемой литературы 182
- •1. Глоссарий
- •2 Конспект лекционных занятий модуль 1 Лекция № 1. Перспективы развития технологии органических веществ (2 часа)
- •0,5 О2 носн2-сн2он
- •О носн2-сн2nh2
- •Лекция № 2. Физико-химические основы термического крекинга
- •Лекция № 3. Физико-химические основы каталитического крекинга
- •Лекция № 4. Физико-химические основы каталитического риформинга
- •Лекция № 5. Физико-химические основы гидрогенизационных процессов
- •Лекция № 7. Химизм и механизм технологических процессов переработки нефтяных газов
- •Лекция № 8 Технологическое оборудование и технологическое оформление основных аппаратов процессов переработки органических веществ
- •Лекция № 10 Теоретические основы очистки нефтяных фракций
- •Лекция № 11 Адсорбционные и каталитические методы очистки
- •Лекция № 12 Очистка с применением избирательных растворителей
- •Лекция № 13 Депарафинизация масел и дизельных фракций
- •3. Практические занятия
- •Практическое занятие №1
- •Тема: Расчетные методы определения физико-химических свойств
- •И состава нефти и нефтепродуктов
- •Задачи для решения
- •Практическое занятие №2 Тема: Расчетные методы вычисления материального баланса процесса термического крекинга
- •Составление материального баланса
- •Задачи для решения
- •Практическое занятие №3 Тема: Составление материального баланса процесса каталитического крекинга
- •Задачи для решения
- •Практическое занятие №4 Тема: Составление материального баланса процесса каталитического риформинга
- •Задачи для решения
- •Практическое занятие №5 Тема: Расчетные методы вычисления материального баланса гидрогенизационных процессов
- •Задачи для решения
- •Практическое занятие №6 Тема: Расчетные методы вычисления материального баланса процесса полимеризационных процессов
- •Задачи для решения
- •Практическое занятие №7 Тема: Задачи и упражнения по составлению уравнений химических реакций, протекающих при алкилировании и изомеризации с указанием механизма ее протекания
- •Задачи для решения
- •Практическое занятие №8 Тема: Технологический расчет основных аппаратов установок переработки органических веществ
- •Число тарелок
- •Практическое занятие №9 Тема: Приближенные методы построения линии однократного испарения (ои)
- •Задачи для решения
- •Практическое занятие №10 Тема: Решение задач по теоретическим основам процесса очистки нефтяных фракций
- •Задачи для решения
- •Практическое занятие №11 Тема: Решение задач по депарафинизации нефтяных фракций
- •Задачи для решения
- •Практическое занятие №12 Тема: Решение задач по закономерностям получения гомогенных растворов
- •Задачи для решения
- •4. Лабораторные занятия лабораторная работа №1 Тема: Термический крекинг (пиролиз) углеводородов и составление материального баланса опыта
- •Описание установки и методика проведения работы
- •Лабораторная работа №2 Тема: Каталитический крекинг углеводородов и составление материального баланса опыта
- •Проведение работы
- •Оформление результатов работы
- •Методика проведения эксперимента
- •Приготовление алюмохромового оксидного катализатора
- •Методика выполнения работы
- •Лабораторная работа №5 Тема: Полукоксование
- •Описание установки и методика проведения работы
- •Лабораторная работа №6 Аппараты установок термических и каталитических процессов. Тема: Методы разделения и анализа продуктов реакций
- •Методика проведения работы
- •Методика проведения работы
- •Лабораторная работа №7 Тема: Разгонка нефти на ректификационном аппарате
- •Лабораторная работа №8 Тема: Очистка сырой нефти от влаги и механических примесей
- •Определение сухого остатка
- •Методика определения
- •Прокаленный остаток
- •Методика определения
- •Лабораторная работа №9 Тема: Депарафинизация бензиновой фракции карбамидным методом
- •Методика определения
- •Лабораторная работа №10 Тема: Адсорбционная очистка масляных дистиллятов
- •Порядок выполнения работ
- •5. Самостоятельная работа студентов под руководством преподавателей (срсп) срсп №1. Реакционная способность органических соединений. Электронные эффекты
- •Срсп № 2. Классификация органических реакций
- •Срсп № 3. Характеристика основных механизмов реакций органических соединений
- •Срсп № 4. Образование пироуглерода и сажи
- •Срсп №5. Термические превращения углеводородов в жидкой фазе
- •Срсп №6. Процесс коксования нефтяного сырья
- •Срсп №7. Кислотный катализ
- •Реакции карбкатионов
- •Срсп №8. Классификация каталитических реакций и катализаторов
- •Энергия активации каталитической реакции
- •Срсп №9. Кинетика газофазных реакций в присутствии твердых катализаторов
- •Срсп №10. Теоретические основы подготовки и переработки газообразного сырья
- •6. Самостоятельная работа студентов срс
- •7 Экзаменационные вопросы
- •8 Технические средства обучения
- •Список рекомендуемой литературы
- •9.1 Основная литература
- •9.2 Дополнительная литература
Лекция № 2. Физико-химические основы термического крекинга
Термические превращения нефтяных фракций – весьма сложный химический процесс. Сырье состоит из большого числа индивидуальных компонентов. Совершенно очевидно, что предсказать превращение каждого компонента невозможно. Поэтому на практике о результатах судят обычно по выходам целевых продуктов: газа, бензина, кокса, а также по групповому составу бензинов.
Термодинамические расчеты показывают, что алканы, начиная с пентана, при повышенных температурах склонны лишь к реакции распада по связи С–С, с образованием алкена и алкана:
![]()
Полученные предельные осколки вновь распадаются на алкен и алкан. Низкомолекулярные углеводороды – этан, пропан и бутаны – могут также дегидрироваться:
![]()
В результате в газах накапливается водород. Распад алканов может происходить по всем связям С–С. Место разрыва зависит от температуры и давления. Чем выше температура и ниже давление, тем место разрыва углеродной цепи все больше смещается к ее концу и значительно возрастает выход газообразных продуктов. При температуре около 450оС разрыв происходит по середине цепи. Повышение давления также сдвигает место разрыва к центру молекулы. Поэтому крекинг под давлением позволяет получать больше целевых жидких продуктов.
Термический распад алканов протекает по радикально-цепному механизму. Например, в условиях термического крекинга бутан распадается на первичный и вторичный бутильные радикалы, которые приводят к образованию этилена, этана, водорода, пропена и метана:


![]() СН3СН2–СН2СН2
СН2=СН2 +
СН3СН2
СН3СН2–СН2СН2
СН2=СН2 +
СН3СН2
С Н3СН2СН2СН3
Н3СН2СН2СН3
СН3–СН2СНСН3 СН3СН=СН2 + СН3
![]() С2Н4
+ Н
С2Н4
+ Н
СН3СН2
![]() С2Н6
+ С4Н9
С2Н6
+ С4Н9
СН3 + С4Н10 СН4 + С4Н9
Н + С4Н10 Н2 + С4Н9
В незначительной степени может идти дегидрирование (10%):
С4Н10 С4Н8 + Н2
Олефины всегда образуются при распаде углеводородов других классов. Разложение олефинов может протекать в различных направлениях:
 2СmH2m
(деполимеризация)
2СmH2m
(деполимеризация)
 CnH2n СmH2m
+ СqH2q
(распад)
CnH2n СmH2m
+ СqH2q
(распад)
СmH2m-2 + СqH2q+2 (распад) СmH2m-2 + Н2 (деструктивная конденсация)
Условия пиролиза (температура до 700оС и низкое давление) способствуют также протеканию реакций дегидрирования алкенов:
С 4Н8 С4Н6 + Н2
Диолефины при температурах около 700оС весьма склонны к уплотнению путем полимеризации:
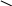
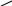
 СН=СН2
СН=СН2
 2СН2=СН–СН=СН2
2СН2=СН–СН=СН2
винилциклогексен
и конденсации с алкенами с образованием циклических углеводородов (реакции диенового синтеза или Дильса-Альдера):
СН2

 СН СН2
СН СН2
 СН
+ СН2 -2Н2
СН
+ СН2 -2Н2
СН2
При условиях термических процессов при 450-500оС термодинамически возможны реакции распада алкенов до низших алкенов, диенов и алканов, образование аренов, а при более высокой температуре – ацетилена.
Распад алкенов происходит в основном по цепному механизму.
Этилен при высокой температуре и низком давлении дегидрируется с образованием ацетилена и водорода.
СН2=СН2 СН2=СН + Н
СН2=СН СНСН + Н
СН2=СН2 + Н СН2=СН + Н2
При более низкой температуре ( 600оС) винильный радикал может вступать только в реакцию присоединения к исходному этилену, и цепной процесс развивается:
СН2=СН2 + СН2=СН СН2=СНСН2СН2


(а) (б) СН2=СН2
СН2=СН –СН=СН2 + Н СН2=СН–СН2–СН3 + СН2=СН
Чем ниже температура и выше давление, тем больше роль реакции (б) с накоплением бутилена и меньше роль реакции (а) с образованием бутадиена.
Пропилен при высокой температуре и низком давлении распадается с образованием Н2, СН4, С2Н4 и аллена (СН2=С=СН2):
СН3СН=СН2 Н + СН2=СНСН2
СН2=СНСН2 СН2=С=СН2 + Н
 Н2
+ СН2=СНСН2
Н2
+ СН2=СНСН2
С Н3СН=СН2
+ Н
Н3СН=СН2
+ Н
СН2=СНСН2 СН3 + СН2=СН2
СН3 + СН3СН=СН2 СН4 + СН2=СНСН2
При относительно невысокой температуре (600-700оС) и атмосферном давлении основной реакции аллильного радикала становится присоединение по двойной связи к исходной молекуле:
СН2=СНСН2СН2СНСН3
С Н2=СНСН2 + СН3СН=СН2 СН3
СН2=СНСН2СНСН2
Реакции радикалов С6Н11 дают сложную смесь продуктов – в основном образуются бутадиен, бутилен, пропилен, этилен, метан, водород и жидкие продукты.
Циклоалкены более устойчивы, чем алкены. Циклогексен устойчив до 600оС, при более высокой температуре он дегидрируется в бензол.
Алкадиены и алкины термически более устойчивы, чем алкены. При относительно невысокой температуре ( 400оС) и давлении, близком к атмосферному, алкадиены превращаются быстрее других классов соединений. Основное направление реакции – диеновый синтез, протекающий по молекулярному механизму:
Ацетилен при этих температурах может конденсироваться в арены.
При температуре 450-1100оС диеновый синтез протекает в незначительной степени, основном идет радикально-цепное разложение. Термическое разложение бутадиена приводит к образованию сложной смеси продуктов конденсации – винилциклогексен, бензол и его производные, Н2, СН4, С2Н6. Ацетилен в этих же условиях дает сложную смесь аренов (бензола, стирола, нафталина, антрацена, фенантрена, пирена, хризена и др.). При более высоких температурах преобладает распад с образованием бутадиена ацетилена, а из ацетилена – винилацетилена, диацетилена и арена:
2СНСН СНС + СН=СН2
С НС + СНСН СНС–СН=СН

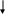
-Н + СНСН -СНС +СНСН
СНС–ССН СНС–СН=СН2 СНС–СН=СНСН=СН
+СНСН -СНС
С6Н5 С6Н6
Для нафтеновых углеводородов предпочтительным являются следующие превращения при высоких температурах:
Деалкилирование. При температуре около 500оС расщепление происходит главным образом посередине боковой цепи. Продолжение нагрева приводит к укорачиванию боковой цепи. Полное деалкилирование возможно лишь при более высоких температурах. Повышение давления препятствует деалкилированию. Труднее всего отщепляется метильная и этильная группы.
Дегидрирование. Реакции благоприятствует пониженное давление.
Дециклизация. При 500-600оС нафтены распадаются на 2 олефина
Распад нафтенов не имеет цепного характера. Термодинамически и кинетически реакция распада конкурирует с реакцией дегидрирования. Поэтому в продуктах всегда присутствуют непредельные и ароматические углеводороды. При 700-800оС циклогексан распадается иначе, с образованием этана и бутадиена:
С 6Н12 С2Н6 + СН2=СН–СН=СН2
Термодинамически наиболее выгодны распад циклоалканов до элементов и дегидрирование циклопентанов до циклопентадиенов, циклогексанов до соответствующих аренов. Фактически при термическом разложении циклоалканов образуются главным образом низшие алкены (С2 –С3), СН4, С2Н6, С4Н8, Н2 и диены. Термодинамически возможные реакции ароматизации и изомеризации в алкены с тем же числом С-атомов не протекают.
Первичный распад С–С-связи происходит с образованием бирадикала, который распадается на стабильные молекулы:

СН2СН2СН2СН2СН2СН2

СН2=СНСН2СН2СН2СН3
СН2=СНСН2СН2СН2СН3
С2Н4 + СН2СН2СН2СН2 2С2Н4
СН2СН2СН2СН2СН2СН2 СН2=СНСН2СН3 + С2Н4
2СН2=СНСН3
Реакция протекает по нецепному механизму.
Первичный распад С–Н-связи с образованием монорадикалов протекает медленно, и цепная реакция ввиду малой скорости инициирования практически не идет. Однако накопление продуктов реакции – алкенов, содержащих сопряженную с двойной связью С–С, резко облегчает инициирование цепей.
В результате при небольшой глубине крекинга цепной процесс становится быстрее реакции, протекающей через бирадикал, и в начальных стадиях самоускоряется.
СН3СН2СН=СН2 СН3 + СН2СН=СН2
Н
+ СН3 + СН4


СН2=СНСН2СН2СН2СН2
СН2=СНСН2СН2СН2СН2
СН2=СН2 +
СН2=СНСН2СН2![]()
![]() СН2=СНСНСН2СН2СН3
СН2=СНСНСН2СН2СН3
+С6Н12
СН2=СНСН2СН3 + С6Н11 СН2=СНСН=СН2 + СН2СН3
+С6Н12
С2Н6 + С6Н11
Ароматические углеводороды наиболее термически устойчивы. Поэтому они накапливаются в жидких продуктах с повышением температуры термодеструктивного процесса.
Арены с длинными боковыми цепями способны деалкилироваться. Преимущественно отрыв происходит между 1 и 2 атомами углерода боковой цепи, т.е. в -положении от углерода кольца. Поэтому при деалкилировании получаются главным образом толуол и ксилолы.
Бензол, нафталин, антрацен и др. голоядерные арены практически не подвергаются распаду. Единственным направлением их превращений является конденсация с выделением водорода. В результате происходит накопление полициклических ароматических углеводородов:
С 6Н6 + С6Н6 С6Н5 –С6Н5 + Н2
дифенил
Термическая устойчивость аренов сильно изменяется в зависимости от строения. Незамещенные и метилзамещенные бензол и нафталины значительно более устойчивы, чем алканы. Алкилзамещенные арены (С2) разлагаются быстрее алканов. При очень высоких температурах незамещенные арены распадаются на элементы. В условиях термических процессов незамещенные арены подвергаются дегидроконденсации и уплотнению по цепному механизму:
С6Н5 + С6Н6 С6Н5–С6Н5 + Н
Н + С6Н6 Н2 + С6Н5
В результате образуется дифенил и водород.
Толуол при малой глубине крекинга подвергается разложению:
С6Н5–СН3 С6Н5–СН2 + Н
Н2 + С6Н5–СН2
 Н
+ С6Н5–СН3
Н
+ С6Н5–СН3
Н С6Н6 + СН3
СН3
СН3 + С6Н5–СН3 СН4 + С6Н5–СН2
2С6Н5–СН2 С6Н5–СН2–СН2–С6Н5
Бензильный радикал С6Н5–СН2 малоактивен, он вступает главным образом в реакции рекомбинации, и цепи не развиваются.
С повышением температуры концентрация бензильных радикалов при крекинге толуола возрастает за счет распада С–С-связи в дибензиле. Образуются метилдифенилметан и дифенилметан.
Арены с длинными боковыми цепями в условиях термических процессов подвергаются распаду алкильных цепей. Разрыв происходит по -связи от бензольного кольца:
С6Н5–СН2 СН2–R C6H5–CH2 + CH2–R
Основными продуктами процесса является толуол, стирол и алкан:
С6Н5–СН2 + С6Н5–СН2–СН2–R C6H5–CH3 + C6H5–CH–CH2–R
C6H5–CH–CH2–R C6H5–CH=CH2 + R
R + С6Н5–СН2–СН2–R RH + C6H5–CH–CH2–R
Контрольные вопросы
Сущность процесса термического крекинга и пиролиза.
Назовите продукты процессов термического крекинга и пиролиза и
дайте им характеристики.
Термические превращения углеводородов.
Литература
Магарил Р.З. Теоретические основы химических процессов переработки нефти. Химия, 1985. -279 с.
Ахметов С.А. Технология глубокой переработки нефти и газа. – Уфа: «Гилем», 2002. – 672 с.
