
- •Содержание
- •Глоссарий 7
- •Конспект лекционных занятий
- •3. Практические занятия
- •4. Лабораторные занятия
- •5. Самостоятельная работа студентов
- •7 Экзаменационные вопросы 181
- •8 Технические средства обучения 182
- •Список рекомендуемой литературы 182
- •1. Глоссарий
- •2 Конспект лекционных занятий модуль 1 Лекция № 1. Перспективы развития технологии органических веществ (2 часа)
- •0,5 О2 носн2-сн2он
- •О носн2-сн2nh2
- •Лекция № 2. Физико-химические основы термического крекинга
- •Лекция № 3. Физико-химические основы каталитического крекинга
- •Лекция № 4. Физико-химические основы каталитического риформинга
- •Лекция № 5. Физико-химические основы гидрогенизационных процессов
- •Лекция № 7. Химизм и механизм технологических процессов переработки нефтяных газов
- •Лекция № 8 Технологическое оборудование и технологическое оформление основных аппаратов процессов переработки органических веществ
- •Лекция № 10 Теоретические основы очистки нефтяных фракций
- •Лекция № 11 Адсорбционные и каталитические методы очистки
- •Лекция № 12 Очистка с применением избирательных растворителей
- •Лекция № 13 Депарафинизация масел и дизельных фракций
- •3. Практические занятия
- •Практическое занятие №1
- •Тема: Расчетные методы определения физико-химических свойств
- •И состава нефти и нефтепродуктов
- •Задачи для решения
- •Практическое занятие №2 Тема: Расчетные методы вычисления материального баланса процесса термического крекинга
- •Составление материального баланса
- •Задачи для решения
- •Практическое занятие №3 Тема: Составление материального баланса процесса каталитического крекинга
- •Задачи для решения
- •Практическое занятие №4 Тема: Составление материального баланса процесса каталитического риформинга
- •Задачи для решения
- •Практическое занятие №5 Тема: Расчетные методы вычисления материального баланса гидрогенизационных процессов
- •Задачи для решения
- •Практическое занятие №6 Тема: Расчетные методы вычисления материального баланса процесса полимеризационных процессов
- •Задачи для решения
- •Практическое занятие №7 Тема: Задачи и упражнения по составлению уравнений химических реакций, протекающих при алкилировании и изомеризации с указанием механизма ее протекания
- •Задачи для решения
- •Практическое занятие №8 Тема: Технологический расчет основных аппаратов установок переработки органических веществ
- •Число тарелок
- •Практическое занятие №9 Тема: Приближенные методы построения линии однократного испарения (ои)
- •Задачи для решения
- •Практическое занятие №10 Тема: Решение задач по теоретическим основам процесса очистки нефтяных фракций
- •Задачи для решения
- •Практическое занятие №11 Тема: Решение задач по депарафинизации нефтяных фракций
- •Задачи для решения
- •Практическое занятие №12 Тема: Решение задач по закономерностям получения гомогенных растворов
- •Задачи для решения
- •4. Лабораторные занятия лабораторная работа №1 Тема: Термический крекинг (пиролиз) углеводородов и составление материального баланса опыта
- •Описание установки и методика проведения работы
- •Лабораторная работа №2 Тема: Каталитический крекинг углеводородов и составление материального баланса опыта
- •Проведение работы
- •Оформление результатов работы
- •Методика проведения эксперимента
- •Приготовление алюмохромового оксидного катализатора
- •Методика выполнения работы
- •Лабораторная работа №5 Тема: Полукоксование
- •Описание установки и методика проведения работы
- •Лабораторная работа №6 Аппараты установок термических и каталитических процессов. Тема: Методы разделения и анализа продуктов реакций
- •Методика проведения работы
- •Методика проведения работы
- •Лабораторная работа №7 Тема: Разгонка нефти на ректификационном аппарате
- •Лабораторная работа №8 Тема: Очистка сырой нефти от влаги и механических примесей
- •Определение сухого остатка
- •Методика определения
- •Прокаленный остаток
- •Методика определения
- •Лабораторная работа №9 Тема: Депарафинизация бензиновой фракции карбамидным методом
- •Методика определения
- •Лабораторная работа №10 Тема: Адсорбционная очистка масляных дистиллятов
- •Порядок выполнения работ
- •5. Самостоятельная работа студентов под руководством преподавателей (срсп) срсп №1. Реакционная способность органических соединений. Электронные эффекты
- •Срсп № 2. Классификация органических реакций
- •Срсп № 3. Характеристика основных механизмов реакций органических соединений
- •Срсп № 4. Образование пироуглерода и сажи
- •Срсп №5. Термические превращения углеводородов в жидкой фазе
- •Срсп №6. Процесс коксования нефтяного сырья
- •Срсп №7. Кислотный катализ
- •Реакции карбкатионов
- •Срсп №8. Классификация каталитических реакций и катализаторов
- •Энергия активации каталитической реакции
- •Срсп №9. Кинетика газофазных реакций в присутствии твердых катализаторов
- •Срсп №10. Теоретические основы подготовки и переработки газообразного сырья
- •6. Самостоятельная работа студентов срс
- •7 Экзаменационные вопросы
- •8 Технические средства обучения
- •Список рекомендуемой литературы
- •9.1 Основная литература
- •9.2 Дополнительная литература
Срсп №9. Кинетика газофазных реакций в присутствии твердых катализаторов
Реакция газофазных реагентов на твердом катализаторе складывается из следующих стадий: 1) диффузия реагентов из газового потока к внешней поверхности частиц катализатора (внешняя диффузия); 2) диффузия реагентов в поры катализатора (внутренняя диффузия); 3) адсорбция реагентов на поверхности катализатора; 4) химическая реакция на поверхности катализатора; 5) десорбция продуктов реакции; 6) диффузия продуктов реакции в порах катализатора; 7) диффузия продуктов реакции от внешней поверхности частиц катализатора в газовой поток.
При установившемся режиме скорости всех стадий равны. Обычно одна из стадий лимитирует скорость суммарного процесса. Лимитирует скорость процесса та стадия, скорость которой в данных условиях предельна и не может повыситься при повышении скорости остальных стадий. Скорость суммарного процесса равна скорости лимитирующей стадии. В зависимости от того, какая из стадий является лимитирующей, различают области протекания реакции: внешнедиффузионную, внутридиффузионную и т.д.
Внешнедиффузионная область. Скорость диффузии () из газового потока к поверхности описывается первым законом Фика:

где Dм – коэффициент молекулярной диффузии; S – поверхность катализа-тора; С – концентрация реагента в газовом объеме; с – концентрация реагента на поверхности катализатора; эфф – эффективная толщина пограничного слоя, через который идет диффузия. На внешней поверхности этого слоя концентрация реагента равна концентрации его в газовом потоке и поддерживается в результате конвективной диффузии.
Если скорость внешней диффузии лимитирует скорость остальных стадий, то С с и (С - с) С.
Кинетическая теория газов дает для коэффициента молекулярной диффузии следующее выражение:
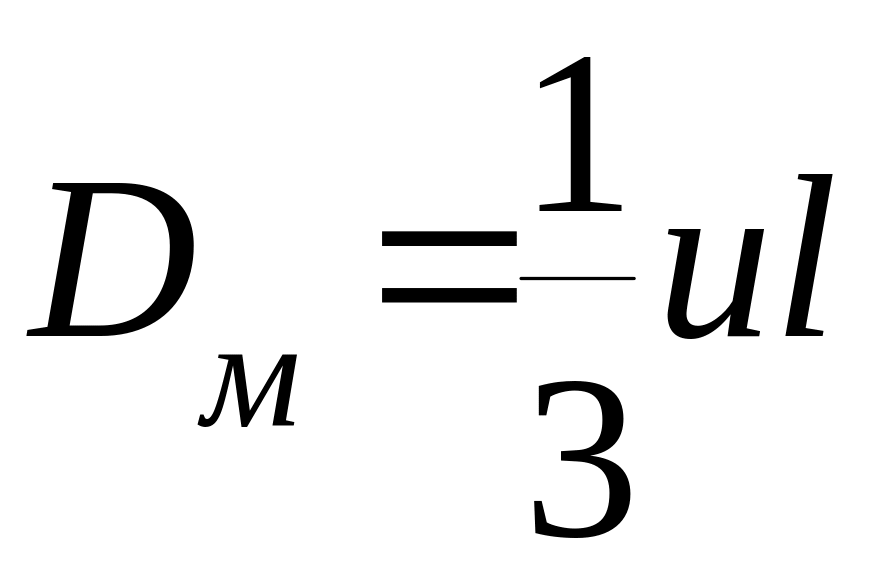
где
u
– средняя скорость движения молекул;
l
– средняя длина свободного пробега
молекул; u
– (8kТ/m)1/2;
l
= kТ/![]() d2p,
где k-константа
Больцмана; Т-абсолютная температура;
m-масса
молекулы; d-диаметр
молекулы; P-давление
газа.
d2p,
где k-константа
Больцмана; Т-абсолютная температура;
m-масса
молекулы; d-диаметр
молекулы; P-давление
газа.
Коэффициент молекулярной диффузии пропорционален температуре в степени 1,5, т.е. зависит от температуры очень мало, обратно пропорционален давлению, молекулярной массе диффундирующего вещества в степени ½ и квадрату диаметра молекулы.
Эффективная толщина пограничного слоя зависит от формы частиц катализатора и гидродинамики потока и не может быть определена теоретически. Поэтому значение Dм/ = , называемое коэффициентом масса-передачи, определяется экспериментально.
Внутридиффузионная область. Поверхность пор высокопористого катализатора составляет практически всю поверхность, на которой может происходить реакция; внешняя поверхность частиц катализатора обычно не превышает 0,01%. Если реакция протекает медленно относительно внешней диффузии, то молекулы реагентов диффундирует в поры катализатора. Сталкиваясь со стенками пор, они с некоторой вероятностью могут адсорбироваться и прореагировать; в результате концентрация реагентов по длине поры уменьшается. Если реакция протекает достаточно быстро, то уже недалеко от устья поры концентрация реагентов равна нулю и реакция проходит только на части поверхности поры, составляющей некоторой доле ее длины. Такой механизм протекания реакции называется внутридиффузионным.
Диффузия в порах не предшествует реакции, подобно внешней диффузии, а идет вместе с реакцией, и скорость реакции поэтому зависит и от диффузионных, и от кинетических факторов. Если диаметр пор катализатора больше длины свободного пробега (l) диффундирующей молекулы, то движению молекул в заданном направлении препятствуют столкновения их между собой. В этом случае скорость диффузии пропорциональна коэффициенту молекулярной диффузии. Если диаметр пор меньше длины свободного пробега молекул, то столкновения их со стенками поры происходит чаще, чем между собой, и скорость диффузии выражается уравнением:
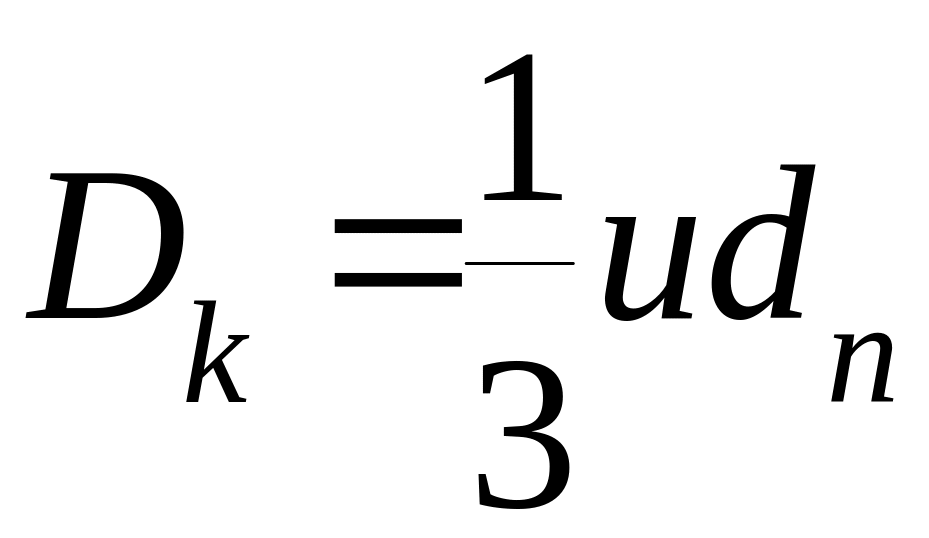
где dn – диаметр поры.
Dk называется коэффициентом диффузии Кнудсена. Он не зависит от давления, пропорционален диаметру пор и Т1/2.
При атмосферном давлении длина свободного пробега молекул l10-5 см, и для пор диаметром 10 нм и менее протекает диффузия Кнудсена. Так как длина свободного пробега обратно пропорциональна давлению, то с его увеличением диаметр пор, при котором осуществляется диффузия Кнудсена, снижается. При 10 Мпа l10-7 см и для пор диаметром более 1 нм осуществляется молекулярная диффузия.
Так как поры в частице катализатора сильно различаются по диаметру и форме, целесообразно рассматривать эти частицы как однородные, в которых диффузия идет с некоторым эффективным коэффициентом диффузии Dэф. В общем виде
 или
или

где - доля объема частицы катализатора, приходящаяся на поры; - коэффициент извилистости пор; = 0,05-0,95.
Если глубина частицы катализатора, на которой реакция заканчивается, значительно меньшее ее радиуса, но значительно больше диаметра пор, то скорость реакции в расчете на единицу объема частицы катализатора () во внутридиффузионной области равна:
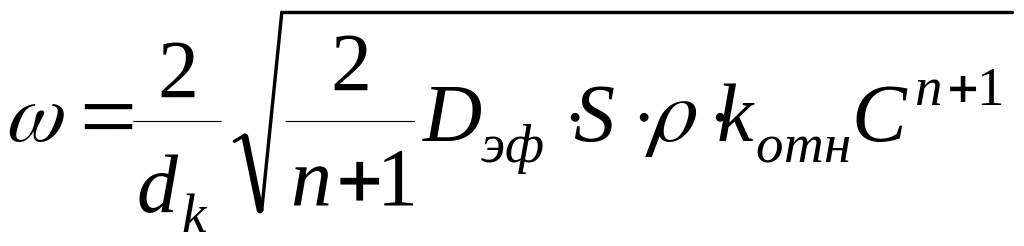
где dk – диаметр частицы катализатора; n – порядок реакции; Dэф – эффективный коэффициент диффузии, пропорциональный DМ при dn l и Dk при dn l; S – удельная поверхность катализатора; - плотность частиц катализатора; kотн – константа скорости реакции, отнесенная к единице поверхности; С – концентрация реагента в газовом объеме.
Порядок реакции во внутридиффузионной области равен (n+1)/2. Для реакций первого порядка наблюдаемый порядок равен истинному, для реакций, у которых 0 n 1, наблюдаемый порядок выше истинного и для реакций, имеющих порядок выше первого, во внутридиффузионной области наблюдаемый порядок ниже истинного.
Коэффициент диффузии можно считать независящим от температуры, и если константа скорости может быть выражена в форме уравнения Аррениуса, то

т.е. энергия активации во внутридиффузионной области протекания реакции равна половине энергии активации в кинетической области ее протекания. Скорость реакции обратно пропорциональна диаметру частиц катализатора и прямо пропорциональна корню квадратному из его удельной поверхности. Удельная поверхность пористого катализатора обратно пропорциональна диаметру пор. Поэтому, если осуществляется молекулярная диффузия, то скорость реакции пропорциональна диаметру пор в степени – 0,5. Если же осуществляется диффузия Кнудсена, то, так как коэффициент диффузии пропорционален диаметру пор, скорость реакции от диаметра пор не зависит.
Если скорость диффузии в порах много больше скорости реакции, то концентрация реагента в порах катализатора не меняется по его глубине и равна концентрации его в объеме. В этом случае поверхность катализатора используется полностью, и скорость реакции в единице объема частицы катализатора (полн) равна:
![]()
Отношение называемое фактором эффективности, показывает, какая часть катализатора используется при протекании реакции во внутридиффузионной области.
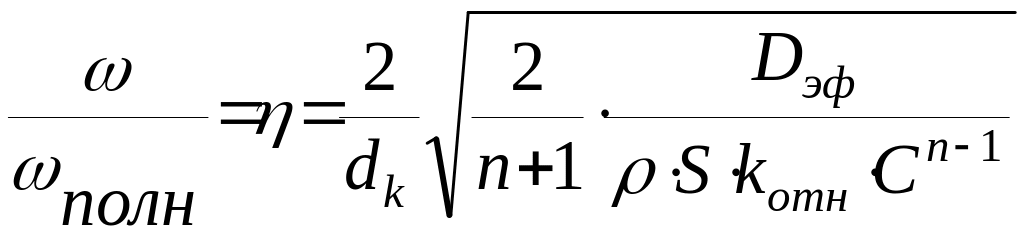
Значение можно определить и как относительную глубину проникновения реакции в частицу катализатора.
Контрольные вопросы
Напишите формулу для определения коэффициента молекулярной диффузии.
Какой механизм протекания реакции называется внутридиффузионным?
Дайте определение фактора эффективности.
Литература
1. Р.З.Магарил. Теоретические основы химических процессов переработки нефти. 1985.
2. В.Н.Эрих, М.Г.Расина, М.Г.Рудин. Химия и технология нефти и газа. 1977.
