
- •Содержание
- •Глоссарий 7
- •Конспект лекционных занятий
- •3. Практические занятия
- •4. Лабораторные занятия
- •5. Самостоятельная работа студентов
- •7 Экзаменационные вопросы 181
- •8 Технические средства обучения 182
- •Список рекомендуемой литературы 182
- •1. Глоссарий
- •2 Конспект лекционных занятий модуль 1 Лекция № 1. Перспективы развития технологии органических веществ (2 часа)
- •0,5 О2 носн2-сн2он
- •О носн2-сн2nh2
- •Лекция № 2. Физико-химические основы термического крекинга
- •Лекция № 3. Физико-химические основы каталитического крекинга
- •Лекция № 4. Физико-химические основы каталитического риформинга
- •Лекция № 5. Физико-химические основы гидрогенизационных процессов
- •Лекция № 7. Химизм и механизм технологических процессов переработки нефтяных газов
- •Лекция № 8 Технологическое оборудование и технологическое оформление основных аппаратов процессов переработки органических веществ
- •Лекция № 10 Теоретические основы очистки нефтяных фракций
- •Лекция № 11 Адсорбционные и каталитические методы очистки
- •Лекция № 12 Очистка с применением избирательных растворителей
- •Лекция № 13 Депарафинизация масел и дизельных фракций
- •3. Практические занятия
- •Практическое занятие №1
- •Тема: Расчетные методы определения физико-химических свойств
- •И состава нефти и нефтепродуктов
- •Задачи для решения
- •Практическое занятие №2 Тема: Расчетные методы вычисления материального баланса процесса термического крекинга
- •Составление материального баланса
- •Задачи для решения
- •Практическое занятие №3 Тема: Составление материального баланса процесса каталитического крекинга
- •Задачи для решения
- •Практическое занятие №4 Тема: Составление материального баланса процесса каталитического риформинга
- •Задачи для решения
- •Практическое занятие №5 Тема: Расчетные методы вычисления материального баланса гидрогенизационных процессов
- •Задачи для решения
- •Практическое занятие №6 Тема: Расчетные методы вычисления материального баланса процесса полимеризационных процессов
- •Задачи для решения
- •Практическое занятие №7 Тема: Задачи и упражнения по составлению уравнений химических реакций, протекающих при алкилировании и изомеризации с указанием механизма ее протекания
- •Задачи для решения
- •Практическое занятие №8 Тема: Технологический расчет основных аппаратов установок переработки органических веществ
- •Число тарелок
- •Практическое занятие №9 Тема: Приближенные методы построения линии однократного испарения (ои)
- •Задачи для решения
- •Практическое занятие №10 Тема: Решение задач по теоретическим основам процесса очистки нефтяных фракций
- •Задачи для решения
- •Практическое занятие №11 Тема: Решение задач по депарафинизации нефтяных фракций
- •Задачи для решения
- •Практическое занятие №12 Тема: Решение задач по закономерностям получения гомогенных растворов
- •Задачи для решения
- •4. Лабораторные занятия лабораторная работа №1 Тема: Термический крекинг (пиролиз) углеводородов и составление материального баланса опыта
- •Описание установки и методика проведения работы
- •Лабораторная работа №2 Тема: Каталитический крекинг углеводородов и составление материального баланса опыта
- •Проведение работы
- •Оформление результатов работы
- •Методика проведения эксперимента
- •Приготовление алюмохромового оксидного катализатора
- •Методика выполнения работы
- •Лабораторная работа №5 Тема: Полукоксование
- •Описание установки и методика проведения работы
- •Лабораторная работа №6 Аппараты установок термических и каталитических процессов. Тема: Методы разделения и анализа продуктов реакций
- •Методика проведения работы
- •Методика проведения работы
- •Лабораторная работа №7 Тема: Разгонка нефти на ректификационном аппарате
- •Лабораторная работа №8 Тема: Очистка сырой нефти от влаги и механических примесей
- •Определение сухого остатка
- •Методика определения
- •Прокаленный остаток
- •Методика определения
- •Лабораторная работа №9 Тема: Депарафинизация бензиновой фракции карбамидным методом
- •Методика определения
- •Лабораторная работа №10 Тема: Адсорбционная очистка масляных дистиллятов
- •Порядок выполнения работ
- •5. Самостоятельная работа студентов под руководством преподавателей (срсп) срсп №1. Реакционная способность органических соединений. Электронные эффекты
- •Срсп № 2. Классификация органических реакций
- •Срсп № 3. Характеристика основных механизмов реакций органических соединений
- •Срсп № 4. Образование пироуглерода и сажи
- •Срсп №5. Термические превращения углеводородов в жидкой фазе
- •Срсп №6. Процесс коксования нефтяного сырья
- •Срсп №7. Кислотный катализ
- •Реакции карбкатионов
- •Срсп №8. Классификация каталитических реакций и катализаторов
- •Энергия активации каталитической реакции
- •Срсп №9. Кинетика газофазных реакций в присутствии твердых катализаторов
- •Срсп №10. Теоретические основы подготовки и переработки газообразного сырья
- •6. Самостоятельная работа студентов срс
- •7 Экзаменационные вопросы
- •8 Технические средства обучения
- •Список рекомендуемой литературы
- •9.1 Основная литература
- •9.2 Дополнительная литература
Срсп № 3. Характеристика основных механизмов реакций органических соединений
Для практического понимания органического синтеза необходимо в совершенстве овладеть определенными фундаментальными типами реакций, которые лежат в основе широкого разнообразия индивидуальных реакций. Большинство органических реакций протекают в нескольких реакциях. Эти стадии и составляют механизм реакций.
Первоначально под механизмом реакций понимали набор последовательных стадий сложного процесса. Например, реакция Гофмана может быть описана следующими стадиями:
N aOH
+ Br2
NaOBr + HBr
aOH
+ Br2
NaOBr + HBr
O
R – C + NaOBr R – NH2 + CO2 + NaBr
NH2
Характеризуя исходное и конечное состояние системы, это уравнение, однако, ничего не говорит о том, как протекает реакция. В настоящее время считают, что эта перегруппировка идет через ряд последовательных стадий с образованием в условиях реакции нестабильных промежуточных продуктов (интермедиатов).
O O
R – C + Br2 + OH- R – C + Br-
NH2 -H2O NHBr
O +OH- O O +OH-
R – C R – C R – C R – N = C = O
NHBr NBr нитрен N: изоцианат
_ OH O- +H+
R – N – C R – NH — C R – NH2 + CO2
O O
На отдельных стадиях могут получаться как относительно стабильные соединения (изоцианаты), так и малостабильные высокореакционноспособные частицы (ионы и нитрены). Совокупность последовательных элементарных стадий и называются механизмом процесса.
Дальнейшее развитие теоретических представлений привело к тому, что в настоящее время при рассмотрении механизма процесса не ограничиваются перечислением элементарных стадий, а подробно исследуют, каким образом каждая из этих стадий осуществляются, как происходит разрыв старых и образование новых связей, какие изменения претерпевает сольватная оболочка и т.д.
Элементарные стадии можно классифицировать по способу нарушения или образования химических связей. Наиболее часто встречаются ионные, или гетеролитические, и радикальные, или гомолитические процессы. При гетеролитическом образовании связи один из атомов предоставляет пару электронов, а второй свободную орбиталь:
В : + А+ В – А
Гетеролитический разрыв связи происходит аналогично:
В : А В: + А+
При гомолитическом образовании связи каждый из атомов предоставляет один электрон:
А ∙ + В∙ А : В
При гетеролитическом образовании связи атом, имеющий пару электронов, за счет которой образуется ковалентная связь, называют нуклеофильным и реакции с участием таких реагентов рассматривают как реакции нуклеофильного замещения, присоединения или отщепления. Частица, предоставляющая свободную орбиталь для образования связи, называется электрофильной, и реакции с участием таких реагентов рассматривают как реакции электрофильного замещения, присоединения или отщепления.
Реакции нуклеофильного замещения у насыщенного атома углерода в настоящее время можно считать изученными в большей степени, чем другие типы реакций. В изучении механизмов реакций большой вклад внесли английские ученые Ингольд и Хьюз.
В общем виде реакцию нуклеофильного замещения можно представить следующей схемой:
Y : + R → X R : Y + X:
AN DN
т.е. можно сказать следующим образом: нуклеофильное замещение (SN) является результатом нуклеофильной атаки (AN) У: на центр с пониженной электронной плотностью (R) и анионоидного отрыва (DN) группы Х:. Отрыв DN чаще всего вызывается именно атакой AN, однако иногда отрыв DN может быть и первой стадией реакции.
В качестве нуклеофильного агента У: может вступать как анион, так и нейтральная молекула, обладающая хотя бы одной неподеленной парой электронов (кислоты Льюиса):
H-, R3С-, OH-, OR-, RS-, CN- , :NR3, H2O:, R-OH и т.д.
Уходящая группа Х: обычно обладает высокой электроотрицательностью и может уходить как в виде аниона, так и в виде незаряженной молекулы с парой электронов, например: галогены Х-, кислород -О-, сера -S-, азот R2N-, R3N+ и т.д.
К электрофильным реагентам относятся ионы и молекулы, имеющие достаточно низкую по энергии свободную орбиталь (кислоты Льюиса):
+
H+, R+, AlR3, Br+, Cl+, BF3, R – C = O и т.д.
Таким образом, процесс гетеролитического образования ковалентной связи, т.е. реакцию между электрофилом и нуклеофилом, можно рассматривать как кислотно-основное взаимодействие.
Различают несколько типов реакций нуклеофильного замещения.
Реакции, проходящие в результате атаки и последующего отрыва. К таким реакциям относятся реакции с участием атомов sp2- углерода
O О- О
R–C + Y- R–C OR R–C + OR
OR Y Y
Реакции, проходящие в результате атаки и одновременного отрыва. Это случай реакций с участием атомов sp3-углерода
 Y-
+ C – Z [Y ---- C ---- Z ]-
Y – C + Z-
Y-
+ C – Z [Y ---- C ---- Z ]-
Y – C + Z-
Реакции, в которых отрыв предшествует атаке.
R
R +Y- R
R C – Z С + Z- R – C Y
R R
R R
Нуклеофильное замещение, катализируемое кислотами. Для замещения одной нуклеофильной группы на другую иногда требуется предварительная электрофильная атака на гетероатом. Например, в случае спиртов, гидроксильная группа недостаточно склонна к анионоидному отрыву, однако легко удаляется в виде аниона оксония после протонирования.
Н
С – О – Н + Н+ С – О – Н С+ + НОН
С+ + Х- С – Х
5. Замещение через элиминирование – присоединение. В некоторых случаях замещение происходит в результате двух последовательных реакций элиминирования и присоединения с промежуточным образованием производного, имеющего двойную или тройную связь.
Н H
+ HY
– С – С – C = C – C – C –
- HZ
Z Y
Н H
+ HY
С = С – C C – C = C
- HZ
Z Y
Эти схемы иллюстрируют взаимоотношения продукта и субстрата в реакциях нуклеофильного замещения, но ничего не говорят о механизме. Механизмы этих реакций определили Хьюз и Ингольд. Это механизм прямого замещения (бимолекулярное замещение SN2) и ионизационный механизм (мономолекулярное замещение SN1).
SN2 – механизм. При таком механизме приближение нуклеофильного реагента вызывает анионоидный отрыв. В этой реакции AN и DN происходит синхронно, без образования интермедиата (промежуточного соединения) через переходное состояние, которое определяет скорость реакции. Переходное состояние соответствует состоянию sp3d-гибридизации

[Y --- C --- X]-

Переходное состояние возникает в результате слияния занятой орбитали нуклеофильного реагента У с вакантной разрыхляющей орбиталью связи С – Х .
Нуклеофильный агент атакует субстрат с противоположной стороны уходящей группы, в результате молекула приобретает конфигурацию, противоположную к исходной молекуле. Нуклеофильная группа «выталкивает» уходящий заместитель.
:
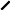
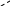
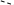
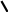 У-
+ С
– Х У С + :Х-
У-
+ С
– Х У С + :Х-
Поскольку атакующие частицы непосредственно участвуют в стадии, определяющей скорость реакции, то скорость реакции зависит не только от их концентрации, но также и от химической природы нуклеофила. Поэтому важны структурные эффекты как субстрата, так и нуклеофила. Отщеплению уходящей группы в переходном состоянии содействует нуклеофил.
SN1 – механизм. При таком механизме отрыв DN предшествует нуклеофильной атаке AN и эта стадия является лимитирующей скорость реакции. Образующийся ион затем подвергается атаке нуклеофильным агентом, присутствующим в реакционной среде.
+ У-
С Х- С+ С – У
Возможно образование продукта обратной конфигурации, т.к. промежуточный карбкатион плоский и может подвергаться атаке независимо с любой стороны его плоскости.
Реакции SN1 иногда приводят к «аномальному» замещению, если карбкатион выступает в неклассической форме или если он может претерпевать перегруппировку в процессе реакции. Так происходит, например, с неопентильными производными:
СН3 СН3 У
У-
СН3–С–СН2–Х СН3–С–С+Н2 СН3–С+–СН2–СН3 СН3–С–СН2– СН3
СН3 СН3 СН3 СН3
В некоторых случаях образуется истенное промежуточное соединение, и реакция включает тогда последовательное элиминирование и присоединение. Именно это наблюдается в случае -галогенкетонов:
X H O O H O
+H+Y-
– C – C – C – R – C = C – C – R Y – C – C – C - R
– HX
Электрофильное замещение (SE) происходит в результате электрофильной атаки АЕ на частицу с электронодефицитной оболочкой и катионоидного отрыва DE, при котором уходящая группа оставляет свою пару электронов связи. Электрофильное замещение может происходить в случае следующих структур: атомов углерода в состоянии sp2-гибридизации, в частности атомов углерода ароматического ядра (обычно реакция включает две стадии: атаку АЕ и затем отрыв DE)
Можно представить два возможных механизма замещения протона в ароматической молекуле на электрофильный реагент.
1) Отщепление протона может происходить одновременно с образованием новой связи с электрофильным реагентом Е, в этом случае реакция будет идти в одну стадию:
 Н
Н
Е+ + Н – Е – + Н+
Е
2) Первоначально происходит присоединение электрофильного агента к -системе ароматического ядра, образуется малостабильный интермедиат (промежуточное соединение). Далее происходит отщепление протона от образовавшегося катиона под действием основания, в качестве которого может вступить молекула растворителя:

 Н
+ В
Н
+ В
 Н
+ Е+ +
Е + НВ+
Н
+ Е+ +
Е + НВ+
Е
Реакции, идущие по этому механизму, должны характеризоваться высокой чувствительностью скорости к электронным эффектам заместителей, т.к. интермедиат является катионом.
При взаимодействии ароматических соединений с электрофильными реагентами может происходить образование двух типов комплексов, которые могут быть интермедиатами в реакциях SE. Если электрофильный агент не разрушает существенным образом электронную -систему ароматического ядра, образуются -комплексы. Так, бензол при -78оС образует с хлористым водородом комплекс в мольном отношении 1 : 1, причем реакция обратима.


 +
НС1 Н – С1
+
НС1 Н – С1
-комплекс
В присутствии электроноакцепторных соединений, например, кислоты Льюиса (А1С13) образуется комплекс, отличающийся от -комплекса. Такой обмен свидетельст-вует об образовании так называемого -комплекса, в котором Н+ или Е+ образует истенную связь с атомом углерода кольца:
H Е
 AlCl3
AlCl3
 +
ЕCl
+ AlCl4-
+
ЕCl
+ AlCl4-
Атом углерода связанный с Н и D находится в состоянии sp2-гибридизации, положитель-ный заряд распределяется по остальным пяти атомам углерода кольца с участием -орбиталей.
Реакция может быть завершена путем удаления протона и -комплекса при действии А1С14-, т.е.весь процесс в целом является электрофильным замещением.
Н Е Е
А1С14-
+ + НС1
Можно было бы ожидать, что превращение бензола в -комплекс, приводящее к утрате ароматической стабилизации, должно требовать значительного количества энергии, т.е. энергия активации реакции должна быть достаточно высокой, а ее скорость, следовательно, небольшой. В действительности же многие реакции SE в ароматических соединениях протекают очень быстро при комнатной температуре. Это связано с влиянием двух факторов, снижающих барьер, препятствующий образованию иона. Первый из них состоит в возможности использования энергии, выделяемой при образовании новой связи с атакующим электрофилом, а второй – в некоторой стабилизации положительно заряженного -комплекса за счет делокализации заряда:
Н Е Н Е Н Е Н Е

 +
+
+
+
+
+
+
Правила ориентации. В молекуле бензола все 6 атомов углерода равномерны, поэтому при SE образуется только одно вещество. Если же в ядре уже имеется заместитель, то он будет оказывать влияние на реакционную способность ароматического ядра в отношении дальнейших электрофильных атак и места последующих замещений.
Индуктивный эффект заместителей. Заместители, обладающие электронодонорными свойствами должны повышать электронную плотность кольца (+I-эффект). К таким заместителям относятся алкильные группы.
Индуктивный эффект большинства других заместителей, например, На1, ОН, ОR, NH2, SO3H и т.д. будет действовать в противоположном направлении, поскольку атомы, непосредственно связанные с кольцом, более электроотрицательны, чем углерод с которым они соединены (– I-эффект).
Однако индуктивный эффект не является единственным эффектом,
С

 Н3
С1 определяющим характер
взаимодействия между заместителем и
Н3
С1 определяющим характер
взаимодействия между заместителем и
ароматическим кольцом.
Мезомерный эффект заместителей (эффект сопряжения). Многие заместители содержат на атоме, непосредственно связанном с ароматическим кольцом, не поделенные пары электронов, которые могут вступать во взаимодействие с делокализованными -орбиталями:
RО : +OR +OR

Аналогичный эффект проявляют также заместители ОН,SH, NH2 и т.д.
Электронная плотность ароматического кольца при этом возрастает. Такой эффект называется +М-эффектом.
Противоположное влияние может иметь место, когда атом, который непосредственно соединен с кольцом, связан кратной связью с еще более электроотрицательным атомом. В этом случае вследствие сопряжения возникает взаимодействие между этим атомом и делокализованными -орбиталями кольца:
Н – С = О Н – С – О- Н – С – О-
+
+
Контрольные вопросы
Напишите несколько типов реакций нуклеофильного замещения.
Какая частица называется электрофильной?
Мезомерный эффект заместителей.
