
- •Содержание
- •Глоссарий 7
- •Конспект лекционных занятий
- •3. Практические занятия
- •4. Лабораторные занятия
- •5. Самостоятельная работа студентов
- •7 Экзаменационные вопросы 181
- •8 Технические средства обучения 182
- •Список рекомендуемой литературы 182
- •1. Глоссарий
- •2 Конспект лекционных занятий модуль 1 Лекция № 1. Перспективы развития технологии органических веществ (2 часа)
- •0,5 О2 носн2-сн2он
- •О носн2-сн2nh2
- •Лекция № 2. Физико-химические основы термического крекинга
- •Лекция № 3. Физико-химические основы каталитического крекинга
- •Лекция № 4. Физико-химические основы каталитического риформинга
- •Лекция № 5. Физико-химические основы гидрогенизационных процессов
- •Лекция № 7. Химизм и механизм технологических процессов переработки нефтяных газов
- •Лекция № 8 Технологическое оборудование и технологическое оформление основных аппаратов процессов переработки органических веществ
- •Лекция № 10 Теоретические основы очистки нефтяных фракций
- •Лекция № 11 Адсорбционные и каталитические методы очистки
- •Лекция № 12 Очистка с применением избирательных растворителей
- •Лекция № 13 Депарафинизация масел и дизельных фракций
- •3. Практические занятия
- •Практическое занятие №1
- •Тема: Расчетные методы определения физико-химических свойств
- •И состава нефти и нефтепродуктов
- •Задачи для решения
- •Практическое занятие №2 Тема: Расчетные методы вычисления материального баланса процесса термического крекинга
- •Составление материального баланса
- •Задачи для решения
- •Практическое занятие №3 Тема: Составление материального баланса процесса каталитического крекинга
- •Задачи для решения
- •Практическое занятие №4 Тема: Составление материального баланса процесса каталитического риформинга
- •Задачи для решения
- •Практическое занятие №5 Тема: Расчетные методы вычисления материального баланса гидрогенизационных процессов
- •Задачи для решения
- •Практическое занятие №6 Тема: Расчетные методы вычисления материального баланса процесса полимеризационных процессов
- •Задачи для решения
- •Практическое занятие №7 Тема: Задачи и упражнения по составлению уравнений химических реакций, протекающих при алкилировании и изомеризации с указанием механизма ее протекания
- •Задачи для решения
- •Практическое занятие №8 Тема: Технологический расчет основных аппаратов установок переработки органических веществ
- •Число тарелок
- •Практическое занятие №9 Тема: Приближенные методы построения линии однократного испарения (ои)
- •Задачи для решения
- •Практическое занятие №10 Тема: Решение задач по теоретическим основам процесса очистки нефтяных фракций
- •Задачи для решения
- •Практическое занятие №11 Тема: Решение задач по депарафинизации нефтяных фракций
- •Задачи для решения
- •Практическое занятие №12 Тема: Решение задач по закономерностям получения гомогенных растворов
- •Задачи для решения
- •4. Лабораторные занятия лабораторная работа №1 Тема: Термический крекинг (пиролиз) углеводородов и составление материального баланса опыта
- •Описание установки и методика проведения работы
- •Лабораторная работа №2 Тема: Каталитический крекинг углеводородов и составление материального баланса опыта
- •Проведение работы
- •Оформление результатов работы
- •Методика проведения эксперимента
- •Приготовление алюмохромового оксидного катализатора
- •Методика выполнения работы
- •Лабораторная работа №5 Тема: Полукоксование
- •Описание установки и методика проведения работы
- •Лабораторная работа №6 Аппараты установок термических и каталитических процессов. Тема: Методы разделения и анализа продуктов реакций
- •Методика проведения работы
- •Методика проведения работы
- •Лабораторная работа №7 Тема: Разгонка нефти на ректификационном аппарате
- •Лабораторная работа №8 Тема: Очистка сырой нефти от влаги и механических примесей
- •Определение сухого остатка
- •Методика определения
- •Прокаленный остаток
- •Методика определения
- •Лабораторная работа №9 Тема: Депарафинизация бензиновой фракции карбамидным методом
- •Методика определения
- •Лабораторная работа №10 Тема: Адсорбционная очистка масляных дистиллятов
- •Порядок выполнения работ
- •5. Самостоятельная работа студентов под руководством преподавателей (срсп) срсп №1. Реакционная способность органических соединений. Электронные эффекты
- •Срсп № 2. Классификация органических реакций
- •Срсп № 3. Характеристика основных механизмов реакций органических соединений
- •Срсп № 4. Образование пироуглерода и сажи
- •Срсп №5. Термические превращения углеводородов в жидкой фазе
- •Срсп №6. Процесс коксования нефтяного сырья
- •Срсп №7. Кислотный катализ
- •Реакции карбкатионов
- •Срсп №8. Классификация каталитических реакций и катализаторов
- •Энергия активации каталитической реакции
- •Срсп №9. Кинетика газофазных реакций в присутствии твердых катализаторов
- •Срсп №10. Теоретические основы подготовки и переработки газообразного сырья
- •6. Самостоятельная работа студентов срс
- •7 Экзаменационные вопросы
- •8 Технические средства обучения
- •Список рекомендуемой литературы
- •9.1 Основная литература
- •9.2 Дополнительная литература
Порядок выполнения работ
Перед проведением адсорбционной очистки проводят анализ сырья: определяют вязкость при температуре 50°С, температуру застывания, оптическую плотность.
Сырьем установки адсорбционной очистки масел является маловязкий масляный дистиллят. В качестве адсорбента используется синтетический алюмосиликат или крупнопористый силикагель А.С.К. Для улучшения контакта сырья с адсорбентом применяется разбавление сырья бензином, который применяют также в качестве десорбента. Процесс очистки проводят при температуре 30-40°С (в зависимости от вязкости сырья) в колонке диаметром 10 мм и высотой 600 мм.
Силикагель весом 30 г засыпают в колонку при непрерывном постукивании ее стенок для плотной упаковки зерен адсорбента по всей высоте колонки, после чего осуществляют смачивание адсорбента растворителем. На технических весах взвешивают 30 г дистиллята, разбавляют его 30 г бензина. Полученный раствор переносят в емкость, связанную с адсорбционной колонкой через дозировочный насос (рисунок 10.1), который со скоростью 125 мл/ч подает раствор вниз адсорбционной колонки.
Пройдя слой адсорбента, раствор очищенного дистиллята через перепускной кран поступает в предварительно взвешенную колбу для отгона растворителя. Полученный после отгона растворителя продукт (рафинат 1)
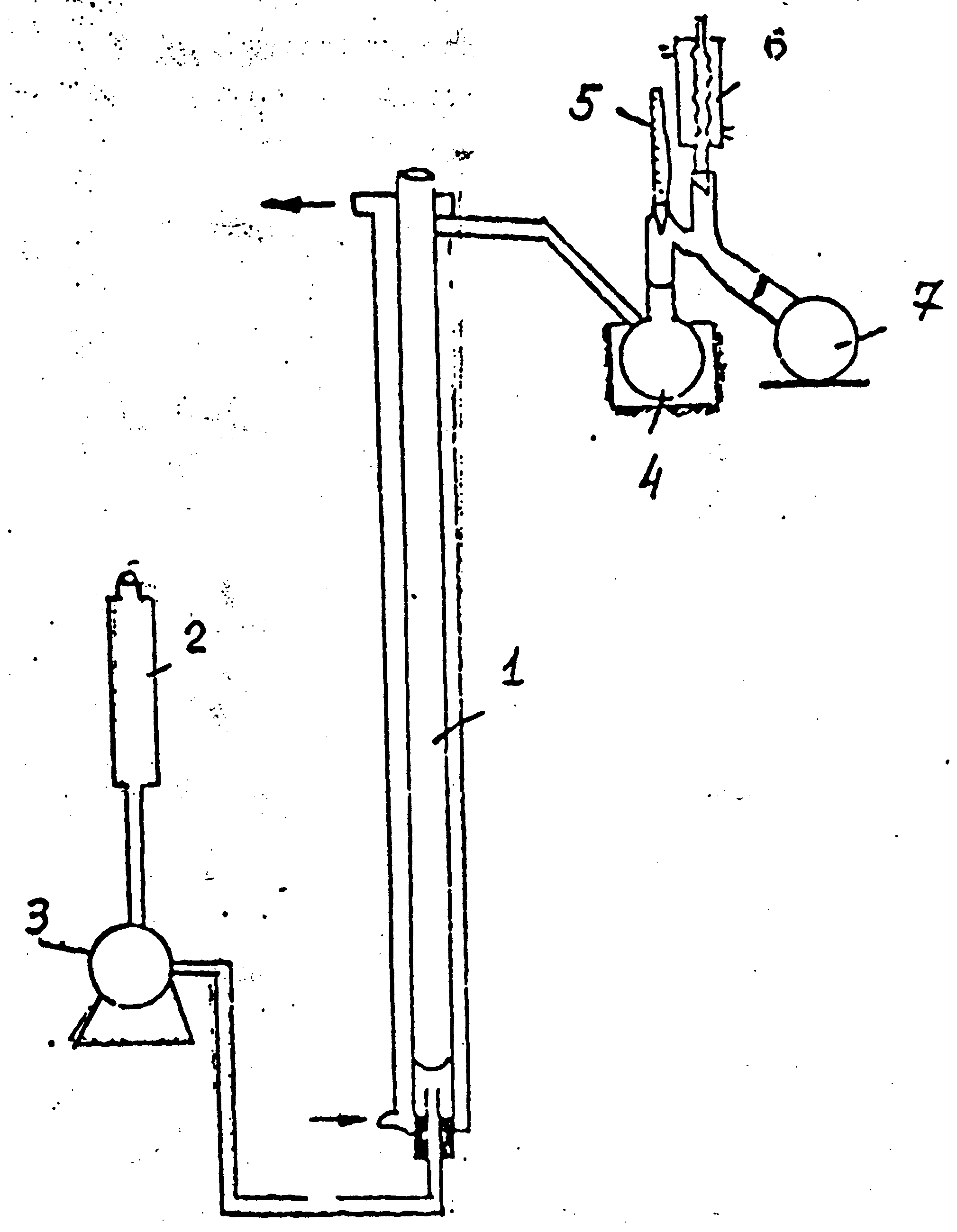
Рисунок 10.1 - Установка адсорбционной очистки
1 – колонка, 2 – мерник, 3 – насос, 4 - отгонная колба, 5 – термометр,
6 – холодильник, 7 – приемник.
взвешивают, выливают из колбы в стакан и анализируют, отогнанный растворитель, конденсируясь в холодильнике 6, собирается в приемнике.
После того как раствор сырья прошел через адсорбционную колонку, осуществляют стадию десорбции, для чего повышают температуру в колонке до 60-70°С и из емкости со скоростью 150-200 мл/ч начинает подачу 60 г бензина. Раствор десорбата собирается в колбе для отгона растворителя. Освобожденный от растворителя рафинат-2 по сравнению с рафинатом 1 обогащен ароматическими углеводородами. После определения массы рафинат 2 анализируют.
Контрольные вопросы
1. Теоретические основы процесса адсорбции и ее сущность.
2. Структура адсорбентов.
3. Виды промышленных адсорбентов.
4. Изменение качества масла в зависимости от глубины адсорбционной очистки.
Литература
1. Дияров И.Н., Батуева И.Ю., Садыков А.Н., Солодова Н. Л. Химия нефти, Руководство к лабораторным занятиям: учебное пособие для ВУЗов., Л., Химия, 1990.
2. Смидович Е. В., Лукашевич И.П. Практикум по технологии переработки нефти, М, Химия, 1978.
5. Самостоятельная работа студентов под руководством преподавателей (срсп) срсп №1. Реакционная способность органических соединений. Электронные эффекты
При изучении реакционной способности органических соединений в органической химии фундаментальным понятием является электроотрицательность элементов. Американский ученый Полинг определяет электроотрицательность как способность атома притягивать электроны. Эта способность влияет на поляризацию связей и таким образом определяет ход реакции; она обусловливает также природу и энергию связей между различными атомами.
Атомы, расположенные во втором периоде таблицы Менделеева справа от углерода, имеют тенденцию захватывать электроны, в то же время элементы, расположенные слева от углерода, склонны терять электроны. Углерод, занимающий центральное положение, может с одинаковым успехом отдавать и принимать электроны.
Таким образом, элементы второго периода в порядке уменьшения их электроотрицательности можно расположить в следующий ряд: F O N C B B e Li.
Тенденция захватывать электроны тем сильнее, чем меньше размеры атома. Отсюда возникает следующий ряд электроотрицательности: F Cl Br I.
Как правило, элементы с более низким потенциалом ионизации имеют также более низкое сродство к электрону.
Рассмотрим -связь между атомами С и С1: -связь образована двумя электронами (по одному от каждого атома). Атом С1 притягивает электрон сильнее, чем атом С, т.е. он более электроотрицателен. Вследствие этого -связь деформируется, плотность заряда вблизи атома хлора выше, чем у атома углерода. Связь становится электронно несимметричной, т.е. образуется диполь:
С+ :С1- или С+ С1-
Такие связи называются полярными связями.
Чем полярнее связь и больше различие электроотрицательности образующих ее партнеров, тем больше энергия связи и соответственно прочнее: С – F( 448 кДж/моль), С – О (335 кДж/моль), С – N (285 кДж/моль). Между противоположными по знаку частичными зарядами действует дополнительная сила притяжения.
Связь между атомами С и Н благодаря незначительному различию в их электроотрицательности малополярна, причем на атоме углерода сосредоточен небольшой отрицательный заряд (С-).
Из-за различной электроотрицательности связи С – Х (Х – различные заместители) могут быть в той или иной степени поляризованы.
R-CH2→Cl (-I) R-CH2Li (+I)
Заместитель, притягивающий пару электронов связи сильнее, чем атом водорода обладает –I эффектом (С1). Эффект, возникающий при смещении электронов -связи от углерода называют отрицательным индукционным эффектом (-I). Заместитель, отталкивающий пару электронов от себя обладает +I эффектом (Li). Положительным индукционным эффектом (+I) называют эффект, возникающий при смещении электронов -связи к углероду.
Если электроотрицательный заместитель связан с двойной или тройной связью, то –I-эффект в первую очередь влияет на -связи. Возникающая при этом поляризация молекулы называется мезомерным эффектом (М-эффект). Если заместитель сильно электроотрицателен, то за счет –М-эффекта на нем возникает отрицательный заряд:
 O
O-
O
O-
R
 –CH=CH–C
R–C+H–CH=C
–CH=CH–C
R–C+H–CH=C
H H
Здесь наблюдается ,-сопряжение.
Если же атом заместителя имеет свободную пару электронов, то за счет +М-эффекта он приобретает положительный заряд:
R –CH=CH–NR2 R –CH –CH=NR2
Причиной этому является сопряжение не поделенной пары электронов (р-электроны) азота с -связью. Такой эффект называется р,-сопряжение.
Под влиянием –М-эффекта водородные атомы, находящиеся у соседнего углеродного атома удерживаются менее прочно, чем в углеводородах и легче удаляются из молекулы в виде протонов. Такой эффект называется ,-сопряжение.
Связи Н–С–С=О сопряжены, и система этих связей действует как единое целое: разрыв связи С –Н ведет к разрыву -связи С=О и сосредоточению р-пары электронов у кислорода. И обратно, атака по кислороду, разрывающая -связь, часто ведет к отрыву протона:

 Н
О Н
О
Н
О Н
О
 R
– C – C
+ Y+
R – C
= C
R
– C – C
+ Y+
R – C
= C
- H+
H
– М-эффект заместителей тем сильнее, чем меньше их внутренняя мезомерия:
О О О О
– С – С – С – С
О NH2 CH3 Cl
+М-эффект заместителя тем сильнее, чем меньше электроотрицательность соответствующего гетероэлемента:
NR2 OR F
С химической точки зрения электроноакцепторные –М- и –I-эффекты облегчают уход частиц без пары электронов связи. Эти эффекты способствуют атаке центров, бедных электронами. Классическим примером может служить атака с участием оксаниона. Она может быть направлена на атом углерода, связанный с электроноакцепторной группой (-I) и приводит к замещению этой группы:
 R
– O -
+ C → X
R
– O – C
– + X –
R
– O -
+ C → X
R
– O – C
– + X –
Атака может быть также направлена на двойную связь, способную к поляризации, и может приводить к возникновению новой, отрицательно заряженной частицы:
R – O - + C = О R – O – C – О –
Наоборот, электронодонорные +М- и +I-эффекты облегчают уход частиц с захватом электронной пары связи:
С – N N: С+ + :N N:
а также способствуют атаке богатых электронами центров:
С = С + Н+ +С – С – Н
Некоторые группы, обладающие двумя эффектами противоположной природы (галогены +М- и –I-эффекты) могут оказывать более сложное влияние.
Установить абсолютную шкалу величин электронных эффектов не представляется возможным, поскольку эти величины зависят одновременно от ряда структурных факторов, условий реакций и даже от применяемых методов их определения.
Таблица 1 – Электронные эффекты важнейших функциональных групп
Группа |
– M |
– I |
+ I |
+ M |
|
+ + + + + + +
+ + + + +
+
+
|
+ + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + +
+ +
|
+ + +
+ + + + + + |
+ + + + + +
+ + + + + +
+ + + + |
Контрольные вопросы
Какие связи называются полярными?
Дайте определение «мезомерного эффекта».
Какой эффект называется положительным индукционным эффектом?
Литература
Днепровская Т.М. Теоретические основы органической химии. М., 2000.
Матье Ж., Панико Р. Курс теоретических основ органической химии. М., 1975.
