
- •Содержание
- •Глоссарий 7
- •Конспект лекционных занятий
- •3. Практические занятия
- •4. Лабораторные занятия
- •5. Самостоятельная работа студентов
- •7 Экзаменационные вопросы 181
- •8 Технические средства обучения 182
- •Список рекомендуемой литературы 182
- •1. Глоссарий
- •2 Конспект лекционных занятий модуль 1 Лекция № 1. Перспективы развития технологии органических веществ (2 часа)
- •0,5 О2 носн2-сн2он
- •О носн2-сн2nh2
- •Лекция № 2. Физико-химические основы термического крекинга
- •Лекция № 3. Физико-химические основы каталитического крекинга
- •Лекция № 4. Физико-химические основы каталитического риформинга
- •Лекция № 5. Физико-химические основы гидрогенизационных процессов
- •Лекция № 7. Химизм и механизм технологических процессов переработки нефтяных газов
- •Лекция № 8 Технологическое оборудование и технологическое оформление основных аппаратов процессов переработки органических веществ
- •Лекция № 10 Теоретические основы очистки нефтяных фракций
- •Лекция № 11 Адсорбционные и каталитические методы очистки
- •Лекция № 12 Очистка с применением избирательных растворителей
- •Лекция № 13 Депарафинизация масел и дизельных фракций
- •3. Практические занятия
- •Практическое занятие №1
- •Тема: Расчетные методы определения физико-химических свойств
- •И состава нефти и нефтепродуктов
- •Задачи для решения
- •Практическое занятие №2 Тема: Расчетные методы вычисления материального баланса процесса термического крекинга
- •Составление материального баланса
- •Задачи для решения
- •Практическое занятие №3 Тема: Составление материального баланса процесса каталитического крекинга
- •Задачи для решения
- •Практическое занятие №4 Тема: Составление материального баланса процесса каталитического риформинга
- •Задачи для решения
- •Практическое занятие №5 Тема: Расчетные методы вычисления материального баланса гидрогенизационных процессов
- •Задачи для решения
- •Практическое занятие №6 Тема: Расчетные методы вычисления материального баланса процесса полимеризационных процессов
- •Задачи для решения
- •Практическое занятие №7 Тема: Задачи и упражнения по составлению уравнений химических реакций, протекающих при алкилировании и изомеризации с указанием механизма ее протекания
- •Задачи для решения
- •Практическое занятие №8 Тема: Технологический расчет основных аппаратов установок переработки органических веществ
- •Число тарелок
- •Практическое занятие №9 Тема: Приближенные методы построения линии однократного испарения (ои)
- •Задачи для решения
- •Практическое занятие №10 Тема: Решение задач по теоретическим основам процесса очистки нефтяных фракций
- •Задачи для решения
- •Практическое занятие №11 Тема: Решение задач по депарафинизации нефтяных фракций
- •Задачи для решения
- •Практическое занятие №12 Тема: Решение задач по закономерностям получения гомогенных растворов
- •Задачи для решения
- •4. Лабораторные занятия лабораторная работа №1 Тема: Термический крекинг (пиролиз) углеводородов и составление материального баланса опыта
- •Описание установки и методика проведения работы
- •Лабораторная работа №2 Тема: Каталитический крекинг углеводородов и составление материального баланса опыта
- •Проведение работы
- •Оформление результатов работы
- •Методика проведения эксперимента
- •Приготовление алюмохромового оксидного катализатора
- •Методика выполнения работы
- •Лабораторная работа №5 Тема: Полукоксование
- •Описание установки и методика проведения работы
- •Лабораторная работа №6 Аппараты установок термических и каталитических процессов. Тема: Методы разделения и анализа продуктов реакций
- •Методика проведения работы
- •Методика проведения работы
- •Лабораторная работа №7 Тема: Разгонка нефти на ректификационном аппарате
- •Лабораторная работа №8 Тема: Очистка сырой нефти от влаги и механических примесей
- •Определение сухого остатка
- •Методика определения
- •Прокаленный остаток
- •Методика определения
- •Лабораторная работа №9 Тема: Депарафинизация бензиновой фракции карбамидным методом
- •Методика определения
- •Лабораторная работа №10 Тема: Адсорбционная очистка масляных дистиллятов
- •Порядок выполнения работ
- •5. Самостоятельная работа студентов под руководством преподавателей (срсп) срсп №1. Реакционная способность органических соединений. Электронные эффекты
- •Срсп № 2. Классификация органических реакций
- •Срсп № 3. Характеристика основных механизмов реакций органических соединений
- •Срсп № 4. Образование пироуглерода и сажи
- •Срсп №5. Термические превращения углеводородов в жидкой фазе
- •Срсп №6. Процесс коксования нефтяного сырья
- •Срсп №7. Кислотный катализ
- •Реакции карбкатионов
- •Срсп №8. Классификация каталитических реакций и катализаторов
- •Энергия активации каталитической реакции
- •Срсп №9. Кинетика газофазных реакций в присутствии твердых катализаторов
- •Срсп №10. Теоретические основы подготовки и переработки газообразного сырья
- •6. Самостоятельная работа студентов срс
- •7 Экзаменационные вопросы
- •8 Технические средства обучения
- •Список рекомендуемой литературы
- •9.1 Основная литература
- •9.2 Дополнительная литература
Практическое занятие №12 Тема: Решение задач по закономерностям получения гомогенных растворов
Примеры решения
Задача №1
Даны реакции:
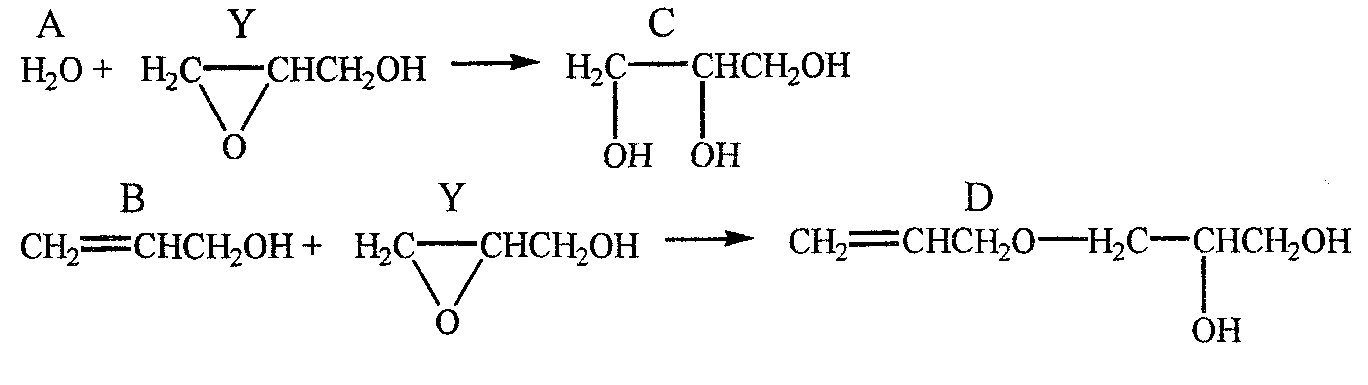
и соответствующие им кинетические уравнения:
![]()
![]()
Реактор периодический. Начальные условия: [А]0=28 моль/л, [В]0=5 моль/л, [Y]0=3 моль/л.
Необходимо вычислить выход глицерина при полной конверсии глицидола и соотношение констант скоростей реакции k2/k1=0,5.
Решение. Запишем уравнения реакции в буквенном виде:
А+Y![]() С
С
В+Y![]() D
D
Исключим время из кинетических уравнений, поделив одно уравнение на другое, и затем проинтегрируем:
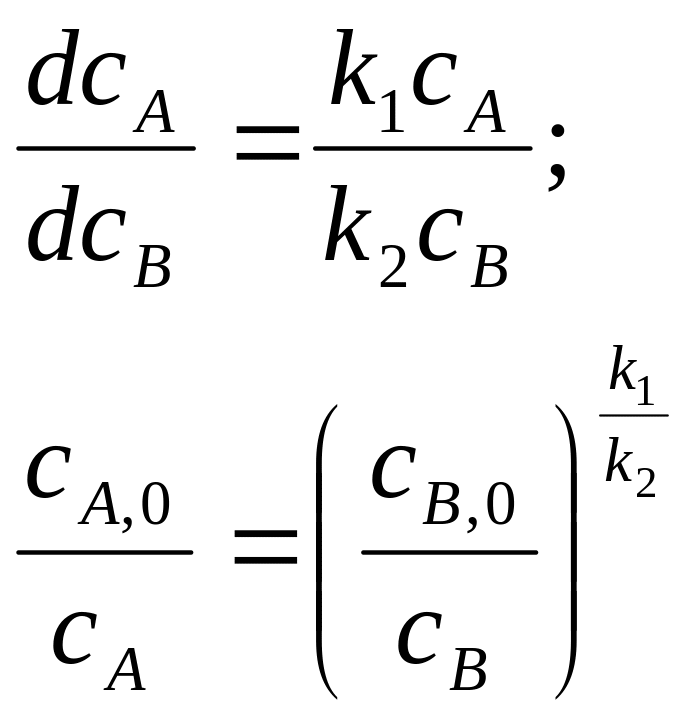 (12.1)
(12.1)
Дополним полученной соотношение уравнениями материального баланса, учитывая , что глицидол (Y) эквивалентно расходуется на образование глицерина (С) и его аллилового эфира (D), вода (А) расходуется только на образование глицерина (С), аллиловый спирт (В) – только на образование аллилового эфира (D) и что конверсия глицидола полная:
сY=сY,0-сС-сD=0 (12.2)
сА=сА,0-сС (12.3)
сВ=сВ,0-сD (12.4)
Решив систему уравнений (1-4) относительно сА получим:
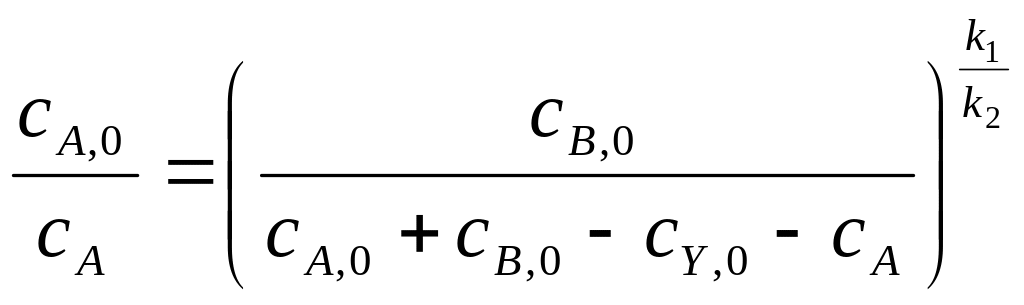
Подставив заданные значения начальных концентраций, получим:
![]()
Откуда находим значение концентраций воды в конце реакции:
СА=25,766
Конечные концентрации остальных веществ находим из уравнений материального баланса (2-4):
сС=28-25,766=2,234 моль/л;
сD=3-2,237=0,766 моль/л;
сВ=5-0,766=4,234 моль/л.
Выход глицерина (С) по глицидолу (Y) составляет:
![]()
Задача №2
В периодическом реакторе в избытке NaОН идут реакции:
(СН3)3ССl +NaОН →(СН3)3СОН+NaСl (1)
(СН3)3ССl +NaОН →(СН3)2С=СН2+ NaСl+Н2О (2)
до полной конверсии трет-бутилхлорида.
Вычислить разницу энергии активации двух реакций, если выход спирта при 30 °С составил 90%, а при 50 °С – 70%.
Решение. Обозначив через А, Y, В, С, Z и U третбутилхлорид, едкий натр, третбутиловый спирт, изобутилен, хлористый натрий и воду соответственно, запишем уравнения химических реакций и материального баланса:
А+Y В+Z;
А+ Y С+ Z+ U;
сА=сА,0-сВ-сС;
сY=сY,0-сВ-сС=0.
Выход третбутанола (В) по третбутилхлориду (А) равен:
![]()
С другой стороны, исходя из кинетических уравнений:
![]()
Можно записать
![]() .
.
После интегрирования последнего уравнения получим (учитывая, что в конце реакции сА=0):
сВ/сА,0=k1+(k1+k2).
Таким образом:
![]()
Из последнего уравнения находим отношения констант:
при
30 °С,
![]() =0,9, k2/
k1=0,111;
=0,9, k2/
k1=0,111;
при 50 °С, =0,7, k2/ k1=0,4286.
Согласно уравнению Аррениуса:
k2/ k1= k2,0/ k1,0ехр(-(Е2-Е1)RT),
откуда вычисляем: Е2-Е1=54716 Дж/моль.
