
- •Новгородский агротехнический техникум
- •Материаловедение
- •110809 «Механизация сельского хозяйства»
- •190631 «Техническое обслуживание и ремонт
- •Введение
- •1 Производство черных и цветных металлов
- •Производство чугуна
- •Доменной печи
- •1.1.4 Продукты доменного производства.
- •1.2 Производство стали
- •1.2.4 Производство стали в электропечах.
- •1.3 Производство цветных металлов
- •1.3.3 Производство титана.
- •2 Физико-химические основы материаловедения
- •2.1 Строение и свойства материалов
- •2.1.3 Строение кристаллов и аллотропические превращения в металлах.
- •Процессе для чистого железа
- •2.2 Методы определения различных показателей и свойств материалов
- •2.3 Основы теории сплавов
- •2.4 Термическая обработка металлов и сплавов
- •2.4.2 Превращения в металлах при нагревании и охлаждении.
- •2.4.3 Отжиг.
- •2.4.4 Нормализация.
- •2.4.5 Закалка и отпуск стали.
- •2.5 Химико-термическая обработка металлов и сплавов
- •2.5.2 Поверхностная закалка.
- •2.5.3 Химико-термическая обработка стали.
- •2.5.4 Упрочнение поверхностным деформированием.
- •3 Материалы, применяемые в машиностроении
- •3.1 Углеродистые стали
- •3.1.1 Общие сведения.
- •3.1.2 Влияние содержания углерода и постоянных примесей на свойства углеродистых сталей.
- •3.1.3 Углеродистая конструкционная сталь.
- •3.2 Чугуны
- •И форме графитовых включений
- •3.2.3 Белый чугун.
- •3.2.4 Серый чугун.
- •3.2.5 Ковкий чугун.
- •3.2.6 Высокопрочный чугун.
- •3.2.7 Антифрикционные чугуны.
- •3.3 Легированные стали
- •3.3.2 Конструкционные легированные стали.
- •3.3.3 Инструментальные легированные стали.
- •3.3.4 Стали и сплавы с особыми свойствами.
- •3.4 Цветные металлы и сплавы
- •3.4.1 Медь
- •3.4.2 Сплавы на медной основе
- •3.4.5 Титан и его сплавы
- •3.4.6 Магний и его сплавы
- •3.5 Порошковые материалы
- •3.5.1 Материалы порошковой металлургии
- •3.5.2 Пористые порошковые материалы
- •3.5.3 Прочие пористые изделия
- •3.5.4 Конструкционные порошковые материалы
- •3.5.5 Спеченные цветные металлы
- •Металлокерамических твердых сплавов
- •3.6 Композиционные материалы
- •3.6.1 Общие сведения.
- •3.7 Неметаллические материалы
- •3.7.1 Общие сведения о классификации неметаллических материалов
- •3.7.2 Пластические массы
- •3.8 Прочие материалы
- •3.9 Защитные материалы
- •3.9.3 Методы нанесения защитных покрытий.
- •3.9.5 Классификация и свойства лакокрасочных материалов.
- •3.9.7 Классификация и свойства клеевых материалов.
- •3.10 Коррозия металлов и способы её предотвращения
- •Литература
1.3 Производство цветных металлов
1.3.1 Производство меди. К цветным металлам, получившим наибольшее распространение в машиностроении можно отнести медь, алюминий, титан и магний.
Медь является ценнейшим материалом во многих отраслях промышлености. Её высокая электропроводность (электросопротивление меди составляет 1,7*10-6 Ом*см, тогда как железа 9,8*10-6 Ом*см) обуславливает широкое применение меди в электротехнике. Медь является основой таких сплавов, как латунь и бронза.
Медь отличается:
высокой пластичностью;
высокой электропроводностью;
высокой теплопроводностью;
малой окисляемостью.
По химическим свойствам медь близка к серебру и золоту, которые не окисляются на воздухе, поэтому относятся к благородным металлам. Медь окисляется слабо, поэтому ее называют полублагородным металлом.
Температура плавления меди 1083°С, плотность при температуре 20°С – 8900кг/м3. В земной коре меди содержится всего 0,01%, в то же время она не является рассеянным металлом и концентрируется в медных рудах (до 5%).
Медные руды бывают двух видов: сульфидные (80 % всех мировых запасов) и окисленные. Содержание меди в промышленных рудах составляет в среднем от 1 до 3%. Сначала руду подвергают обогащению, т. е. отделяют пустые породы: кварц, борит, алюмосиликаты, кальцит. Обогащение выполняют методом флотации: к дробленой руде добавляют маслянистые вещества, которые покрывают крупинки сульфида меди пленкой, в результате они всплывают на поверхность воды во флотационной машине, а пустая порода осаждается на дно.
Из полученного сульфидно-медного концентрата выплавляют медь, используя пирометаллургический способ, при котором расплавляется вся масса материала. Медь концентрируется в сульфидном расплаве (штейне), а окислы образуют шлак. Штейн отделяют от шлака путем отстаивания.
На современных заводах плавку выполняют в отражательных или электрических печах. В отражательных печах рабочее пространство вытянуто в горизонтальном направлении; площадь подачи 300м2 и более. Необходимую для плавления теплоту получают сжиганием углеродистого топлива (газа, мазута, угольной пыли) в газовом пространстве над поверхностью ванны. В электрических печах через расплавленный шлак пропускают электрический ток (напряжение подводится через погруженные в шлак графитовые электроды).
Однако и отражательная, и электрическая плавки, основанные на использовании внешних источников теплоты, несовершенны. Сульфиды, составляющие основную массу медных концентратов, обладают высокой теплотворной способностью. Поэтому все чаще применяют такие методы плавки, в которых используется теплота сжигания сульфидов (окислитель – подогретый воздух, воздух, обогащенный кислородом, технический кислород). Мелкие, предварительно высушенные сульфидные концентраты вдувают струей кислорода или воздуха в раскаленную до высокой температуры печь. Частицы горят во взвешенном состоянии (кислородно-взвешенная плавка). Богатые кусковые сульфидные руды (2–3% Cu) с высоким содержанием серы (35–42% S) используются при плавке в шахтных печах (печи с вертикальным расположением рабочего пространства). При одном из видов шахтной плавки (медно-серная плавка) в шихту добавляют мелкий кокс, восстановляющий в верхних слоях печи SO2 до элементарной серы. При этом медь также концентрируется в штейне. Жидкий штейн (в основном Cu2S и FeS) заливают в конвертер, который представляет собой цилиндрический резервуар из листовой стали, выложенный изнутри магнезитовым кирпичом. Конвертер имеет боковой ряд фурм для вдувания воздуха и устройство для поворота вокруг оси. Через слой штейна продувают сжатый воздух. Конвертирование штейнов имеет две стадии. Сначала окисляется сульфид железа, и для связывания окислов железа в конвертер добавляют кварц; образуется конвертерный шлак. Затем окисляется сульфид меди с образованием металлической меди (черновой) и SO2. Черновую медь разливают в формы. Слитки (а иногда расплавленную черновую медь) с целью извлечения ценных металлов (Аu, Ag, Sе, Fе, Вi и др.) и удаления вредных примесей направляют на огневое рафинирование.
Огневое рафинирование производят в отражательных печах для удаления железа, серы и прочих примесей. Для этого черновую медь расплавляют, окисляют имеющиеся примеси, удаляют растворенные газы и раскисляют медь.
Другой способ рафинирования меди – электролитический.
Для этого слитки черновой меди подвешивают в ванне с раствором медного купороса, подкисленным серной кислотой, они служат анодом. При пропускании тока аноды растворяются, а чистая медь откладывается на катодах – тонких медных листах, которые получают методом электролиза в специальных матричных ваннах. Полученную медь промывают водой и переплавляют. Благородные металлы, селен, теллур и другие спутники меди концентрируются в анодном шламе. Оттуда их извлекают специальной переработкой.
Широко используются и гидрометаллургические способы получения меди, как правило, из бедных окисленных и самородных руд. Они основаны на избирательном растворении медьсодержащих минералов в слабых растворах Н2SO4 или аммиака. Из раствора медь осаждают химическим способом либо выделяют электролизом с нерастворимыми анодами.
1.3.2 Производство алюминия. Объем производства алюминия занимает второе место после железа. Алюминий имеет сравнительно невысокую стоимость среди прочих легких металлов. Плотность алюминия 2700кг/м3, температура плавления 660°С (для сравнения: плотность железа 7860кг/м3, температура плавления 1535°С). Алюминий высокопластичен, но отличается низкой прочностью. Он коррозионностоек, так как при контакте с кислородом на нем образуется защитная окисная пленка. Чем меньше различных примесей в алюминии, тем он более устойчив к коррозии.
Электропроводность алюминия (электросопротивление 2,7*10-6 Ом*см) на 35% меньше электропроводности меди.
Алюминий широко применяется как:
проводник для электротехнических целей;
коррозионностойкий материал;
пластичный материал, позволяющий получить глубокую штамповку и тонкий прокат.
Алюминий получают из алюминиевых руд: бокситов, нефелинов, алунитов и каолинов. Основной рудой, на которой базируется большая часть мировой алюминиевой промышленности, являются бокситы.
При получении алюминия из руд сначала производят глинозем (Аl2О3), а затем, подвергая его электролизу, получают алюминий.
Глинозем можно получить щелочным или кислотным способом. В настоящее время используют только щелочной способ. Кислотные и кислотно-щелочные способы находятся на стадии разработки. Один из методов получения алюминия щелочным способом заключается в следующем. Обезвоженный боксит измельчают в шаровых мельницах, смешивают с мелом и содой и спекают для получения растворимого в воде твердого алюмината натрия. Спекшуюся массу измельчают и выщелачивают водой, алюминат натрия при этом переходит в раствор.
При другом методе глинозем, содержащийся в боксите, связывают в алюминат натрия путем обработки руды щелочами. При этом сразу получается водный раствор алюмината.
И в том и в другом случаях образование водного раствора алюмината натрия приводит к выделению его из нерастворимых компонентов руды, являющихся в основном оксидами и гидроксидами кремния, железа и титана. Отделение раствора от нерастворимого осадка, который называют красным шламом, осуществляют в отстойниках. В полученный раствор при температуре 125°С под давлением 500кПа добавляют известь. Это приводит к обескремниванию. Соединения кальция и кремния выпадают в осадок, образуя белый шлам. Очищенный от кремния раствор после отделения его от белого шлама обрабатывают углекислым газом при температуре 60 – 80°С, в результате
чего в осадок выпадает кристаллический гидрат окиси алюминия:
А12O3 Na2O + ЗН2O + СO2 = 2А1(ОН)3 +Na2СO3,
который промывают, просушивают и прокаливают. При прокаливании образуется глинозем:
2А1(OН)3 = А12O3 + ЗН2O
Данный метод обеспечивает достаточно полное извлечение глинозема из боксита – около 80%.
Получение металлического алюминия из глинозема заключается в его электролитическом разложении на составные части: алюминий и кислород. Электролитом при этом является раствор глинозема в криолите (Na2АlF6), который, обладая способностью растворять глинозем, одновременно снижает его температуру плавления. Глинозем плавится при температуре около 2000°С, а температура плавления раствора, состоящего, например, из 85% криолита и 15% глинозема, 935°С.
Схема электролиза глинозема достаточно проста, но это технологически сложный процесс, требующий больших затрат электроэнергии. На рисунке 1.11 представлен чертеж электролизной ванны. В подине 6 ванны, стены которой выполнены из углеродистых блоков, заложены катодные шины 7. Для теплоизоляции корпус ванны выложен шамотным кирпичом 4. К анодной шине 1 присоединены электродные штыри 2.
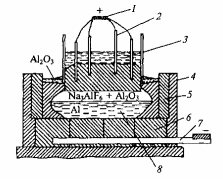
1 – анодная шина; 2 – электродный штырь; 3 – жидкая анодная масса;4 – шамотный кирпич; 5 – стена; 6 – подина; 7 – катодная шина; 8 – жидкий алюминий
Рисунок 1.11 Электролизная ванна
Перед началом электролиза на дно ванны насыпают тонкий слой кокса, электроды опускают до соприкосновения с ним и подают напряжение. Когда угольная набивка накалится, постепенно вводят криолит.
При толщине слоя расплавленного криолита 200 – 300мм загружают глинозем (15% от количества криолита). Процесс протекает при температуре 950 – 1000°С.
Под действием электрического тока глинозем разлагается на алюминий и кислород. Жидкий алюминий 8 скапливается на угольной подине (дно угольной ванны), являющейся катодом, а кислород соединяется с углеродом анодов, постепенно сжигая их. Криолит расходуется незначительно. Глинозем периодически добавляют. Электроды по мере их сгорания постепенно опускают вниз, а накопившийся жидкий алюминий выпускают.
Для получения 1т алюминия электролизом расходуется около 2т глинозема, 0,6т угольных электродов, 0,1т криолита и от 17000 до 18000кВт*ч электроэнергии.
Полученный при электролизе глинозема алюминий-сырец содержит металлические примеси (железо, кремний, титан и натрий), растворенные газы, главным из которых является водород, неметаллические включения, представляющие собой частицы глинозема, угля и криолита. В таком состоянии он непригоден для использования, так как имеет низкие технические свойства, поэтому его подвергают рафинированию. Неметаллические и газообразные примеси удаляют путем переплавки и продувки металла хлором. Металлические примеси можно удалить только сложными электролитическими способами.
Рафинированием получают товарные сорта алюминия. Чистота алюминия является основным показателем, влияющим на все его свойства. Поэтому химический состав положен в основу классификации алюминия. Неизбежными вредными примесями, имеющими место при производстве алюминия, являются железо и кремний. Железо не растворяется в алюминии, образует с ним хрупкие химические соединения.
В России выпускается тринадцать марок алюминия.
