
- •Формулы для химических расчётов.
- •Общие формулы соединений
- •Примеры решения задач
- •Решение:
- •Решение
- •Решение
- •Решение
- •Прорешайте и проанализируйте задачи и цепочки:
- •Цепочки превращений
- •1. Степень окисления
- •1. Определение
- •2. Правила нахождения степени окисления.
- •1. Алгебраический
- •2. Графический
- •Амфотерные оксиды
- •Амфотерные гидроксиды
- •Оксиды, кислоты, основания, соли
- •Правила составления ионных уравнений
- •Этапы составления ионных уравнений
- •Разложение нитратов
- •Свойства азотной кислоты
- •1. Диссоциация:
- •2. Взаимодействие с металлами:
- •3. Концентрированная азотная кислота взаимодействует с неметаллами, восстанавливаясь до no или no2:
- •4. Взаимодействие с оксидами металлов:
- •9. Взаимодействие с бинарными соединениями: металл-неметалл, неметалл-неметалл: (сульфиды, карбиды, йодиды, фосфиды, нитриды, …)
- •Свойства щелочей
- •9. Электролиз расплава:
- •10. Взаимодействие с бинарными соединениями:
- •11. Щелочи участвуют в овр, создают щелочную среду и образуют соли:
- •12. Взаимодействие с органическими веществами:
- •Получение и свойства гидроксида хрома (III)
- •Свойства серной кислоты
- •1. Диссоциация (2 ступени):
- •2. Взаимодействие с металлами:
- •3. Концентрированная серная кислота при нагревании взаимодействует с неметаллами:
- •4. Взаимодействие с оксидами металлов:
- •5. Взаимодействие с основными и амфотерными гидроксидами:
- •6. Разложение при нагревании:
- •7. Взаимодействие с солями:
- •Свойства соляной кислоты
- •1. Диссоциация:
- •2. Взаимодействие с металлами:
- •3. Взаимодействие с оксидами металлов:
- •4. Взаимодействие с основными и амфотерными гидроксидами:
- •5. Взаимодействие с аммиаком:
- •6. Взаимодействие с солями:
- •7. Окислительные свойства смеси концентрированных соляной и азотной кислот:
- •Химические свойства воды
- •Химические свойства кислорода.
- •2.Взаимодействие с металлами.
- •3.Взаимодействие с неметаллами
- •11.Взаимодействие с карбонилами металлов.
- •12.Взаимодействие с солями.
- •13.Участие кислорода в овр.
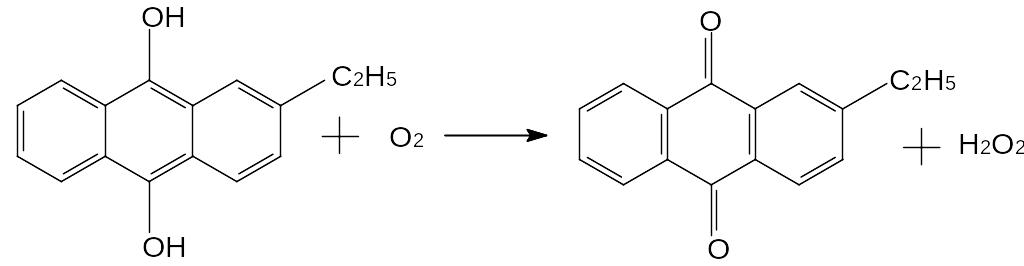
- •14. Взаимодействие с органическими веществами.
- •Литература:
- •Литературу по химии можно заказать в интернет-магазине ozon.Ru
11.Взаимодействие с карбонилами металлов.
[Fe(CO)5] + O2 → Fe2O3 + CO2 [Mn2(CO)10] + O2 → MnO2 + CO2
[Co2(CO)8] + O2 → CoO + CO2 [Cr(CO)6] + O2 → Cr2O3 + CO2
[Ni(CO)4] + O2 → NiO + CO2
12.Взаимодействие с солями.
Na2SO3 + O2 → Na2SO4
NaNO2 + O2 → NaNO3
Na2SeO3 + O2 → Na2SeO4
Na2S2O5 + O2 Na2SO4 + SO2
NH4HSO3 + O2 (NH4)2SO4 + SO2 + H2O
NaHSO3 + O2 Na2SO4 + SO2 + H2O
MnCl2 + O2 → Mn2O3 + Cl2 (t)
FeCl2 + O2 → Fe2O3 + Cl2 (t)
HCOOK + O2 → K2CO3 + CO2 + H2O
Na[BH4] + O2 → NaBO2 + H2O
FeCO3 + O2 → Fe2O3 + CO2 (t)
SnCl2 + O2 + H2O → SnCl4 + SnCl(OH)
PbCO3 + O2 → Pb3O4 + CO2 (аналогично FeCO3)
PtF6 + O2 (O2)+[PtF6] (As, Sb, Bi, Ru, Au)
13.Участие кислорода в овр.
FeCl2 + O2 + H2O → FeO(OH) + HCl
FeO + O2 + HCl FeCl3 + H2O FeCl2 + O2 + HCl FeCl3 +H2O
FeCl2 + O2 + H2O + NaOH Fe(OH)3 + NaCl
Fe + O2 + HCl FeCl3 + H2O
Fe + O2 + H2O Fe(OH)2 (Коррозия железа)
Fe(OH)2 + O2 + H2O Fe(OH)3 (Коррозия железа)
(FeFe2)O4 + O2 + H2SO4 → Fe2(SO4)3 + H2O
Cu + O2 + H2O + CO2 (CuOH)2CO3
Cu + O2 + H2SO4 → CuSO4 + H2O
Zn + O2 + H2O + CO2 (ZnOH)2CO3
Pb + O2 + H2O + CO2 (PbOH)2CO3
Bi + H2O + O2 + CO2 Bi2CO3(OH)4 ((Bi(OH)2)2CO3)
Fe + H2O +O2 + CO2 Fe(HCO3)2
Cu + O2 + HCl CuCl2 + H2O
Cu + O2 + NH3(р-р) + H2O [Cu(NH3)2]OH
Cu + O2 + NH3(p-p) + H2O [Cu(NH3)4](OH)2
Cu + NaCN + H2O + O2 Na2[Cu(CN)4] + NaOH
Cr2O3 + O2 + KOH → K2CrO4 + H2O
MnO2 + NaOH + O2 Na3MnO4 + H2O
NO2 + O2 + H2O HNO3 NO2 + O2 + NaOH NaNO3 + H2O
SO2 + O2 + H2O H2SO4 Cr2O3 + O2 + K2CO3 K2CrO4 + CO2
NaI + HCl + O2 I2 + NaCl + H2O
N2H4. H2O + O2 → N2 + H2O2 + H2O
Na2S2O4 + H2O + O2 NaHSO3
14. Взаимодействие с органическими веществами.
14.1.Полное окисление.
CH4 + O2 CO2 + H2O C2H2 + O2 CO2 + H2O
CH3COOH + O2 CO2 + H2O CH3NH2 + O2 CO2 + H2O + N2
14.2. Неполное окисление.
СН3-CH2-CH2-CH3 + O2 → CH3COOH + H2O (t, kat)
CH3CH(OH)CH3 + O2 → CH3COCH3 + H2O (140ºC)
CH2=CH2 + O2 → (CH2)2O (Ag)
C
 H3-CH2=CH2
+ O2
→
CH3-CH-CH2
(Ag)
H3-CH2=CH2
+ O2
→
CH3-CH-CH2
(Ag)
O
CH2=CH2 + O2 → CH3CHO (PdCl2, CuCl2)
CH3-CH2=CH2 + O2 → CH3-CO-CH3 (PdCl2, CuCl2)
C6H5 - CH(CH3)2 + O2→C6H5OH + CH3COCH3 (H2SO4)
![]()
С6Н6
+ О2
![]() + СО2
+ Н2О
+ СО2
+ Н2О
СН3СНО + О2 → СН3СООН (Mn2+)
Получение кислорода.
1. Промышленный способ получения кислорода заключается в сжижении воздуха при низких температурах и его дальнейшей фракционной перегонке. Вначале из жидкого воздуха отгоняется газообразный азот (так как его температура кипения ниже, чем у кислорода), а в жидком состоянии остается почти чистый кислород.
2. Лабораторные методы
2.1. KClO3 = KCl + O2↑ (MnO2, tº)
2.2. KMnO4 = K2MnO4 + MnO2 + O2↑ (tº)
2.3. NaNO3 = NaNO2 + O2↑ (tº)
2.4. H2O2 = H2O + O2↑ (MnO2)
2.5. Na2O2 + CO2 = Na2CO3 + O2↑
2.6. H2O = H2↑ + O2↑ (электролиз)
3. В природе в процессе фотосинтеза в зеленых частях живых растений образуется кислород: 6CO2 + 6H2O = C6H12O6 + 6O2↑
Химические свойства озона.
1. О3 ↔ О2 + О0 (УФ-облучение),
О3 + О0 О2 (кат. NO, Cl2, Pt, CuO, CClF3 при УФ-облучении).
2. О3 О2 (250° С, кат. МnО2),
O3(p)
![]() O2(p)
(комн.)
O2(p)
(комн.)
3. Оз + Н2O2 О2 + Н2O.
4. О3 + Н0 НО2 + О2 (-196° С; примеси Н2О2, Н2О3, Н2О4).
5. O3 + Fe Fe2O3
О3 + Ag (AgIAgIII)O2 + O2 (комн.).
6. О3 + М2О2 МО3 + МО2 (М = К, Rb, Cs; в жидк. CC12F2),
О3 + МО2 МО3 + О2 (комн.).
(FeFe2)O4 + O3 Fe2O3
7. О3 + МОH МО3 + ОН0 (М = К, Rb, Cs; в жидк. NH3),
О3 + МОН МО3 + О2 + 2Н2О (комн.).
8. О3 + NH3 (ж) + Li [Li(NH3)4]O3 (-40° С).
9. О3 + NO NO2 + O2 (разрушение озонового слоя атмосферы Земли).
10. О3 + Н2О + KI I2 + O2 + KOH,
О3 + KI КIO3 + О2 (в гор. конц. КОН).
11. О3 + H2S(г) SO2 + Н2О,
O3 + H2S(p) H2SO4.
12. О3 + PbS PbSO4 (комн.).
13. О3 + Mn(NO3)2 + H2O MnO2- + O2 + HNO3.
14. O3 + KI + H2SO4 O2 + I2 + K2SO4 + H2O
Городская химическая олимпиада учащихся 8 классов 2010
1. Имеется 19,6 г молекулярного азота. Вычислите:
а) количество вещества азота б) объем азота (н. у.)
в) число молекул азота в данной массе г) массу одной молекулы азота
д) плотность азота (н. у.)
е) относительную плотность азота по водороду и воздуху (5 баллов)
2. В 1 кг газообразного вещества содержится 3,3444 ∙ 1025 молекул (1,00332 ∙ 1026 атомов). Определите молекулярную массу вещества, назовите вещество. (5 баллов)
3. Газ массой 1,6 г занимает объем 1,12 л (н. у.). Определите молярную массу газа, назовите газ. (2 балла)
4. Массовая доля серы в соединении Fe2(SO4)3.nH2O равна 15,584%. Определите формулу кристаллогидрата. (3 балла)
5. Установите формулу гидроксида, имеющего состав: 50,485% хрома, 46,602% кислорода и 2,913% водорода. Назовите гидроксид, напишите уравнения реакций (молекулярные, ионные), характеризующие химические свойства данного гидроксида. (8 баллов)
6. Какой объем 20%-го раствора (плотность 1,14 г/мл) серной кислоты необходим для нейтрализации 50,6 мл 25,0%-го раствора (плотность 1,24 г/мл) гидроксида калия? (4 балла)
7. При взаимодействии 1,36 г нитрата металла (I) с соляной кислотой образовалось 1,148 г хлорида металла (I). Определите формулу нитрата. Под каким названием известен данный нитрат в медицине? (5 баллов)
8. При полном окислении 4,32 г алюминия выделяется 134,08 кДж теплоты. Определите теплоту образования оксида алюминия. (3 балла)
9. Тетрагидрат нитрата кальция массой 59,000 г растворили в 105,000 мл воды и получили раствор объёмом 135,425 мл. Определите массовую долю нитрата кальция в растворе, его молярную концентрацию, плотность раствора. (6 баллов)
10. Смесь оксидов железа (II) и (III) массой 12 г, содержащая 74,667% железа, реагирует с 20%-ным раствором соляной кислоты. Определите массовые доли оксидов в смеси, массовые доли солей в растворе после реакции. (10 баллов)
11. Напишите уравнения реакций (молекулярные, ионные, ОВР), с помощью которых можно осуществить превращения:
Al Al2(SO4)3 AlCl3 Al(NO3)3 Al2O3 Al Na[Al(OH)4]
Al(NO3)3 H2S Al2S3 SO2 (10 баллов)
12. При взаимодействии смеси алюминия и сульфида алюминия с 20%-м раствором серной кислоты ( = 1,139 г/мл) выделяется 10,752 л (н. у.) смеси газов с относительной плотностью по водороду 5. Определите массовые доли компонентов в смеси, объемные и массовые доли газов в смеси, объем серной кислоты, вступившей в реакцию. (13 баллов)
Расчетные задачи 74 балла
Тест (каждое задание - 1 балл; итого 13 баллов)
1. Основные положения атомно-молекулярного учения сформулировал:
1) Д. И. Менделеев 2) М. В. Ломоносов 3) Л. А. Чугаев 4) И. В. Курчатов
2. В каком соединениии массовая доля серы такая же как и массовая доля кислорода в оксиде меди (II)
1) CuS 2) FeS2 3) Cu2S 4) Al2S3
3. Масса (в граммах) 0,4 моль нитрата железа (II) равна
1) 124 2) 56 3) 180 4) 72
4. Сумма коэффициентов в уравнении реакции:
(CuOH)2CO3 + HCl ® CuCl2 + CO2 + H2O равна
1) 5 2) 4 3) 11 4) 6
5. При 60°С в 20 г воды растворяется 24 г нитрата калия. Растворимость нитрата калия (в г/л) равна
1) 54,55 2) 120 3) 1200 4) 44
6. При разложении малахита образуются следующие вещества:
1) медь, углерод, водород, кислород 2) гидроксид меди (II), углекислый газ
3) оксид меди (II), оксид углерода (IV), вода 4) карбонат меди, вода
7. Водород в лаборатории получают в аппарате Киппа при взаимодействии
1) меди с соляной кислотой 2) алюминия с азотной кислотой
3) цинка с соляной кислотой 4) мрамора с соляной кислотой
8. Только амфотерные оксиды находятся в ряду
1) CO2, ZnO, Mn2O7 2) ZnO, Al2O3, Cr2O3
3) BeO, N2O5, Na2O 4) CaO, MnO, CrO3
9. Способ получения кислорода в промышленности:
1) разложение бертолетовой соли (KClO3)
2) разложение пероксида водорода (H2O2)
3) разложение перманганата калия (KMnO4)
4) фракционная перегонка (ректификация) жидкого воздуха
10. Порядковый номер элемента 127Э74
1) 201 2) 53 3) 74 4) 127
11. В каком из перечисленных рядов находятся кислоты: а) плавиковая (фтороводородная), б) ортофосфорная, в) дифосфорная (пирофосфорная), г) соляная (хлороводородная).
1) a) H2SiO3; б) HF; в) Н3РО4; г) НСlO; 2) a) HF; б) HF; в) H4P2O7, г) НСlO4;
3) а) Н4Р2О7; б) HF; в) Н4Р2О7; г) НС1О3; 4) a) HF; б) H3PO4, в) Н4Р2О7; г) НС1.
12. Изотопы находятся в ряду:
1) 6329Cu34, 6529Cu36 2) 4019K21, 4020Ca20 3) 3919K20, 4020Ca20 4) 3717Cl20, 5525Mn30
13. Экзотермической является реакция:
1) CaCO3 CaO + CO2 2) 2AgNO3 2Ag + 2NO2 + O2
3) 4HNO3 4NO2 + O2 + H2O 4) C + O2 CO2
Городская химическая олимпиада учащихся 8 классов 2010
Ответы к тесту
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
2 |
3 |
4 |
3 |
3 |
3 |
3 |
2 |
4 |
2 |
4 |
1 |
4 |
Задание 1
1. M(N2) = 28 г/моль 0,5 балла
n(N2)
=
![]() 0,5
балла
0,5
балла
2. V(N2) = 0,7 моль × 22,4 л/моль = 15,68 л 0,5 балла
3. N(N2) = 0,7 × 6,02 × 1023 моль-1 = 4,214 × 1023 0,5 балла
4.
ma(N2)
=
![]() 0,5
балла
0,5
балла
ma(N2)
=
![]() 0,5
балла
0,5
балла
5.
r(N2)
=
![]() 0,5
балла
0,5
балла
r(N2)
=
![]() 0,5
балла
0,5
балла
6.
![]() 0,5 балла
0,5 балла
![]() 0,5 балла
0,5 балла
Итого 5 баллов
Задание 2
n(молекул)
=
![]() 1
балл
1
балл
n(атомов)
=
![]() 1
балл
1
балл
М(в-ва) = 1000 г / 55, (5) моль = 18 г/моль
1 балл
n(молекул) : n(атомов) = 55,555 : 166,664 = 1 : 3 1 балл
Молекула вещества состоит из трех атомов
H2O - вода 1 балл
Итого 5 баллов
Задание 3
m (газа) / M (газа) = V (газа) / Vm
M(газа) = (1,6г ∙22,4л/моль) / 1,12 л = 32 г/моль
1 балл
О2 - кислород 1 балл
(SiH4 - силан)
Итого 2 балла
Задание 4
Mr(Fe2(SO4)3) = 400 + 18n 1 балл
0,15584
=
![]() n
= 12 1 балл
n
= 12 1 балл
Fe2(SO4)3 . 12H2O 1 балл
Итого 3 балла
Задание 5
n(Cr)
: n(O)
: n(H)
=
![]() 1
балл
1
балл
Cr(OH)3 - гидроксид хрома (III) 1 балл
Cr(OH)3 - амфотерный гидроксид 1 балл
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O 1 балл
Cr(OH)3
+ KOH
![]() KCrO2
+ 2H2O
KCrO2
+ 2H2O
Cr(OH)3 + OH- CrO2- + 2H2O 1 балл
Cr(OH)3 + 3KOH K3[Cr(OH)6]
Cr(OH)3 + 3OH- [Cr(OH)6]- 1 балл
2Cr(OH)3 (суспензия) + 3SO3 Cr2(SO4)3 + 3H2O
2Cr(OH)3 + 3SO3 2Cr3+ + 3SO42- + 3H2O 1 балл
2Cr(OH)3 Cr2O3 + 3H2O 1 балл
Итого 8 баллов
Задание 6
0,28 моль 0,14 моль
2KOH + H2SO4 = K2SO4 + H2O 1 балл
2 моль 1 моль
56 г/моль 98 г/моль
n(KOH) = (50,6 мл 0,25 1,24 г/мл) : 56 г/моль = 0,28 моль 1 балл
n( H2SO4) = n(KOH)/2 = 0,14 моль 1 балл
V(H2SO4) = (0,14 моль 98 г/моль) : (1,14 г/мл 0,2) = 60,2 мл 1 балл
Итого 4 балла
Задание 7
МеNO3 + HCl = MeCl + HNO3 1 балл
1 моль 1 моль
(х+62) г/моль (х+35,5) г/моль
( МеNO3) = ( MeCl)
![]() 1
балл
1
балл
1,36(х+35,5) = 1,148(х+62)
0,212х = 22,896 х = 108 1 балл
Ме - Ag (серебро) 1 балл
AgNO3 - ляпис 1 балл
Итого 5 баллов
Задание 8
0,16 моль 0,08 моль
4Al + 3O2 = 2Al2O3 1 балл
4 моль 2 моль
27 г/моль
ν (Al) = 4.32г / 27г/моль = 0,16 моль
1 балл
Q(Al2O3) = 134.08 кДж / 0,8 моль = 1676 кДж/моль
1 балл
Итого 3 балла
Задание 9
Ca(NO3)24H2O —— Ca(NO3)2; 1 балл
1 моль 1 моль
236 г/моль 164 г/моль
( Ca(NO3)2) = ( Ca(NO3)24H2O) = 59 г : 236 г/моль = 0,25 моль 1 балл
m(Ca(NO3)2р-р) = 59 г + 105 г = 164 г 1 балл
%( Ca(NO3)2) = (0,25 моль 164 г/моль 100%) : 164 г = 25,00 % 1 балл
c(Ca(NO3)2) = 0,25 моль : 0,135425 л = 1,846 моль/л 1 балл
( Ca(NO3)2 р-р) = 164 г : 135,425 мл = 1,211 г/мл 1 балл
Итого 6 баллов
Задание 10
(Fe)
=
![]() 1
балл
1
балл
х моль х моль у моль 2у моль
FeO Fe Fe2O3 2Fe
1 моль 1 моль 1 моль 2 моль
72 г/моль 56 г/моль 160 г/моль 56 г/моль 1 балл
72х + 160у = 12 у = 0,03
х + 2у = 0,16 х = 0,1 2 балла
0,1 моль 0,2 моль 0,1 моль
FeO + 2HCl = FeCl2 + H2O 1 балл
1 моль 2 моль 1 моль
36,5 г/моль 127 г/моль
0,03 моль 0,18 моль 0,06 моль
Fe2O3 + 6HCl = 2FeCl3 + 3H2O 1 балл
1 моль 6 моль 2 моль
162,5 г/моль
(HCl) = 0,2 + 0,18 = 0,38 моль 0,5 балла
m(p-pa HCl) = 0,38 моль ∙ 36,5 г/моль / 0,2 = 69,3 г
1 балл
m(p-pa соли) = 69,35 + 12 = 81,35 г 0,5 балла
W%(FeCl2) = (0,1 моль ∙ 127 г/моль / 81,35 г) ∙100% = 15,61%
0,5 балла
W%(FeCl3) = (0,06 моль ∙ 162,5 г/моль / 81,35 г) ∙100% = 12%
0,5 балла
W%(FeO) = (0,1 моль ∙72 г/моль / 12 г) ∙ 100% = 60%
0,5 балла
W%(Fe2O3) = (0,03 моль ∙ 160 г/моль / 12 г) ∙ 100% = 40%
0,5 балла
Итого 10 баллов
Задание 11
1) 2Al + 3H2SO4 = Al2(SO4)3 + 3H2 1 балл
2Al + 6H2SO4(конц) Al2(SO4)3 + 3SO2 + 6H2O
2) Al2(SO4)3 + 3BaCl2 = 2AlCl3 + 3BaSO4 1 балл
3) AlCl3 + 3AgNO3 = AgCl + Al(NO3)3 1 балл
4) 4Al(NO3)3 2Al2O3 + 12NO2 + 3O2 1 балл
5)
2Al2O3
![]() 4Al + 3O2 1
балл
4Al + 3O2 1
балл
6) 2Al + 6HOH + 2NaOH = 2Na[Al(OH)4] + 3H2 1 балл
7) Al + 4HNO3(p-p) = Al(NO3)3 + NO + 2H2O 1 балл
10Al + 36HNO3(p-p) = 10Al(NO3)3 + 3N2 + 18H2O
8Al + 30HNO3(p-p) = 8Al(NO3)3 + 3N2O + 15H2O
8Al + 30HNO3(очень разб.) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
Al + 6HNO3(конц) Al(NO3)3 + 3NO2 + 3H2O
2Al + 3Hg(NO3)2 = 2Al(NO3)3 + 3Hg
8) 2Al + 3S = Al2S3 1 балл
2Al + 3H2S(г) = Al2S3 + 3H2
9) 2Al2S3 + 9O2 = 2Al2O3 + 6SO2 1 балл
10) Al2S3 + 6HOH = 2Al(OH)3 + 3H2S 1 балл
Al2S3 + 6HCl = 2AlCl3 + 3H2S
Итого 10 баллов
Задание 12
(газов) = 10,752 л / 22,4 л/моль = 0,48 моль
1 балл
М(газов) = 5 2 г/моль = 10 г/моль 1 балл
m(газов) = 0,48 моль 10 г/моль = 4,8 г 1 балл
пусть (Н2) = х моль, а (H2S) = (0,48 - х) моль
2х + 34(0,48 - х) = 4,8 х = 0,36
(Н2) = 0,36 моль (H2S) = 0,12 моль 2 балла
W%(H2) = (0,36 моль ∙ 2 г/моль / 4,8 г) ∙ 100% = 15%
0,5 балла
%(Н2) = (0,36 моль / 0,48 моль) ∙ 100% = 75%
0,5 балла
%(H2S) = (0,12 моль / 0,48 моль) ∙ 100% = 25%
0,5 балла
W%(H2S) = (0,12 моль * 34 г/моль / 4,8 г) ∙ 100% = 85%
0,5 балла
0,24 моль 0,36 моль 0,36 моль
2Al + 3H2SO4 = Al2(SO4)3 + 3H2 1 балл
2 моль 3 моль
27 г/моль 98 г/моль
0,04 моль 0,12 моль 0,12 моль
Al2S3 + 3H2SO4 = Al2(SO4)3 + 3H2S 1 балл
1 моль 3 моль
150 г/моль
m(Al) = 0,24 моль 27 г/моль = 6,48 г 0,5 балла
m(Al2S3) = 0,04 моль 150 г/моль = 6 г 0,5 балла
m(смеси) = 6,48 г + 6 г = 12,8 г 0,5 балла
W%(Al)
=
![]() 0,5
балла
0,5
балла
W%(Al2S3)
=
![]() 0,5
балла
0,5
балла
(H2SO4) = 0,36 моль + 0,12 моль = 0,48 моль 0,5 балла
V(H2SO4) = 0,48 моль ∙ 98 г/моль / 0,2 ∙ 1,139 г/мл = 206,5 мл
1 балл
Итого 13 баллов
Расчетные задачи 74 балла
Городская химическая олимпиада учащихся 8 классов 2011
Задачи
1. Смесь алюминия и железа массой 9,52 г реагирует с 20%-ным раствором соляной кислоты (плотность 1,1 г/мл) с выделением 7,168 л газа (н.у.). Определите массовые доли металлов в исходной смеси и массовые доли солей в полученном растворе. (12 баллов)
2. При взаимодействии 9,12 г оксида металла (III) с серной кислотой образуется 23,52 г сульфата металла (III). Определите металл. (3 балла)
3. Смесь кальция и карбоната кальция прокалили на воздухе до постоянной массы. Вычислите массовые доли компонентов в исходной смеси, если известно, что масса исходной смеси равна массе твердых продуктов реакций. (6 баллов)
4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (10 баллов):
5. Русский химик В. М. Северин писал: «Имея железный купорос, можно бы приготовлять в России и купоросную кислоту».
Какая кислота называлась купоросной? Напишите уравнение получения этой кислоты и объясните, почему она называлась купоросной или «купоросным маслом»? Какие вещества называют купоросами? Приведите примеры. (5 баллов)
6. Даны твердые вещества в пробирках без надписей: CaCO3, CaS, CaCl2, Ca3(PO4)2, Ca(NO3)2. Как их можно различить используя минимальное число реагентов. Напишите соответствующие уравнения реакций. (10 баллов)
7. В соединении NY3X массовая доля азота составляет 13,861 %, а в соединении NY2X -16,471 %. Установите формулы веществ, назовите их, напишите уравнение реакций перехода NY3X в NY2X и NY2X в NY3X. (10 баллов)
Тест 1
К каждому заданию даны несколько ответов, из которых только один верный. Выберите верный ответ. В бланках ответов под номером выполняемого задания поставьте цифру, соответствующую правильному ответу.
1. Степень окисления хрома увеличивается в ряду:
1) KCrO2, K2CrO4, Cr2S3 2) CrO, Cr2(SO4)3, BaCrO4
3) CrS, CrCl2, CrSO4 4) Cr2O3, CrS, CrCl3
2. Во 2-м периоде VIA группе периодической системы находится химический элемент схема строения атома которого
1) 2) 3) 4)
3. К основным оксидам относится каждое из двух веществ:
1) MgO, ZnO 2) ZnO, Al2O3
3) A12O3, SO3 4) MgO, Cs2O
4. К кислотным оксидам относится каждое из двух веществ:
1) ZnO, Cl2O 2) MgO, ZnO
3) CO,CO2 4) Cl2O7, SO3
5. Степень окисления железа в соединении FeЭO4, массовая доля элемента в котором равна 38,462%
1) +2 2) +3 3) +6 4) +4
6. Масса (в граммах) 0,25 моль нитрата железа (II) равна:
1) 124 2) 56 3) 180 4) 45
7. Число атомов кислорода в 5,04 л оксида углерода (IV) равно:
1) 2,709 1023 2) 5,418 1023
3) 6,02 1023 4) 1,357 1023
8. Сумма коэффициентов в уравнении реакции:
Mg + HNO3 = Mg(NO3)2 + N2O + H2O равна
1) 14 2) 10 3) 24 4) 20
9. Если прокалить кусочек мела CaCO3, дать ему остыть, затем поместить остаток в пробирку с небольшим количеством воды и прибавить фенолфталеин, то в пробирке
1) не произойдет никаких изменений
2) раствор окрасится в малиновый цвет
3) образуется синий раствор
4) будет наблюдаться выделение пузырьков газа
10. Объем водорода (в литрах), выделяющийся при взаимодействии 4,86 г алюминия с 20%-ным раствором соляной кислоты:
1) 22,4 2) 4,032 3) 6,048 4) 0,896
11. Железо быстро взаимодействует с водным раствором
1) NH3 2) HCl 3) СO2 4) СО
12. Водный раствор серной кислоты реагирует с каждым из веществ:
1) железом и оксидом углерода (II) 2) медью и гидроксидом калия
3) алюминием и хлоридом натрия 4) цинком и оксидом натрия
13. Гидроксид алюминия взаимодействует с каждым из веществ:
1) медью и азотной кислотой
2) азотом и хлороводородом
3) гидроксидом калия и серной кислотой
4) гидроксидом кальция и сульфатом цинка
14. В перечне веществ кислотами являются:
А) CH4 Б) H2S В) H3PO4
Г) NH3 Д) H5IO6 Е) K2HPO4
1) АБВ 2) БВД 3) БГД 4) ВДЕ
15. В водном растворе протекает реакция между:
1) Mn и CuSO4 2) Fe и Al(NO3)3
3) Ag и ZnCl2 4) Ag и FeSO4
16. Как с гидроксидом натрия, так и с соляной кислотой взаимодействует:
1) CaO 2) CrO 3) ZnO 4) BaO
17. Количество вещества (моль), содержащееся в 10 мл брома (ρ=3,12 г/мл), равно:
1) 0,446 2) 0,195 3) 0,390 4) 1,390
18. Валентность азота одинакова в ряду соединений:
1) NH3, NF3, N2O3 2) NO, NO2, NOF
3) NO2, HNO3, HNO2 4) N2H4, N2O3, N2O5.
19. Нитрат серебра (I) в водном растворе реагирует с
1) BaSO4 2) FeO 3) CuCl2 4) H2SiO3
20. Смешали 200 г 15% раствора MgSO4 и 300 г 20% раствора MgSO4. Массовая доля (в процентах) сульфата магния в полученном растворе равна:
1) 9 2) 18 3) 27 4) 36
21. Реакция в результате которой выделяется газ
1) KOH + HCl 2) Cu(OH)2 + HNO3
3) K2S + Cu(NO3)2 4) K2CO3 + H2SO4
22. Массовая доля азота в нитрате железа (III) равна:
1) 17,355% 2) 15,556% 3) 11,570% 4) 23,140%
23. Углекислый газ в лаборатории получают в аппарате Киппа при взаимодействии:
1) мрамора с серной кислотой 2) алюминия с азотной кислотой
3) цинка с соляной кислотой 4) мрамора с соляной кислотой
24. В соединении Ca(ЭO3)2 массовая доля элемента 34,3 %. Неизвестный элемент — это …
1) фосфор; 2) хлор; 3) азот; 4) бром.
25. Молярная масса газа массой 1,28 г, занимающего объём 896 мл (н.у.), равна:
1) 44; 2) 28; 3) 32; 4) 16.
26. Наибольшая массовая доля фосфора в соединении
1) Mg3(PO4)2 2) Ba3(PO4)2 3) Ca3(PO4)2 4) Sr3(PO4)2
27. Углекислый газ объемом 3,36 л (н.у) имеет массу (в граммах)
1) 44 2) 6,6 3) 22,4 4) 12
28. При разложении малахита образуются следующие вещества:
1) медь, углерод, водород, кислород
2) гидроксид меди (II), углекислый газ
3) оксид меди (II), оксид углерода (IV), вода
4) карбонат меди, вода
29. Фенолфталеин приобретет малиновую окраску в растворе:
1) соляной кислоты 2) хлорида натрия
3) гидроксида серы (VI) 4) гидроксида натрия.
30. Только амфотерные оксиды находятся в ряду
1) CO2, ZnO, Mn2O7 2) ZnO, Al2O3, Cr2O3
3) BeO, N2O5, Na2O 4) CaO, MnO, CrO3
1. Смесь алюминия и железа массой 9,52 г реагирует с 20%-ным раствором соляной кислоты (плотность 1,1 гмл) с выделением 7,168 л газа (н.у.). Определите массовые доли металлов в исходной смеси и массовые доли солей в полученном растворе. (12 баллов)
х моль 3х моль х моль 1,5х моль
2Al + 6HCl = 2AlCl3 + 3H2 1 балл
2 моль 6 моль 2 моль 3 моль
27 г/моль 36,5 г/моль 133,5 г/моль 22,4 л/моль
у моль 2у моль у моль у моль
Fe + 2HCl = FeCl2 + H2 1 балл
1 моль 2 моль 1 моль 1 моль
56 г/моль 36,5 г/моль 127 г/моль 22,4 л/моль
(Н2) = 7,168л / 22,4 л/моль = 0,32 моль 1 балл
27х + 56у = 9,52 27х + 56у = 9,52 38у = 3,76
1,5х + у = 0,32 27х + 18у = 5,76
у = 0,0989 х = 0,1474 2 балла
(Al) = 0,1474 моль (Fe) = 0,0989 моль 2 балла
%(Al)
=
![]() 100%
= 41,8%
100%
= 41,8%
%(Fe)
=
![]() 100%
= 58,2% 1 балл
100%
= 58,2% 1 балл
(HCl) = 30,1474 моль + 20,0989 моль = 0,64 моль. 1 балл
m(р-ра
HCl)
=
![]() = 116,8 г. 1 балл
= 116,8 г. 1 балл
m(р-ра солей) = 116,8 г + 9,52 г - 0,32 моль2 г/моль = 125,68 г 1 балл
%(AlCl3)
=
![]() 100%
= 15,66%
100%
= 15,66%
%(FeCl2)
=
![]() 100%
= 9,99%. 1 балл
100%
= 9,99%. 1 балл
Итого 12 баллов
2. При взаимодействии 9,12 г оксида металла (III) с серной кислотой образуется 23,52 г сульфата металла (III). Определите металл. (3 балла)
Me2O3 + 3H2SO4 = Me2(SO4)3 + 3H2O 1 балл
1 моль 1 моль
(2х + 48)г/моль (2х + 288)г/моль
(Me2O3)
= (Me2(SO4)3)
(x)
=
![]()
![]() =
=
![]() ;
х
= 52 Cr
(хром),
Cr2O3,
Cr2(SO4)3
2 балла
;
х
= 52 Cr
(хром),
Cr2O3,
Cr2(SO4)3
2 балла
Итого 3 балла.
3. Смесь кальция и карбоната кальция прокалили на воздухе до постоянной массы. Вычислите массовые доли компонентов в исходной смеси, если известно, что масса исходной смеси равна массе твердых продуктов реакций. (6 баллов)
х моль х моль
2Са + О2 = 2СаО 1 балл
2 моль 2 моль
40 г/моль 56 г/моль
у моль у моль
СаСО3 = СаО + СО2 1 балл
1 моль 1 моль
100 г/моль 56 г/моль
40х + 100у = 56х + 56у 1 балл
16х = 44у х = 2,75у 1 балл
%(Са)
=
![]() =
=
![]() = 52,38% 1 балл
= 52,38% 1 балл
%(СаСО3)
=
![]() = 47,62% 1 балл
= 47,62% 1 балл
Итого 6 баллов
4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (10 баллов):
За каждое уравнение реакции по 1 баллу
1).
4Zn + 10HNO3(очень разб.) = 4Zn(NO3)2 + NH4NO3 + 3H2O;
5Zn + 12HNO3(разб) = 5Zn(NO3)2 + N2+ 6H2O;
4Zn + 10HNO3(разб) = 4Zn(NO3)2 + N2O + 5H2O;
3Zn + 8HNO3(разб) = 3Zn(NO3)2 + 2NO + 4H2O;
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2 + 2H2O;
Zn + Cu(NO3)2 = Zn(NO3)2 + Cu
2). Zn(NO3)2 + 2NaOH = Zn(OH)2 + 2NaNO3
Zn(NO3)2 + 2NH3.H2O = Zn(OH)2 + 2NH4NO3
3). Zn(OH)2 + 2KOH = K2[Zn(OH)4]
4). K2[Zn(OH)4] + 4HNO3 = 2KNO3 + Zn(NO3)2 + 4H2O
5). Zn + 2HCl = ZnCl2+ H2
Zn+ Cl2 = ZnCl2
Zn + CuCl2 = ZnCl2 + Cu
6). ZnCl2 + 2AgNO3 = 2AgCl + Zn(NO3)2
ZnCl2 + Pb(NO3)2 + PbCl2 + Zn(NO3)2
7). 2Zn(NO3)2 = 2ZnO + 4NO2 + O2
8). ZnO + 2HCl = ZnCl2 + H2O
9). 3ZnCl2 + 2Na3PO4 = Zn3(PO4)2 + 6NaCl
10) Zn3(PO4)2 + 6HNO3 = 3Zn(NO3)2 + 2H3PO4
Итого 10 баллов.
5. Русский химик В. М. Северин писал: «Имея железный купорос, можно бы приготовлять в России и купоросную кислоту». 1. Какая кислота называлась купоросной? 2. Напишите уравнение получения этой кислоты и объясните, почему она называлась купоросной или «купоросным маслом»? 3. Какие вещества называют купоросами? Приведите примеры.
Решение:
1. Концентрированная серная кислота (H2SO4) называлась в 17-18 в.в. «купоросной кислотой», «купоросным маслом», «купоросным спиртом».
1 балл.
2. Получали кислоту нагреванием железного купороса:
FeSO4.7H2O → H2SO4 + FeO + 6H2O
2 балла
3. «Купоросами» называют кристаллогидраты сульфатов некоторых металлов:
ZnSO4 . 7H2O – цинковый купорос,
CuSO4 . 5H2O – медный купорос («турецкий купорос»),
FeSO4.7H2O – железный купорос,
NiSO4.7H2O – никелевый купорос,
VSO4·7H2O – ванадиевый купорос,
CoSO4·7H2O – кобальтовый купорос
CrSO4·7H2O – хромовый купорос
MnSO4·5H2O – марганцевый купорос
Применяются в промышленности, сельском хозяйстве, медицине.
За каждую формулу по 0,5 балла.
Итого 7 баллов.
6. Даны твердые вещества в пробирках без надписей: CaCO3, CaS, CaCl2, Ca3(PO4)2, Ca(NO3)2. Как их можно различить используя минимальное число реагентов. Напишите соответствующие уравнения реакций.
CaCO3 + 2 HСl = CaCl2 + CO2↑ + H2O (газ без запаха) 2 балла
CaS + 2HCl = CaCl2 + H2S↑ (газ с запахом) 2 балла
Ca3(PO4)2 + 6HCl = 3 CaCl2 + 2H3PO4 (растворение вещества) 2 балла
CaCl2 + 2AgNO3 = Ca(NO3)2 + 2AgCl↓ (белый осадок) 2 балла
Ca(NO3)2 + H2SO4 = CaSO4↓ + 2 HNO3 (белый осадок) 2 балла
Итого 10 баллов.
7. В соединении NY3X массовая доля азота составляет 13,861 %, а в соединении NY2X -16,471 %. Установите формулы веществ, назовите их, напишите уравнение реакций перехода NY3X в NY2X и NY2X в NY3X.
Решение:
Чтобы определить элементы, выразим массовые доли азота в соединениях
ω%(N в NY3X) = 14/(14 + 3a + b) = 0,13861 1 балл
ω%(N в NY2X) = 14/(14 + 2a + b) = 0,16471 1 балл

14 + 3а + b = 101 a = 16 → O
14 + 2a + b = 85 b = 39 → K 2 балла
(вычитаем из первого уравнения второе, находим a и b – молярные массы элементов Y и X).
KNO3 – нитрат калия, калийная (индийская) селитра 1 балл
KNO2 – нитрит калия 1 балл
2KNO3 → 2KNO2 + O2 (400 – 520 0C) 1 балл
2KNO2 + O2 → 2KNO3 1 балл
KNO2 +H2O2 → KNO3 + H2O 1 балл
KNO2 + 2HNO3 → KNO3 + 2NO2 + H2O 1 балл
Итого: 10 баллов.
Ответы к тесту
№ задания |
Ответ |
|
№ задания |
Ответ |
1 |
2 |
|
16 |
3 |
2 |
3 |
|
17 |
2 |
3 |
4 |
|
18 |
1 |
4 |
4 |
|
19 |
3 |
5 |
2 |
|
20 |
2 |
6 |
4 |
|
21 |
4 |
7 |
1 |
|
22 |
1 |
8 |
3 |
|
23 |
4 |
9 |
2 |
|
24 |
2 |
10 |
3 |
|
25 |
3 |
11 |
2 |
|
26 |
1 |
12 |
4 |
|
27 |
2 |
13 |
3 |
|
28 |
3 |
14 |
2 |
|
29 |
4 |
15 |
1 |
|
30 |
2 |
Городская химическая олимпиада учащихся 8 классов, 2012
Тест
К каждому заданию даны несколько ответов, из которых только один верный. Выберите верный ответ. В бланках ответов под номером выполняемого задания поставьте цифру, соответствующую правильному ответу.
1. Степень окисления железа уменьшается в ряду:
1) KFeO2, K2FeO4, FeBr3 2) BaFeO4, Fe2(SO4)3, FeO
3) FeI2, FeCl2, FeSO4 4) Fe2O3, FeS, FeCl3
2. Какие две частицы являются изоэлектронными (имеют одинаковое число электронов)
1) Na и Ca2+ 2) S и Ar 3) S2- и Ca2+ 4) P и Cl-
3. К основным оксидам относится каждое из трех веществ:
1) MgO, ZnO, Cl2O7 2) ZnO, Al2O3, CaO
3) A12O3, SO3, Fe2O3 4) MgO, Cs2O, Ag2O
4. К кислотным оксидам относится каждое из трех веществ:
1) ZnO, Cl2O, Na2O 2) MgO, ZnO, N2O
3) CO, CO2, Al2O3 4) Cl2O7, SO3, Mn2O7
5. Степень окисления марганца в соединении Mn(ClO4)n, массовая доля марганца в котором равна 21,6535%
1) +6 2) +2 3) +3 4) +4
6. Масса (в граммах) 0,125 моль сульфата хрома (III) равна:
1) 192 2) 392 3) 98 4) 49
7. Масса (в граммах) молекулы оксида углерода (II) равна:
1) 4,651 10-23 2) 1,661 10-24
3) 6,02 1023 4) 28
8. Сумма коэффициентов в уравнении реакции:
Al + HNO3 очень разб. = Al(NO3)3 + NH4NO3 + H2O равна
1) 30 2) 38 3) 58 4) 20
9. Оксид углерода (IV) массой 9,9 г занимает при н.у. объем (в литрах)
1) 22,4 2) 5,04 3) 10,08 4) 2,52
10. Из перечисленных веществ кислой солью является:
1) NH4NO3 2) Na2CO3 3) NaHCO3 4) (MgOH)2CO3
11. Раствор серной кислоты будет реагировать со всеми из веществ в группе:
1) HCl, BaSO4, NaOH 2) Zn, ZnO, Zn(OH)2
3) СO2, C, Na2CO3 4) Cu, CuO, Cu(OH)2
12. Наибольшее число атомов содержится в:
1) 4,4 г СО2 2) 3,2 г О2 3) 19,6 г Н3РО4 4) 27 г Н2О
13. В реакцию с 10,08 л кислорода (н.у.) может вступить алюминий массой (в граммах):
1) 27 2) 10,8 3) 16,2 4) 11,34
14. Гидроксид хрома (III) взаимодействует с каждым из веществ:
1) гидроксидом меди (II) и азотной кислотой
2) гидроксидом цезия и серной кислотой
3) соляной кислотой и хлоридом бария
4) гидроксидом бария и сульфатом натрия
15. Фосфат натрия из сточных вод удаляют полностью с помощью
1) Ca(OH)2 2) NaCl 3) HNO3 4) KOH
16. Как с гидроксидом натрия, так и с соляной кислотой взаимодействует:
1) CaCO3 2) Na2CO3 3) Pb(NO3)2 4) Sr(OH)2
17. Количество вещества (моль), содержащееся в 12 мл брома (ρ=3,12 г/мл), равно:
1) 0,468 2) 0,234 3) 0,936 4) 1,07
18. Объем (в литрах) оксида углерода (IV), полученного при полном сгорании 15 л пропана (С3Н8) (н.у.) равен:
1) 45 2) 75 3) 22,4 4) 88,4
19. Смешали 400 г 10% раствора CuCl2 и 200 г 40% раствора CuCl2. Массовая доля (в процентах) хлорида меди (II) в полученном растворе равна:
1) 15 2) 25 3) 20 4) 30
20. Число нейтронов в ядре 17О
1) 8 2) 9 3) 16 4) 17
21. Реакция в результате которой выпадает осадок
1) NaOH + HClO3 2) Cu(OH)2 + HBr
3) Na2CO3 + H2SeO4 4) Na2S + Hg(NO3)2
22. Массовая доля фтора будет наибольшей в соединении
1) BF3 2) AlF3 3) ScF3 4) GaF3
23. Водород в лаборатории получают в аппарате Киппа при взаимодействии:
1) цинка с серной кислотой 2) цинка с азотной кислотой
3) цинка и фосфорной кислотой 4) цинка с соляной кислотой
24. В соединении Ba(ЭO3)2 массовая доля элемента 40,712 %. Неизвестный элемент — это …
1) йод; 2) бром; 3) хлор; 4) азот.
25. Молярная масса газа массой 2,56 г, занимающего объём 896 мл (н.у.), равна:
1) 80; 2) 44; 3) 64; 4) 46.
26. В четырех пробирках находятся растворы сульфата, сульфита, сульфида и силиката калия. С помощью какого реагента можно распознать все четыре соли
1) соляная кислота 2) гидроксид бария
3) лакмус 4) хлорид бария
27. Содержание сульфата магния в растворе хлорида калия можно обнаружить с помощью
1) хлорида аммония 2) хлорида бария
3) нитрата серебра 4) фенолфталеина
28. Соединения состава NаЭО3 и NаЭО4 может образовать
1) углерод 2) сера 3) хлор 4) фосфор
29. Лакмус приобретет красную окраску в растворе:
1) гидроксид кальция 2) хлорида калия
3) поваренной соли 4) серной кислоты
30. Способ получения кислорода в промышленности
1) разложение KMnO4 2) ректификация жидкого воздуха
3) разложение KClO3 4) разложение H2O2
Задачи
1. В ёмкости помещается 4,01(3) ∙ 1026 молекул воды. В такой же ёмкости помещается 4,878 ∙ 1026 атомов ртути. Каков объем ёмкости? Какова плотность ртути (в кг/м3, если плотность воды 1000 кг/м3)? (3 балла)
2. В XVIII - XIX веках в России это химическое вещество называли «соляной спирт», «морская кислота». В 1790 году русский академик Эрик Густав (Кирилл Густавович) Лаксман ввел для этого вещества название, которым мы пользуемся и по сей день. Приведите современное название вещества. Составьте уравнения реакций взаимодействия этого вещества с железом, оксидом магния, гидроксидом натрия, гидроксидом хрома (III), карбонатом натрия, силикатом натрия, нитратом серебра, гидрокарбонатом натрия, карбонатом гидроксомеди (II) (малахитом), тетрагидроксо-алюминатом натрия. (13 баллов)
3. Относительная плотность по гелию смеси азота и аммиака равна 5,35. Вычислите массовые и объемные доли газов в смеси. (6 баллов)
4. Нонагидрат нитрата алюминия массой 60 г растворили в 167,2 мл воды и получили раствор объемом 201,8 мл. Вычислите массовую долю нитрата алюминия в растворе, его молярную концентрацию и плотность раствора. (6 баллов)
5. Оксид металла содержит 77,(7)% металла по массе. Определите формулу оксида, назовите его. Какие еще оксиды образует данный металл? Назовите их. (7 баллов)
6. Смесь сульфита и сульфата калия массой 13,04 г растворили в воде и получили 42,4 мл раствора (ρ = 1,18 г/мл). Полученный раствор полностью реагирует с 79,7 мл 25%-го раствора нитрата свинца (II) (ρ = 1,329 г/мл). Вычислите молярные концентрации сульфита и сульфата калия в растворе. Какова массовая доля нитрата калия в фильтрате? (11 баллов)
7. В раствор, содержащий 0,1 моль нитрата магния и 0,08 моль нитрата серебра, поместили железную пластинку массой 10 г. Какую массу будет иметь пластинка после окончания реакции? (7 баллов)
8. При полном термическом разложении КГОn массой 11,08 г выделилось 3,584 л (н.у.) кислорода, а в твердом остатке массовая доля калия равна 52,349%, галогена – 47,651%. Выведите формулу КГОn, назовите его. (7 баллов)
9. Вещество (МеОН)2СО3 массой 12,7 г полностью реагирует с 59,7 мл 10%-го раствора азотной кислоты (ρ = 1,056 г/мл). Выведите молекулярную формулу вещества, назовите его. Какова массовая доля соли в растворе после реакции? Как данное соединение реагирует с концентрированным раствором гидроксидом натрия, оксидом углерода (IV), разлагается при нагревании? (10 баллов)
(70 баллов)
1. В ёмкости помещается 4,01(3) ∙ 1026 молекул воды. В такой же ёмкости помещается 4,878 ∙ 1026 атомов ртути. Каков объем емкости? Какова плотность ртути (в кг/м3, если плотность воды 1 г/см3 или 1000 кг/м3)? (3 балла)
n(H2O) = 4,01(3) ∙ 1026/6,02 ∙ 1023 моль-1 =666,667 моль 0,5 балла
m(H2O) = 666,667 моль ∙ 18 г/моль = 12000 г (12 кг) 0,5 балла
V(емкости) = 12 кг /1000 кг/м3 = 0,012 м3 (12 л) 0,5 балла
n(Hg) = 4,878 ∙ 1026/6,02 ∙ 1023 моль-1 = 810,299 моль 0,5 балла
m(Hg) = 810,299 моль ∙ 200,59 г/моль = 162,538 кг 0,5 балла
ρ(Hg) = 162,538 кг / 0,012 м3 = 13545 кг/м3 (13,545 г/см3) 0,5 балла
2. В XVIII - XIX веках в России это химическое вещество называли «соляной спирт», «морская кислота». В 1790 году русский академик Эрик Густав (Кирилл Густавович) Лаксман ввел для этого вещества название, которым мы пользуемся и по сей день. Приведите современное название вещества. Составьте уравнение реакций взаимодействия этого вещества с железом, оксидом магния, гидроксидом натрия, гидроксидом хрома (III), карбонатом натрия, силикатом натрия, нитратом серебра, гидрокарбонатом натрия, карбонатом гидроксомеди (II) (малахитом), тетрагидроксоалюминатом натрия. (13 баллов)
НСl -раствор хлороводорода в воде - соляная кислота. 1 балл
1. Fe + 2НСl = FeCl2 + Н2↑ 1 балл
2. 4Fe + 3О2 +12НСl = 4FeCl3 + 6Н2О 1 балл
3. MgO + 2НСl = MgCl2 + Н2О 1 балл
4. NaOH + НСl = NaCl + Н2О 1 балл
5. Сr(ОН)3 + 3НСl = СrС13 + 3Н2О 1 балл
6. Na2CО3 + 2НСl = 2NaCl + СО2↑+ Н2О 1 балл
7. Na2SiО3 + 2НСl = 2NaCl + H2SiО3↓ 1 балл
8. AgNО3 + НСl = AgCl↓ + HNО3 1 балл
9. NaHCО3 + HCl = NaCl + CО2↑+ H2О 1 балл
10. (CuOH)2CО3 + 4HCl = 2CuCl2 + CО2↑+ 3H2О 1 балл
11. Na[Al(OH)4] + HCl = NaCl + Al(OH)3↓ + H2О 1 балл
12. Na[Al(OH)4] + 4HCl = NaCl + A1C13+ 4H2О 1 балл
3. Относительная плотность по гелию смеси азота и аммиака равна 5,35. Вычислите массовые и объемные доли газов в смеси. (6 баллов)
M(N2 + NH3) = 5,35 ∙ 4 г/моль = 21,4 г/моль 1 балл
n(N2 + NH3) = 1 моль m(N2 + NH3) = 21,4 г 1 балл
M(N2) = 28 г/моль n(N2) = x моль
M(NH3) = 17 г/моль n(NH3) = (1 - x) моль
28x + 17(1 - x) = 21,4
28x + 17 - 17x = 21,4 11х = 4,4 x = 0,4
n(N2) = 0,4 моль n(NH3) = 0,6 моль 2 балл
φ%(N2) = (0.4 моль / 1 моль) ∙ 100% = 40% 0,5 балла
φ%(NH3) = (0.6 моль / 1 моль) ∙ 100% = 60% 0,5 балла
w%(N2) = (0.4 моль ∙ 28 г/моль / 21,4 г) -100% = 52,34% 0,5 балла
w%(NH3) = (0.6 моль ∙ 17 г/моль / 21,4 г) -100% = 47,66% 0,5 балла
4. Нонагидрат нитрата алюминия массой 60 г растворили в 167,2 мл воды и получили раствор объемом 201,8 мл. Вычислите массовую долю нитрата алюминия в растворе, его молярную концентрацию и плотность раствора. (6 баллов)
Al(NО3)3.9H2О → Al(NО3)3
1 моль 1 моль
375 г/моль 213 г/моль
n(Al(NО3)3.9H2О) = n(Al(NО3)3) = 60 г / 375 г/моль = 0,16 моль 1 балл
m(p-pa A1(NO3)3) = 60 г + 167,2 г = 227,2 г 1 балл
w%(Al(NО3)3) = (0,16 моль ∙ 213 г/моль / 227 г) ∙ 100% = 15% 1 балл
c(Al(NO3)3) = 0,16 моль / 0,2018 л = 0,793 моль/л 1 балл
ρ(А1(NO3)3) = 227,2 г / 201,8 мл = 1,126 г/мл 1 балл
5. Оксид металла содержит 77,(7)% металла по массе. Определите формулу оксида, назовите его. Какие еще оксиды образует данный металл? Назовите их. (7 баллов)
Ме2Оn → 2Me 1 балл
1моль 2 моль
(2х+16n) г/моль х г/моль
0,(7) = 2х / (2х+16n) х = 28n 1 балл
n = 1 → x = 28 ─
n = 2 → x = 56 х=56, Fe, FeO - оксид железа (II) 2 балла
Fe2O3 - оксид железа (III), гематит, красный железняк 1 балл
Fe3O4, (Fe+2Fe+32)O4 - железная окалина, магнитный железняк, магнетит, оксид дижелеза(III)-железа(II). 1 балл
FeO4 - оксид железа(VIII). 1 балл
6. Смесь сульфита и сульфата калия массой 13,04 г растворили в воде и получили 42,4 мл раствора (ρ = 1,18 г/мл). Полученный раствор полностью реагирует с 79,7 мл 25%-го раствора нитрата свинца (II) (ρ = 1,329 г/мл). Вычислите молярные концентрации сульфита и сульфата калия в растворе. Какова массовая доля нитрата калия в фильтрате? (11 баллов)
х моль х моль 2х моль х моль
K2SО3 + Pb(NО3)2 = 2KNО3 + PbSО3↓ 2 балла
1 моль 1 моль 1 моль 1 моль
158 г/моль 331 г/моль 101 г/моль 287 г/моль
у моль у моль 2у моль у моль
K2SО4 + Pb(NО3)2 = 2KNО3 + PbSО4↓ 2 балла
1 моль 1 моль 2 моль 1 моль
174 г/моль 331 г/моль 101 г/моль 303 г/моль
n(Pb(NO3)2) = (79,7 мл ∙ 0,25 ∙ 1,329 г/мл) / 331 г/моль = 0,08 моль 1 балл

 158х
+ 174у = 13,04 х =
0,055
158х
+ 174у = 13,04 х =
0,055
х + у = 0,08 у = 0,025
n(K2SО3) = 0,055 моль n(K2SО4) = 0,025 моль 1балл
c(K2SО3) = 0,055 моль / 0,0424 л = 1,297 моль/л 1 балл
c(K2SО4) = 0,025 моль / 0,0424 л = 0,59 моль/л 1 балл
m (р-ра после реакции) = 42,4 ∙ 1,18 + 79,7 ∙ 1,329 - (0,055 ∙ 287 + 0,025 ∙ 303) = 132,5933 г 1балл
n(KNО3) = 0,11 + 0,05 = 0,16 моль 1 балл
w%( KNО3) =((0,16 моль ∙ 101 г/моль) / 132,5933 г) ∙ 100% = 12,2% 1 балл
7. В раствор, содержащий 0,1 моль нитрата магния и 0,08 моль нитрата серебра, поместили железную пластинку массой 10 г. Какую массу будет иметь пластинка после окончания реакции? (6 баллов)
n(Fe) = 10 г / 56 г/моль = 0,179 моль 1 балл
Mg(NО3)2 + Fe ≠ 1балл
0,08 моль 0,04 моль 0,08 моль
AgNO3 + Fe → Fe(NО3)2 + 2Ag↓ 2 балла
2 моль 1моль 2 моль
56 г/моль 108 г/моль
Δm = 0,08 ∙ 108 - 0,04 ∙ 56=6,4r 1 балл
m(пластинки)= 10 + 6,4= 16,4г или
m(пластинки)=10 - 0,04 ∙ 56 + 0,08 ∙ 108=16,4 г 1 балл
Масса пластинки увеличилась, т.к. железо (М = 56 г/моль) вступило в реакцию, а серебро (М = 108 г/моль) выделилось на пластинке.
8. При полном термическом разложении КГОn массой 11,08 г выделилось 3,584 л (н.у.) кислорода, а в твердом остатке массовая доля калия равна 52,349%, галогена – 47,651%. Выведите формулу КГОn, назовите его. (7 баллов)
КГ → К 1 балл
1 моль 1 моль
(39 + х) г/моль 39 г/моль
0,52349 = 39 / (39 + х) х = 35,5 → Cl, KCl 1 балл
0,32/n моль 0,16 моль
2KClOn → 2KCl + nO2 2 балл
2 моль n моль
(74,5 + 16n) г/моль 22,4 л/моль
n(O2) = 3,584 л / 22,4 л/моль = 0,16 моль 1 балл
0,32 / n = 11,08 / (74,5 + 16n) n = 4 1 балл
KClO4 – перхлорат калия 1 балл
9. Вещество (МеОН)2СО3 массой 12,7 г полностью реагирует с 59,7 мл 10%-го раствора азотной кислоты (ρ = 1,056 г/мл). Выведите молекулярную формулу вещества, назовите его. Какова массовая доля соли в растворе после реакции? Как данное соединение реагирует с концентрированным раствором гидроксидом натрия, оксидом углерода (IV), разлагается при нагревании? (10 баллов)
0,025 моль 0,1 моль
(МеОН)2СО3 + 4HNO3 = 2Me(NO3)2 + CO2↑ + 3H2O 1 балл
1 моль 4 моль
(2х + 94) г/моль 63 г/моль
n(HNO3) = (59,7 мл ∙ 1,056 г/мл ∙ 0,1) / 63 г/моль 0,1 моль 1 балл
2х + 94 = 12,7 / 0,025 х = 207, Pb 1 балл
(PbOH)2CO3 – карбонат гидроксосвинца (II), гидроксокарбонат свинца (II) 1 балл
0,025 моль 0,1 моль
(PbОН)2СО3 + 4HNO3 = 2Pb(NO3)2 + CO2↑ + 3H2O 1 балл
1 моль 4 моль 2 моль 1 моль
331 г/моль 44 г/моль
m(р-ра) = 12,7 г + 59,7 мл ∙ 1,056 г/мл – 0,025 моль ∙ 44 г/моль = 74,6432 г 1 балл
w%( Pb(NO3)2) = ((0,05 моль ∙ 331 г/моль) / 74,6432 г) ∙ 100% = 22,2% (1 балл)
(PbОН)2СО3 + 6NаOH = 2Na2[Pb(OH)4] + Na2CO3 1 балл
(PbОН)2СО3 + CO2 = 2PbCO3 + H2O 1 балл
(PbОН)2СО3 = 2PbO + CO2↑ + H2O 1 балл
(70 баллов)
Тест
№ задания |
Ответ |
|
№ задания |
Ответ |
1 |
2 |
|
16 |
3 |
2 |
3 |
|
17 |
2 |
3 |
4 |
|
18 |
1 |
4 |
4 |
|
19 |
3 |
5 |
2 |
|
20 |
2 |
6 |
4 |
|
21 |
4 |
7 |
1 |
|
22 |
1 |
8 |
3 |
|
23 |
4 |
9 |
2 |
|
24 |
2 |
10 |
3 |
|
25 |
3 |
11 |
2 |
|
26 |
1 |
12 |
4 |
|
27 |
2 |
13 |
3 |
|
28 |
3 |
14 |
2 |
|
29 |
4 |
15 |
1 |
|
30 |
2 |
Городская химическая олимпиада учащихся 8 классов, 2013
Тест
К каждому заданию даны несколько ответов, из которых только один верный. Выберите верный ответ. В бланках ответов под номером выполняемого задания поставьте цифру, соответствующую правильному ответу. (всего 10 баллов)
1. Масса (в граммах) молекулы азота равна:
1) 4,651 10-23 2) 1,661 10-24
3) 6,02 1023 4) 28
2. Сумма коэффициентов в уравнении реакции:
Ba3N2 + HNO3 = Ba(NO3)2 + NH4NO3 равна
1) 5 2) 9 3) 13 4) 14
3. Оксид азота (I) массой 9,9 г занимает при н.у. объем (в литрах)
1) 22,4 2) 5,04 3) 10,08 4) 2,52
4. Кислотой, в которой массовая доля атомарного водорода равна 2,439% является
1) сероводородная 2) серная
3) сернистая 4) тиосерная
5. В соединении KЭO4 массовая доля элемента 34,81 %. Неизвестный элемент — это
1) хлор; 2) бром; 3) йод; 4) марганец.
6. Скорость реакции наибольшая при взаимодействии цинка с водным раствором
1) NH3 2) СO2 3) HCl 4) NaCl
7. В окислительно-восстановительной реакции P + HNO3конц. = H3PO4 + NO2↑ + H2O восстановителем является
1) фосфор 2) азот 3) водород 4) кислород
8. Массовая доля (в процентах) соляной кислоты, полученной растворением 8,96 л (н.у.) хлороводорода в 58,4 мл воды, равна
1) 13,3 2) 26,6 3) 20 4) 36
9. В цепочке Cu(OH)2 → X → CuS вещество X – это:
1) Cu; 2) Cu(NO3)2; 3) CuO; 4) Cu2O.
10. Молярная масса газа массой 0,68 г, занимающего объём 896 мл (н.у.), равна:
1) 32; 2) 64; 3) 17; 4) 44.
Задачи
1. Русский химик и минералог В.М. Севергин в 1804 году писал: «Имея железный купорос, можно бы приготовлять в России и купоросную кислоту». Термины «купоросная кислота» и «купоросное масло» встречались в России уже в XVII веке.
1) Какую кислоту называли «купоросным маслом»? Назовите кислоту и напишите ее формулу.
2) Почему ее называли «купоросным маслом»?
3) Напишите уравнения реакций взаимодействия этой кислоты с железом (разбавленная и концентрированная кислота), оксидом магния, гидроксидом натрия, гидроксидом хрома (III), карбонатом натрия, силикатом натрия, хлоридом бария, гидрокарбонатом натрия, карбонатом гидроксомеди (II) (малахитом), тетрагидроксоалюминатом натрия. (16 баллов)
2. На нейтрализацию 40,56 г 25%-го раствора одноосновной кислородсодержащей кислоты израсходовано 24 мл раствора гидроксида натрия концентрацией 5 моль/л.
1) Выведите формулу кислоты, назовите её.
2) Какую соль данной кислоты получают в промышленности и где она применяется? (10 баллов)
3. Хром вступил в реакцию с бромом. Продукт реакции растворили в воде и добавили раствор гидроксида натрия. Выпавший осадок серо-зеленого цвета разделили на две части. Одну из частей растворили в азотной кислоте, а другую – в концентрированном растворе гидроксида натрия. Напишите уравнения описанных реакций. (4 балла)
4. Смесь алюминия и железа полностью реагирует с 8,064 л хлора. Такая же масса смеси полностью реагирует с 109,5 мл 20%-го раствора соляной кислоты (=1,1 г/мл). Каковы массовые доли металлов в исходной смеси? (12 баллов)
5. В кабинете химии найден обрывок шпаргалки, на котором записаны только правые части химических уравнений. Восстановите левые части уравнений. (10 баллов)
1) = 4Al2O3 + 9Fe 5) = 2Na[Al(OH)4] + 3H2↑
2) = Al(NO3)3 + 3H2O 6) = Al(NO3)3 + 3NO2↑ + 3H2O
3) =2Al(NO3)3 7) = 4Al(NO3)3 + 3CH4↑
4) = 2Al(NO3)3 + 3H2O 8) = 2Na[Al(OH)4] + 3H2↑ + 2Na2HPO4
6. Нитрид металла Me3Nn массой 7,5 г полностью реагирует с 132,1 мл 25%-го раствора азотной кислоты (ρ = 1,145 г/мл). Выведите формулу нитрида металла. Каковы массовые доли веществ в растворе после реакции? (9 баллов)
7. Смесь кальция и карбоната кальция прокалили на воздухе до постоянной массы. Вычислите массовые доли компонентов в исходной смеси, если известно, что масса исходной смеси равна массе твердых продуктов реакций. (6 баллов)
(всего 77 баллов)
Городская химическая олимпиада учащихся 8 классов, 2013
Решения
Тест
Номер задание |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
Ответ |
1 |
4 |
2 |
3 |
4 |
3 |
1 |
3 |
2 |
3 |
Задачи
1. Русский химик и минералог В.М. Севергин в 1804 году писал: «Имея железный купорос, можно бы приготовлять в России и купоросную кислоту». Термины «купоросная кислота» и «купоросное масло» встречались в России уже в XVII веке.
1.) Какую кислоту называли «купоросным маслом»? Назовите кислоту и напишите ее формулу.
2.) Почему ее называли «купоросным маслом»?
3.) Напишите уравнения реакций взаимодействия этой кислоты с железом (разбавленная и концентрированная кислота), оксидом магния, гидроксидом натрия, гидроксидом хрома (III), карбонатом натрия, силикатом натрия, хлоридом бария, гидрокарбонатом натрия, карбонатом гидроксомеди (II) (малахитом), тетрагидроксоалюминатом натрия. (16 баллов)
1. Н2SO4 – серная кислота 1 балл
2. Серную кислоту получали нагреванием железного купороса в глиняных ретортах. 1 балл
Концентрированная серная кислота является тяжелой маслянистой жидкость. 1 балл
3.
1.) Fe + Н2SO4 = FeSO4 + Н2↑ 1 балл
2.) 2Fe + 6Н2SO4конц., гор. = Fe2(SO4)3 + 3SO2↑ + 6Н2О 1 балл
3.) 4Fe + 3О2 + 6Н2SO4 = 2Fe2(SO4)3 + 6Н2О 1 балл
4.) MgO + Н2SO4 = MgSO4 + Н2О 1 балл
5.) 2NaOH + Н2SO4 = Na2SO4 + 2Н2О 1 балл
6.) 2Сr(ОН)3 + 3Н2SO4 = Сr2(SO4)3 + 6Н2О 1 балл
7.) Na2CО3 + Н2SO4 = Na2SO4 + СО2↑+ Н2О 1 балл
8.) Na2SiО3 + Н2SO4 = Na2SO4 + H2SiО3↓ 1 балл
9.) BaCl2 + Н2SO4 = BaSO4↓ + HCl 1 балл
10.) 2NaHCО3 + Н2SO4 = Na2SO4 + 2CО2↑+ 2H2О 1 балл
11.) (CuOH)2CО3 + 2Н2SO4 = 2CuSO4 + CО2↑+ 3H2О 1 балл
12.) 2Na[Al(OH)4] + Н2SO4 = Na2SO4 + Al(OH)3↓ + 2H2О 1 балл
13.) 2Na[Al(OH)4] + 4Н2SO4 = Na2SO4 + Al2(SO4)3+ 8H2О 1 балл
2. На нейтрализацию 40,56 г 25%-го раствора одноосновной кислородсодержащей кислоты израсходовано 24 мл раствора гидроксида натрия концентрацией 5 моль/л.
1.) Выведите формулу кислоты, назовите её.
2.) Какую соль данной кислоты получают в промышленности и где она применяется? (10 баллов)
HЭOn + NaOH = NaЭOn + H2O 2 балла
1 моль 1 моль
(1+х+16n) г/моль
ν(NaOH) = 0,024л ∙ 5моль/л = 0,12 моль 1 балл
ν(NaOH) = ν(HЭOn) = 0,12 моль 1 балл
m(HЭOn) = 40,56г ∙ 0,25 = 10,14 г 1 балл
М(HЭOn) = 10,14г / 0,12 моль = 84,5 г/моль 1 балл
1 + х + 16n = 84,5 х = 83,5 – 16n
n = 1 х = 67,5 —
n = 2 х = 51,5 —
n = 3 х = 35,5 Cl, HClO3 1 балл
n = 4 х = 19,5 —
HClO3 – хлорноватая кислота 1 балл
KClO3 – хлорат калия, бертолетова соль 1 балл
KClO3 применяется в лаборатории для получения кислорода 2KClO3 = 2KCl + 3O2↑ (MnO2, tº)
Применяется как окислитель в зажигательных смесях для головок спичек. 1 балл
3. Хром вступил в реакцию с бромом. Продукт реакции растворили в воде и добавили раствор гидроксида натрия. Выпавший осадок серо-зеленого цвета разделили на две части. Одну из частей растворили в азотной кислоте, а другую – в концентрированном растворе гидроксида натрия. Напишите уравнения описанных реакций. (4 балла)
1. 2Cr + 3Br2 = 2CrBr3 1 балл
2. CrBr3 + 3NaOH = Cr(OH)3↓ + 3NaBr 1 балл
3. Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O 1 балл
4. Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] 1 балл
4. Смесь алюминия и железа полностью реагирует с 8,064 л хлора. Такая же масса смеси полностью реагирует с 109,5 мл 20%-го раствора соляной кислоты (=1,1 г/мл). Каковы массовые доли металлов в исходной смеси? (12 баллов)
х моль 1,5х моль
2Al + 3Cl2 = 2AlCl3 1 балл
2 моль 3 моль
27 г/моль 22,4 л/моль
у моль 1,5у моль
2Fe + 3Cl2 = 2FeCl3 1 балл
2 моль 3 моль
56 г/моль 22,4 л/моль
ν(Cl2) = 8,064л / 22,4л/моль = 0,36 моль 1 балл
х моль 3х моль
2Al + 6HCl = 2AlCl3 + 3 H2↑ 1 балл
2 моль 6 моль
36,5 г/моль
у моль 2у моль
Fe + 2HCl = FeCl2 + H2↑ 1 балл
1 моль 2 моль
ν(HCl) = (109,5мл ∙ 1,1г/мл ∙ 0,2) / 36,5г/моль = 0,66 моль 1 балл
![]()
![]() 1
балл
1
балл
m(Al) = 0,18моль ∙ 27г/моль = 4,86 г 1 балл
m(Fe) = 0,06моль ∙ 56г/моль = 3,36 г 1 балл
m(Al + Fe) = 4,86г + 3,36г = 8,22 г 1 балл
ω%(Al) = 4,86г/8,22г ∙ 100% = 59,12% 1 балл
ω%(Fe) = 3,36г/8,22г ∙ 100% = 40,88% 1 балл
5. В кабинете химии найден обрывок шпаргалки, на котором записаны только правые части химических уравнений. Восстановите левые части уравнений. (10 баллов)
1.) = 4Al2O3 + 9Fe 5.) = 2Na[Al(OH)4] + 3H2↑
2.) = Al(NO3)3 + 3H2O 6.) = Al(NO3)3 + 3NO2↑ + 3H2O
3.) =2Al(NO3)3 7.) = 4Al(NO3)3 + 3CH4↑
4.) = 2Al(NO3)3 + 3H2O 8.) = 2Na[Al(OH)4] + 3H2↑ + 2Na2HPO4
1.) 8Al + 3Fe3O4 = 4Al2O3 + 9Fe 1 балл
2.) Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O 1 балл
3.) Al2O3 + 3N2O5 =2Al(NO3)3 1 балл
4.) Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O 1 балл
5.) 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑ 1 балл
6.) Al + 6HNO3конц., гор. = Al(NO3)3 + 3NO2↑ + 3H2O 1 балл
7.) Al4С3 + 12HNO3 = 4Al(NO3)3 + 3CH4↑ 2 балла
8.) 2Al + 2Na3PO4 + 8H2O = 2Na[Al(OH)4] + 3H2↑ + 2Na2HPO4 2 балла
6. Нитрид металла Me3Nn массой 7,5 г полностью реагирует с 132,1 мл 25%-го раствора азотной кислоты (ρ = 1,145 г/мл). Выведите формулу нитрида металла. Каковы массовые доли веществ в растворе после реакции? (9 баллов)
Me3Nn + 4n HNO3 = 3Me(NO3)n + nNH4NO3 1 балл
1 моль 4n моль
(3а + 14n)г/моль 63 г/моль
ν(HNO3) = (132,1мл ∙ 1,145г/мл ∙ 0,25) / 63г/моль = 0,6 моль 1 балл
ν(Me3Nn) = 0,6/4n = 0,15/n моль 1 балл
7,5/(3а + 14n) = 0,15/n а = 12n
n = 1 а = 12 — (углерод не является металлом)
n = 2 а = 24 Mg, Mg3N2 – нитрид магния 2 балла
n = 3 а = 36 —
0,6 моль 0,225 моль 0,15 моль 1 балл
Mg3N2 + 8HNO3 = 3Mg(NO3)2 + 2NH4NO3
1 моль 8 моль 3 моль 2 моль
148 г/моль 80г/моль
m(р-ра) = 7,5г + 132,1 мл ∙ 1,145г/мл = 158,7545г 1 балл
ω%(Mg(NO3)2) = (0,225моль ∙ 148г/моль / 158,7545г) ∙ 100% = 20,98% 1 балл
ω%( NH4NO3) = (0,15моль ∙ 80г/моль / 158,7545г) ∙ 100% = 7,56% 1 балл
7. Смесь кальция и карбоната кальция прокалили на воздухе до постоянной массы. Вычислите массовые доли компонентов в исходной смеси, если известно, что масса исходной смеси равна массе твердых продуктов реакций. (6 баллов)
х моль х моль
2Са + О2 = 2СаО 1 балл
2 моль 2 моль
40 г/моль 56 г/моль
у моль у моль
СаСО3 = СаО + СО2 1 балл
1 моль 1 моль
100 г/моль 56 г/моль
40х + 100у = 56х + 56у 1 балл
16х = 44у х = 2,75у 1 балл
ω%(Ca) = (40x /(40x+100y)) ∙ 100% = (40 ∙ 2,75y /(40 ∙ 2,75y + 100y)) ∙ 100% = 52,38% 1 балл
%(СаСО3) = (100y /(100y + 40 ∙ 2,75y)) ∙ 100% = 47,62% 1 балл
