
- •1Історія виникнення колоїдної хімії як самостійної науки
- •3.Загальна характеристика колоїдних розчинів
- •4 Класифікацій поверхневих явищ
- •5.Основні положення явища адсорбції. Дати визначення овновним поняттям.
- •10.Основні положення теорії полімолекулярної адсорбції Поляні та бет
- •14.Капілярна конденсація
- •15. Природа поверхневого натягу.
- •16.Адсорбіяна межі розподілу рідини-газ. Застосування зміни вільної енергії Гіббса для характеристики поверхневих явищ
- •17. Охарактеризувати три варіанти залежності поверхневого натягу від концентрації розчину та три типи ізотерм адсорбції Гіббса
- •18. Характеристика пар, будова молекул пар. Поверхнева активність, правило Дюкло-Траубе. Будова газоподібних та конденсованих плівок.
- •21. Практичне використання адсорбції
- •23. Особливості іноннообмінної адсорбції.
- •25. Характеристика явища замочування
- •27. Характеристика явищ капілярного підняття або просочування їх значення для харчових технологій.
17. Охарактеризувати три варіанти залежності поверхневого натягу від концентрації розчину та три типи ізотерм адсорбції Гіббса
Залежність поверхневого натягу від концентрації називається ізотермою поверхневого натягу. Оскільки аналітичного вигляду таких ізотерм не існує то за допомогою відповідних приладів і методик вимірюють поверхневий натяг розчинів різних концентрацій і будують графік ізотерми поверхневого натягу.
 Типові
залежності поверхневого натягу від
концентрації розчину для речовин, що
характеризуються різним впливом на
поверхневий шар.
Типові
залежності поверхневого натягу від
концентрації розчину для речовин, що
характеризуються різним впливом на
поверхневий шар.
 До
1-готипу відносяться речовини , збільшення
концентрації яких зменшують поверхневий
натяг розчину( криві 1,2). Такі речовини
отримали назву поверхнево активні
речовини(ПАР). По своїй здатності
зменшувати поверхневий натяг вони
можуть бути більш активні (2) менш активні
(1). До другого класу речовин відносять
такі, що при збільшенні концентрації
збільшують поверхневий натяг розчинів.
Такі речовини називаються поверхнево
інактивні речовини (ПІР)
До
1-готипу відносяться речовини , збільшення
концентрації яких зменшують поверхневий
натяг розчину( криві 1,2). Такі речовини
отримали назву поверхнево активні
речовини(ПАР). По своїй здатності
зменшувати поверхневий натяг вони
можуть бути більш активні (2) менш активні
(1). До другого класу речовин відносять
такі, що при збільшенні концентрації
збільшують поверхневий натяг розчинів.
Такі речовини називаються поверхнево
інактивні речовини (ПІР)
Д
4
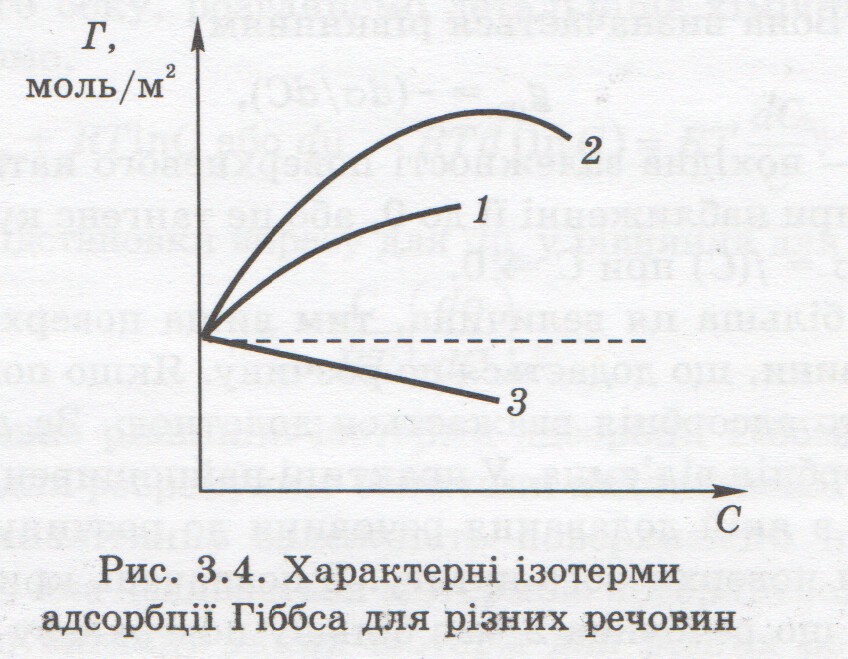
о особого класу відносяться речовини , які не залежать від концентрації , не змінюючи поверхневий натяг розчинів – поверхнево нон активні речовини. Використовуючи ізотерму поверхневого натягу Ленгмюра будують ізотерми адсорбції , які мають вигляд:
Величина адсорбції Г визначаються кількістю молів речовини на одиниці поверхні ( моль/ ).
Чим
більш активна речовина тим більша буде
адсорбція(2 1)
. Молекули ПІР(3) не адсорбуються на меж
поділу фаз і збільшується їх концентрація
, зростає їх кількість в об’ємі фази,
тому збільшується поверхневий натяг(3)
на ізотермі поверхневого натягу, та
спостерігається від’ємна адсорбція.
Для особливих молекул(4) зі збільшенням
концентрації Г не змінюється.
1)
. Молекули ПІР(3) не адсорбуються на меж
поділу фаз і збільшується їх концентрація
, зростає їх кількість в об’ємі фази,
тому збільшується поверхневий натяг(3)
на ізотермі поверхневого натягу, та
спостерігається від’ємна адсорбція.
Для особливих молекул(4) зі збільшенням
концентрації Г не змінюється.
18. Характеристика пар, будова молекул пар. Поверхнева активність, правило Дюкло-Траубе. Будова газоподібних та конденсованих плівок.
Речовини, що спричиняють сильне зниження поверхневого натягу розчинів, називаються поверхнево-активними речовинами(ПАР) Характерною особливістю є те , що молекулярні взаємодії між молекулами ПАР значно сильніші ніж між молекулами ПАР і розчинника.
М
Неполярний радикал
олекула ПАР побудована з двох частин: полярної групи та неполярного радикала. Полярна або гідрофільна група має великий дипольний момент і добре гідратована у розчині, що зумовлює високу спорідненість ПАР з водою. Вуглеводний або гідрофобний радикал є чинником низької розчинності ПАР у воді. Цей радикал начебто виштовхується з води. Наяскравішим прикладом молекули ПАР є структура молекул жирних кислот, зокрема оцтової.С
 хематично
вони зображуються позначками :
хематично
вони зображуються позначками :
Я
Полярна група
к встановили вчені П.Дюкло та І. Траубе,
поверхнева активність молекул ПАР дуже залежить від довжини вуглеводневого радикала. Детальне вивчення поверхневої активності гомологічного ряду насичених жирних кислот привело до висновку, що вона збільшується у 3,2 рази при додаванні однієї етичної групи СН2 до молекули ПАР. Це так зване правило Дюкло-Траубе: якщо довжина ланцюга жирної кислоти зростає в арифметичній прогресії, то її поверхнева активність збільшується у геометричній прогресії.
Г азоподібні плівки утворюються за адсорбції дуже малих кількостей ПАР. У цьому разі молекули ПАР розміщуються у поверхневому шарі на далекій відстані одна від одної та рухаються практично незалежно. Взаємодії між молекулами ПАР тут дуже слабкі. Тому цей адсорбційний шар вважається газоподібним і має двовимірну структуру:



Газоподібні плівки утворюють жирні кислоти з кількістю вуглецевих атомів
у ланцюзі не менше як 12, але не більше як 20-22, а також аліфатичні спирти та аміни з не дуже великою молекулярною масою.
Якщо сили взаємодії між молекулами ПАР дуже зростають, то вони утворюють між собою асоціати, тобто ці молекули, так би мовити «злипаються». При цьому утворюються конденсовані «острови» на поверхні води, в яких тепловий рух молекул обмежений.



Конденсовані плівки утворюють поверхнево активні речовини, молекули яких мають довгі ланцюги. Якщо довжина молекули перевищує 20-24 вуглецевих атомів, такі плівки розглядаються як твердо подібні.
19.Характеристика молекулярної адсорбції з розчинів. Ізотерма Фрейдліха та визначення сталих адсорбції
Молекулярна адсорбція – адсорбція неелектролітів , коли речовина адсорбується у молекулярному стані.
Для визначення кількості адсорбованої на поверхні твердого тіла речовини «Г» вимірюють молярну концентрацію розчину певного об’єму V до та після його контакту (С0 і С) з певною масою адсорбенту m, моль/г, і використовують рівняння:

Для опису залежності величини адсорбції від концентрації розчину рівняння Гіббса та Ленгмюра використовуються в обмежених кількостях, коли мала концентрація розчину. Тому використовують емпіричне рівняння ізотерми Фрейндліха:

K,n – сталі, що визначаються властивостями адсорбента
Для визначення сталих Фрейндліх запропонував:

Отримаємо рівняння прямої
Lg Г/m

α
Lg α = 1/n
Lg k
20.Залежність молекулярної адсорбції від мольної частки адсорбтиву. Правило Ребіндера.
 Залежність
адсорбції від мольної частки адсорбтиву
має два типи :
Залежність
адсорбції від мольної частки адсорбтиву
має два типи :
У першому випадку(крива 1) спостерігається різке зростання концентрації розчиненої речовини у поверхневому шарі і за певних концентрацій настає насичення. У разі подальшого збільшення концентрації розчину адсорбція вже не зростає. На гіббсівських кривих(крива 3) це відображається як різке збільшення надлишкової адсорбції за малих концентрацій розчину.
У другому випадку спостерігається s-подібна крива залежності концентрацій Cs =f(N) , а відповідна їй гіббсівська ізотерма адсорбції переходить у від’ємну область концентрацій (4). Точкою перетину кривої Cs =f(N)з прямою відповідає нульовій надлишкової адсорбції, оскільки за цієї концентрації розчину немає різниці між концентраціями в об’ємі та на поверхні. Таке явище називається адсорбційною азеотропією, коли адсорбент вже не може розділяти суміші.
Ребіндер вивів правило вирівнювання полярностей : процес адсорбції проходить у бік вирівнювання полярностей контактуючих фаз, причому тим сильніше, чим більша початкова різниця полярностей. Узагальнюючи правило Ребіндера : речовина С може адсорбуватися на поверхні розділу фаз А та В у тому разі, якщо наявність речовини С у поверхневому шарі буде проводити до вирівнювання різниці полярностей цих фаз. Правило вирівнювання полярностей діє також і для адсорбції на межі розділення рідина-газ.
