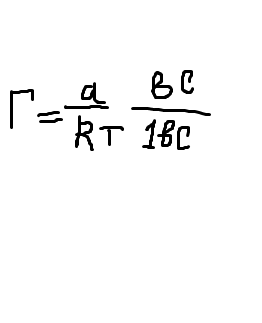- •1Історія виникнення колоїдної хімії як самостійної науки
- •3.Загальна характеристика колоїдних розчинів
- •4 Класифікацій поверхневих явищ
- •5.Основні положення явища адсорбції. Дати визначення овновним поняттям.
- •10.Основні положення теорії полімолекулярної адсорбції Поляні та бет
- •14.Капілярна конденсація
- •15. Природа поверхневого натягу.
- •16.Адсорбіяна межі розподілу рідини-газ. Застосування зміни вільної енергії Гіббса для характеристики поверхневих явищ
- •17. Охарактеризувати три варіанти залежності поверхневого натягу від концентрації розчину та три типи ізотерм адсорбції Гіббса
- •18. Характеристика пар, будова молекул пар. Поверхнева активність, правило Дюкло-Траубе. Будова газоподібних та конденсованих плівок.
- •21. Практичне використання адсорбції
- •23. Особливості іноннообмінної адсорбції.
- •25. Характеристика явища замочування
- •27. Характеристика явищ капілярного підняття або просочування їх значення для харчових технологій.
16.Адсорбіяна межі розподілу рідини-газ. Застосування зміни вільної енергії Гіббса для характеристики поверхневих явищ
Адсорбцією називається процес самодовільної зміни концентрації компонента уповерхневому шарі, порівняно із об'ємом фази. Речовину, на поверхні якої проходить адсорбція, називають адсорбентом. Речовину, концентрація якої змінюється у поверхневому шарі, називають адсорбтивом (іноді адсорбатом). Причиною адсорбції є здатність розчинених речовин змінювати поверхневий натяг розчинника. Склад поверхневого шару чистої рідини (розчинника) не відрізняється від складу об'єму рідини. Розчинення речовини, яка має поверхневий натяг σ, відмінний від поверхневого натягу розчинника σ0, приводить до зміни складу поверхневого шару. По мірі збільшення концентрації поверхнево-активної речовини (ПАР) поверхневий натяг розчинів зменшується, тобто знижується вільна енергія поверхневого шару. Таким чином, молекули ПАР самодовільно накопичуються на поверхні поділу фаз в надлишковій, в порівнянні з об'ємом, кількості, тобто відбувається позитивна адсорбція: Г > 0. По відношенню до межі поділу вода (полярний розчинник) — повітря, поверхнево-активними речовинами є органічні речовини, які мають дифільну будову молекули, наприклад жирні кислоти, спирти, кетони, мила та ін. Вони містять в своєму складі неполярну частину — зокрема, вуглеводневий радикал і полярну частину, представлену функціональними групами —COOH, —OH, -NH2, -SO2OH і т.д. Вуглеводневі ланцюги гідрофобні, причому чим довший ланцюг, тим сильніше виражені гідрофобні властивості молекули ПАР, тим сильніше виштовхується вона на поверхню і тим більше молекул накопичується в поверхневому шарі. Полярні групи, споріднені з водою (гідрофільні), гідратуються і зумовлюють задовільну розчинність ПАР у воді.
Для розрахунку ізотерми адсорбції Г = f(с) необхідно
знати залежність поверхневого
натягу від концентрації розчиненої речовини. Схема
графічного розрахунку показана на рис
. “Ізотерми поверхневого натягу (1) і адсорбції (2)”
В декількох точках кривої , що відповідають
різним концентраціям, проводять дотичні і визначають
тангенси кута нахилу їх до осі абсцис у, які дорівнюють
з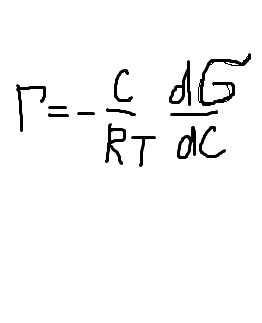 наченням
похідних d/
dс
в даних точках.
наченням
похідних d/
dс
в даних точках.
Підставляючи їх у рівняння Гіббса:
одержують відповідно величини Г1, Г2,….., за якими будують ізотерму адсорбції Г =f(с).
Залежність = f(с) можна побудувати за експериментальними значеннями поверхневого
натягу водних розчинів при різних концентраціях ПАР. Можна також скористатися емпіричним
рівнянням Б. А. Шишковського:
o - = = a ln(1+bC)
Причому значення B мало залежить від природи ПАР і є єдиним для всього гомологічного
ряду, а A називається питомою капілярною сталою, яка має певне значення для кожного члена гомологічного ряду. Рівняння Шишковського застосовують для обчислення поверхневого натягу жирних кислот(або інших ПАР) з невеликим числом атомів вуглецю (до С8).За допомогою рівняння Шишковського можна перейти від рівняння Гіббса до рівняння
Ленгмюра. Якщо продиференціювати рівняння Шишковського за концентрацією:
d/ dc = ab / (1+bc)
і підставити похідну в рівняння Гіббса , то одержимо: