
- •1Історія виникнення колоїдної хімії як самостійної науки
- •3.Загальна характеристика колоїдних розчинів
- •4 Класифікацій поверхневих явищ
- •5.Основні положення явища адсорбції. Дати визначення овновним поняттям.
- •10.Основні положення теорії полімолекулярної адсорбції Поляні та бет
- •14.Капілярна конденсація
- •15. Природа поверхневого натягу.
- •16.Адсорбіяна межі розподілу рідини-газ. Застосування зміни вільної енергії Гіббса для характеристики поверхневих явищ
- •17. Охарактеризувати три варіанти залежності поверхневого натягу від концентрації розчину та три типи ізотерм адсорбції Гіббса
- •18. Характеристика пар, будова молекул пар. Поверхнева активність, правило Дюкло-Траубе. Будова газоподібних та конденсованих плівок.
- •21. Практичне використання адсорбції
- •23. Особливості іноннообмінної адсорбції.
- •25. Характеристика явища замочування
- •27. Характеристика явищ капілярного підняття або просочування їх значення для харчових технологій.
10.Основні положення теорії полімолекулярної адсорбції Поляні та бет
Основні положення теорії полі молекулярної адсорбції Поляні
Адсорбція визначається чисто фізичними силами і є оборотним рівноважним процесом.
На поверхні адсорбенту немає окремих адсорбційних центрів. Адсорбція відбувається в безперервному потенційному полі поверхні, тобто маємо нелокалізовану адсорбцію.
Адсорбційні сили діють на значній відстані від поверхні, значно більшій, ніж розміри адсорбованих молекул.
Дія адсорбційних сил зменшується з віддаленням від поверхні і на деякій відстані зникає зовсім.
На притягування даної молекули до поверхні адсорбенту не впливають інші молекули, що також адсорбуються.
Адсорбційні сили не залежать від температури, тобто не змінюється адсорбційний об'єм.
У 1935—1940 рр. учені Б. Брунауер, К. Еммет та М. Тей-лор (БЕТ) узагальнили теорії Дж. Ленгмюра та М. Поляні і запропонували так звану теорію БЕТ, що ґрунтується на таких положеннях:
На поверхні адсорбенту є певна кількість рівноцінних в енергетичному відношенні активних центрів, що утримують молекули адсорбтиву.
Взаємодією сусідніх молекул нехтують.
Кожна молекула наступного шару є своєрідним центром адсорбції.
Припускається, що статистична сума станів молекул у різних шарах така сама, як і в рідкому стані. Тобто хаотичність розміщення молекул в адсорбційному шарі така сама, як і у рідині.
На основі цих припущень автори БЕТ вивели рівняння ізотерми адсорбції:

Для практичних цілей це рівняння легко привести до лінійної форми:

Як
і у випадку ізотерми Ленгмюра, за нахилом
прямої визначають
і
К. Обробка експериментальних результатів
із використанням рівняння БЕТ дає
точніші дані про питому поверхню
визначають
і
К. Обробка експериментальних результатів
із використанням рівняння БЕТ дає
точніші дані про питому поверхню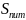 адсорбенту,
а аналіз константи К — про енергетику
адсорбції.
адсорбенту,
а аналіз константи К — про енергетику
адсорбції.
11. Типи ізотерм адсорбції
Х арактер
взаємодії адсорбованих молекул із
поверхневею твердого тіла визначає
форму ізотерм адсорбції. За цією ознакою
вони поділяються на п’ять типів
(малюнок).
арактер
взаємодії адсорбованих молекул із
поверхневею твердого тіла визначає
форму ізотерм адсорбції. За цією ознакою
вони поділяються на п’ять типів
(малюнок).
Перший тип характерний для хімічної адсорбції з утворенням мономолекулярного шару. У чистому вигляді він зустрічається результаті взаємодії барвника з активним вугіллям.Другий тип найпоширеніший і належить до адсорбції з утворенням полімолекулярних шарів. Ізотерма типу 3 описує процеси, що відбуваються на поверхні з відносно слабкою адсорбційною здатністю. Ізотерми типу 4 й 5 характерні для складніших процесів адсорбції, що відбуваються в пористих адсорбентах з утворенням полімолекулярних шарів. Так, ізотерму типу 4 отримують під час адсорбції водяних парів шаруватими силікатами, в яких у процесі адсорбції відбувається розширення кристалічної ґратки з утворенням міжшарового простору.
12. Інтегральна та диференційна теплота адсорбції, їх залежність від кількості адсорбтиву.
Розрізняють два способи відображення теплоти адсорбції: інтегральний та диференційний.
Інтегральна теплота адсорбції – це загальна кількість теплоти Q ,що відображається під час адсорбції, віднесена до 1 г адсорбенту q=Q\m, де m- маса адсорбенту.
О скільки
на поверхні адсорбенту активні центри
адсорбції нерівноцінні, тобто поверхня
енергетично неоднорідна, залежність q
від кількості адсорбтиву нелінійна.
скільки
на поверхні адсорбенту активні центри
адсорбції нерівноцінні, тобто поверхня
енергетично неоднорідна, залежність q
від кількості адсорбтиву нелінійна.
На початку адсорбції адсорбовані молекули взаємодіють з найактивнішими поверхневими центрами, при цьому виділяється найбільша кількість теплоти. Якщо величина адсорбції більша, в дію вступають менш активні центри, внаслідок чого виділення теплоти зменшується. Цим пояснюється відхилення від лінійності на залежності q=f(m), що спостерігається в експерименті мал 1.
Якщо до певного часу деяка кількість речовини вже адсорбувалася на поверхні і при цьому виділилася відповідна кількість теплоти, то адсорбція наступних dn молей речовини приведедо виділення додаткових δQ джоулів теплоти при тій самій температурі. Відношення додатково виділеної теплоти до додатково адсорбованої кількості речовини, Дж/моль,δQ/dn=qє диференційною теплотою адсорбції.
Диференційною називається теплота, що виділилася за додаткової адсорбції малої кількості адсорбтиву, перерахована на моль. Типовий графік зміни диференційної теплоти адсорбції від кількості адсорбтиву показано на рис. 2. Видно, що за малих насичень поверхні адсорбенту діють найактивніші центри адсорбції, внаслідок чого виділяється максимальна кількість теплоти. У разі повного насичення поверхні виділення теплоти припиняється. Це явище можна використовувати для визначення кількості адсорбованої речовини.
13. Швидкість адсорбції. Характеристика її кінетичних кривих.
Швидкість адсорбції залежить від характеру взаємодії адсорбат-адсорбент, геометрії та форми пор останніх та інших факторів. На непористих адсорбентах швидкість адсорбції дуже висока. Рівноважний стан тут досягається за 10-20 с. Майже 95% речовини адсорбується за 1-2 с. У пористих сорбентах адсорбція значно повільніша внаслідок загальмованої дифузії газів у тонких порах,ймовірності хемосорбції та можливої наявності на поверхні адсорбенту поглиненого повітря або води. Характер кінетичних кривих можна описати рівнянням:
dГ/dτ
= k(
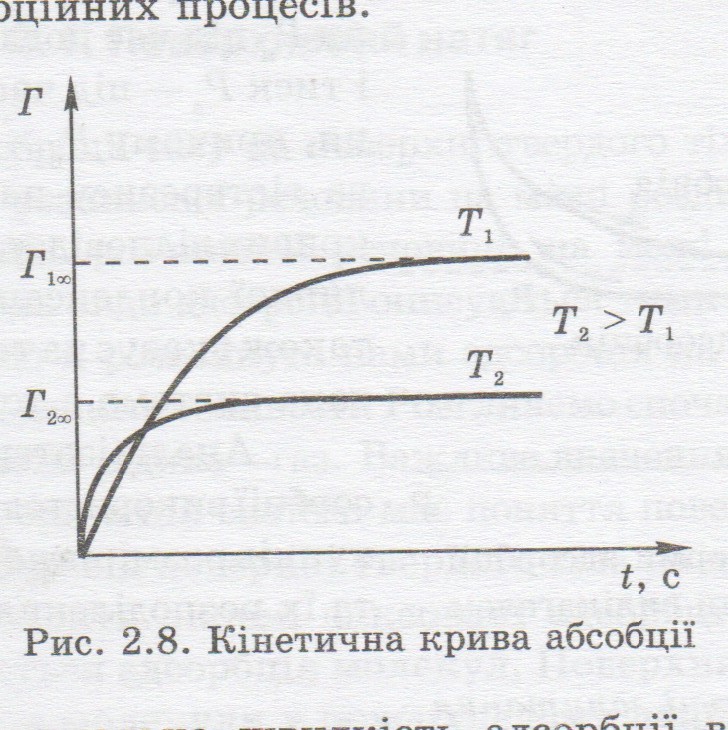
З графіка видно, що з підвищенням температури швидкість адсорбції зростає, тобто прискорюється зрівноважування у системі. При цьому максимальна кількість адсорбованої речовини зменшується , що пояснюється підвищенням інтенсивності десорбцій них процесів. Експериментально швидкість адсорбції визначають за допомогою терезів Мак-Бена.
