
- •1Історія виникнення колоїдної хімії як самостійної науки
- •3.Загальна характеристика колоїдних розчинів
- •4 Класифікацій поверхневих явищ
- •5.Основні положення явища адсорбції. Дати визначення овновним поняттям.
- •10.Основні положення теорії полімолекулярної адсорбції Поляні та бет
- •14.Капілярна конденсація
- •15. Природа поверхневого натягу.
- •16.Адсорбіяна межі розподілу рідини-газ. Застосування зміни вільної енергії Гіббса для характеристики поверхневих явищ
- •17. Охарактеризувати три варіанти залежності поверхневого натягу від концентрації розчину та три типи ізотерм адсорбції Гіббса
- •18. Характеристика пар, будова молекул пар. Поверхнева активність, правило Дюкло-Траубе. Будова газоподібних та конденсованих плівок.
- •21. Практичне використання адсорбції
- •23. Особливості іноннообмінної адсорбції.
- •25. Характеристика явища замочування
- •27. Характеристика явищ капілярного підняття або просочування їх значення для харчових технологій.
5.Основні положення явища адсорбції. Дати визначення овновним поняттям.
Адсо́рбція (від лат. ad — на, при і лат. sorbeo — поглинаю) — вибіркове поглинання речовини з газового чи рідкого середовища поверхневим шаром твердого тіла (адсорбенту) чи рідини. Компонент, що поглинається, який вміщується в суцільному середовищі (газі, рідині), називають адсорбтивом, а той що вміщується в адсорбенті — адсорбатом. Наприклад,активоване вугілля адсорбує гази. Це явище треба відрізняти від абсорбції.
Абсорбція (рос. абсорбция, англ. absorption, нім. Absorption f, Absorbieren f, Aufsaugen f, Einsaugen f, Aufnahme f) — вибіркове поглинання речовини з газового чи рідкого середовища усім об'ємом твердого тіла чи рідини. Наприклад рідини — твердою речовиною (чорнила — промокальним папером) чи газу — рідиною (аміаку — водою).
Десо́рбція (рос. десорбция; англ. desorption; нім. Desorption f)- процес видалення адсорбованої (адсорбату) або абсорбованої (абсорбату) речовини з поверхні адсорбенту або із об'єму абсорбенту. Протилежне — сорбція, адсорбція або абсорбція.
Адсорбенти - високодисперсні природні або штучні матеріали з великою питомою поверхнею, на якій відбувається адсорбція речовин з дотичних з нею газів або рідин. Адсорбенти застосовують в протигазах, в якості носіїв каталізаторів, для очищення газів, спиртів, масел, для поділу спиртів, при переробці нафти, в медицині для поглинання газів і отрут.
6.Характеристика різниці між фізичною і хімічною адсорбцією
Розрізняють фізичну адсорбцію і хемосорбцію.
Фізична адсорбція зумовлена ван-дер-ваальсовими, або електростатичними, силами притягання частинок адсорбованої речовини до частинок адсорбенту.
При хемосорбції молекули поглинутої речовини вступають у хімічну реакцію з молекулами адсорбенту.
Оборотність процесу фізичної адсорбції створює сприятливі умови для послідовного проведення процесів адсорбції (поглинання речовини адсорбентом) та десорбції (вилучення з адсорбенту поглиненої речовини). Адсорбція широко застосовується в адсорбційній техніці, лежить в основі очистки, розділення газів та рідин тощо.
7. Характеристика природи адсорбційних сил
Взаємодія адсорбованих молекул з поверхнею адсорбенту під час фізичної адсорбції зумовлена кількома чинниками. Найпростішою є взаємодія неполярної молекули з неполярним адсорбентом за рахунок дисперсійних сил притягання та сил відштовхування. Потенціал U, що враховуючи таку взаємодію, можна зобразити рівнянням Леннарда-Джонса
U= -Cr-3 + Br-6
де r-відстань між центрами частинок; С-стала сил дисперсійного притягання; В - стала сил відштовхування.
Три складових сталої С (у загальному вигляді) описують відповідно взаємодію двох диполів, або так звану диполь-дипольну орієнтаційну взаємодію, диполя з неполярною молекулою, або індуктивну взаємодію, та так звану дисперсійну взаємодію двох неполярних молекул. Дисперсійні взаємодії зумовлені притяганням між диполями, що виникають флуктуаційно в одній молекулі, та наведеним ним дипольним моментом другої молекули. Розрахунки доводять, що внесок орієнтаційної взаємодії в загальну взаємодію молекул перебувають у межах від 0 — для неполярних молекул до 50 % та більше — для молекул з великим дипольним моментом; індукційна взаємодія не перевищує 5... 10 %. Дисперсійна взаємодія становить понад половину всієї енергії притягування, наближаючись до 100 % для неполярних вуглеводнів.
Аналіз рівняння Леннарда—Джонса показує, що на великих відстанях між частинками переважають сили притягання, а на малих — відштовхування. На деякій відстані ці сили врівноважуються, що відповідає мінімуму вільної енергії системи.
У процесі адсорбції на поверхні адсорбенту адсорбована молекула взаємодіє з кількома атомами чи молекулами поверхні. Підсумковий потенціал адсорбційних сил буде дорівнювати сумі парних взаємодій абсорбованої молекули з усіма ближчими на поверхні атомами і молекулами. Це значно ускладнює теоретичні розрахунки, але ЕОМ дають можливість легко вирішити ці питання.
У процесі адсорбції неполярних і полярних молекул на полярних адсорбентах треба враховувати також дії електростатичних сил, що мають природу індукційних та орієнтаційних взаємодій. Це передусім енергія кулонівського притягання між поверхневими зарядами та адсорбтивом, диполь-дипольні взаємодії між зарядженими частинками та поляризованими поверхневими ділянками тощо.
Окремий клас взаємодій, характерних для адсорбційних явищ у харчових виробництвах, — це водневі зв’язки. Вони виникають під час адсорбції молекул на адсорбентах, що мають поверхневі гідроксильні, карбоксильні або амінні групи.
Частіше енергія електричних взаємодій значно менша за енергію дисперсійних. Енергія міжмолекулярного притягання визначається в основному дисперсійними взаємодіями. Але для такої полярної речовини, як вода, основний внесок в енергію міжмолекулярних взаємодій дають водневі та дипольні взаємодії (70 %), а на частку дисперсійних залишається десь 30 %.
8.Характеристика типів адсорбції
Залежно від агрегатного стану адсорбента та адсорбтиву розрізняють 4-ри типи адсорбціії: адсорбцію газу на поверхні твердого тіла, розчиненої речовини на межі розділення розчин — газ, адсорбцію розчиненої речовини на межі тверде тіло — розчин. Можна також виділити окремий тип адсорбції розчиненої речовини на межі розділення рідина — рідина(наприклад, адсорбція ПАР як стабілізатор або емульгатор в емульсіях).
9.Адсорбція на межі розділення тверде тіло—газ. Основні положення теорії Ленгмюра. Методи визначення ємності моно шару.
Це найпоширеніший у природі й техніці тип адсорбції. Теоретичні уявлення, що були розвинуті в цьому напрямку, використовуються і для опису та розуміння процесів адсорбції, що відбуваються в складніших системах.
Теоретичні основи процесів адсорбції газів на поверхні твердого тіла заклав Джозайм Ленгмюр. Описуючи ізотерми адсорбції, він зробив ряд припущень:
Швидкість адсорбції Vа дорівнює швидкості десорбції V , яка пропорційна кількості зіткнень з тією частиною поверхні, що не зайнята адсорбованими молекулами.
Адсорбційні сили діють тільки на коротких відстанях і повністю екрануються адсорбованими молекулами, тобто адсорбція можлива тільки в моношарі.
Адсорбовані молекули не взаємодіють між собою. Відбувається локалізована адсорбція, в якій кожний адсорбційний центр взаємодіє тільки з одною адсорбованою молекулою і ці молекули не переміщуються по поверхні.
Адсорбційні центри енергетично еквівалентні, тобто поверхня адсорбенту еквіпотенціальна.
Позначимо 0 як частку поверхні, зайнятої адсорбованими молекулами, тоді 1—0 — частка незайнятої поверхні. Згідно із законом діючих мас швидкість адсорбції молекул на одиниці поверхні дорівнює
 ,
,
Аналогічно
швидкість десорбції пропорційна площі
поверхні, вже зайнятої адсорбованими
молекулами, тобто

За
умови рівноваги швидкість процесу адсорбції дорівнює
швидкості процесу десорбції або
швидкість процесу адсорбції дорівнює
швидкості процесу десорбції або

Введемо
нову константу: К =
 — стала адсорбційно-десорбційної
рівноваги.
— стала адсорбційно-десорбційної
рівноваги.
Після підстановки К у формулу маємо:
 К(1-
)Р=КР-К
Р,
К(1-
)Р=КР-К
Р,

Це рівняння ізотерми адсорбції Ленгмюра, що встановлює зв'язок між тиском газу над поверхнею адсорбенту та величиною площі поверхні, зайнятої адсорбованими молекулами. Але у такому вигляді воно не може бути використано на практиці, оскільки не існує методів індикації зайнятої чи незайнятої адсорбованими молекулами площі поверхні дисперсних частинок. Тому виконаємо такі перетворення:
А
Рис 1
= 1/К та θ = Г/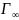 ,
,
П ісля
підстановки цих параметрів у рівняння
отримаємо:
ісля
підстановки цих параметрів у рівняння
отримаємо:
 або
або

Зв'язок між кількістю адсорбованої на поверхні твердого тіла речовини Г і тиском газу над поверхнею можна виміряти експериментально. Для мо-ношарової адсорбції залежність Г = f(Р) має вигляд, показаний на рис. 1.Зіставлення отриманої експериментальної ізотерми адсорбції з теоретичною залежністю дає змогу визначити сталі A та у рівнянні. Для практики залежність Г = Ї(Р)зручніше перебудувати в лінійних координатах Р/Г = = /(Р), поділивши Р на праву та ліву половини рівняння.
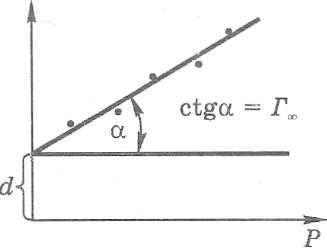
Рис 2
Вимірюючи котангенс кута нахилу прямої на рис. 2, отримаємо величину , тобто ємність моношару — кількість молекул адсорбтиву, необхідних для їх розміщення в один шар на одиничній поверхні розділення фаз. Відрізок на осі ординат сі, що перетинає ця пряма, дає значення параметра А.Розраховуючи таким чином з експериментальних даних величину , визначимо питому поверхню адсорбенту за рівнянням

