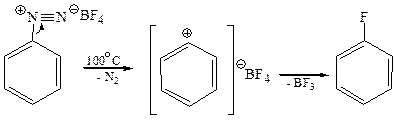- •Синтез бромистого этила
- •I Введение
- •1.1 Реакции галогенирования
- •1.2 Галогенирование алкенов.
- •1.3 Радикальное галогенирование
- •1.4 Присоединение галогеноводородов
- •1.6 Галогенирование алкинов.
- •1.7 Галогенирование ароматических углеводородов (бензола, нафталина).
- •1.8 Применяемые катализаторы и их роль
- •1.9 Непрямое галогенирование
- •1.11 Реакция Гаттермана
- •1.12 Замена диазогруппы на йод
- •1.6.Замещение карбонильного кислорода на галогены.
- •2.5 Таблица 2 - Посуда и приборы
- •III Расчет количеств исходных веществ, необходимых для синтеза
- •3.1 Расчет основных исходных веществ
- •3.2 Расчет количества вспомогательных веществ
- •IV Теоретический выход целевого продукта (в граммах).
- •V Ожидаемый выход целевого продукта (в граммах и в процентах от теоретического выхода).
- •VI Описание хода синтеза
- •VII Схемы приборов и установок
- •VIII Выделение и очистка сырого продукта
- •IX Практический выход бромистого этила
1.7 Галогенирование ароматических углеводородов (бензола, нафталина).
Бензол не взаимодействует с хлором или бромом в обычных условиях.Реакция может протекать только в присутствии катализаторов-безводных AlCl3,FeCl3,AlBr3.В результате реакции образуются галогенозамещённые арены.
Сl2+C6H6C6H5Cl+HCl
В реакции галогенирования нафталин вступает значительно легче бензола. При этом образуются в основном продукты замещения.
1.8 Применяемые катализаторы и их роль
Галогенирование (например, бромирование) бензола действием самого галогена протекает только в присутствии катализаторов, таких как ZnCl2, FeBr3, А1Вr3 и т. д. Катализаторами являются обычно кислоты Льюиса. Они вызывают некоторую поляризацию молекулы галогена, усиливая тем самым ее электрофильный характер, после чего такая поляризованная молекула атакует р-электроны ароматического кольца участком, несущим положительный заряд:
После расщепления связи бром -- бром образуется д-комплекс с бензолом, от которого возникающий отрицательно заряженный комплекс -Br*FeBr3 отрывает протон, давая бром-бензол.
В качестве галогенирующих средств могут применяться также водные растворы НО--Nal, разумеется, в присутствии сильных кислот. Имеются надежные доказательства того, что, например при хлорировании, хлорирующим агентом является ион Сl+, образующийся в результате реакций
Механизм взаимодействия ионов Cl+ с бензолом не отличается от механизма нитрования ионами NO2+. Сходство этих двух процессов подтверждается тем, что кислота НОCl сама по себе, так же как и НNO3 очень слабо взаимодействует с бензолом; как в том, так и в другом случае для высвобождения ионов Cl+ и NO2+ путем протонирвоания «молекул-носителей» требуются сильные кислоты:
Доказательства в пользу того, что замещающими агентами являются галоген-катионы или комплексы, содержащие поляризованный галоген, были получены при изучении реакций между межгалогенидными и ароматическими соединениями. Так, например, действие BrCl приводит только к бромированию, a ICl--только к иодированию, т. е. в молекулу ароматического соединения всегда вводится менее электроотрицательный галоген, который в исходной молекуле межгалогенидного соединения несет на себе частичный положительный заряд.
1.9 Непрямое галогенирование
Среди значительного числа методов непрямого введения галогена в органическое соединение наиболее простым является получение алкилгалогенидов из спиртов путём взаимодействия последних с галогеноводородными кислотами. Следует отметить,что в большинстве случаев используют не свободные кислоты ,а их соли,которые с серной кислотой в процессе реакции образуют соответствующие галогеноводороды.
При непрямом галогенировании применяют галогеноводородные кислоты и кислородсожержащие кислоты галогенов либо их соли со щелочными металлами.Для галогенирования кислородсодержащих органических соединений используют также галоген-прозводные фосфора(PC13,PBr3,PC15,PBrs,POC13),серы(SOC12,S02C12)
1.10 Замещение диазогруппы на фтор (реакция Шимана, 1927 г). Реакцию проводят термическим разложением твердого тетрофторобората арендиазония: