
- •Федеральное агенство по образованию Московская государственная академия тонкой химической технологии имени М.В. Ломоносова
- •Рекомендуемая литература
- •Введение
- •Химические частицы
- •Вещество
- •Формульные единицы
- •Обменные реакции в растворе
- •Уравнения реакций:
- •Составление уравнений
- •Классы неорганических веществ
- •Простые вещества
- •Диагональ амфотерности
- •Классификация простых соединений (по составу)
- •Классы неорганических соединений
- •Гидроксиды
- •Гидроксиды
- •Кислотные гидроксиды (кислородсодержащие кислоты)
- •Номенклатура кислородсодержащих кислот
- •Основные гидроксиды (основания)
- •Важнейшее химическое свойство кислотных и основных гидроксидов
- •Амфотерные гидроксиды
- •Оксиды
- •Соли
- •Бинарные соединения
- •Комплексные соединения
- •Комплексные соединения
- •Номенклатура комплексных соединений
- •Примеры
- •Окислительно- восстановительные реакции (ОВР)
- •Степень окисления
- •Степень окисления
- •Изменение степени окисления
- •Подбор коэффициентов в уравнениях ОВР Метод электронного баланса
- •Подбор коэффициентов в уравнениях ОВР Метод электронного баланса
- •Подбор коэффициентов в уравнениях ОВР Метод электронно-ионных полуреакций
- •Подбор числа атомов водорода и кислорода
- •Типы ОВР
- •Типы ОВР
- •Типичные окислители и восстановители
- •Влияние среды
- •Направление ОВР
- •Электродный потенциал φ
- •Разность потенциалов Δφ
- •Стандартный водородный электрод
- •Стандартный потенциал полуреакции восстановления φ°
- •Сравнение φ°
- •Критерий протекания ОВР
- •Уравнение Нернста
- •Критерий полноты протекания ОВР
- •Пример
- •Кинетические затруднения
- •Пример
- •Диаграмма Латимера
- •Диаграмма Латимера
- •Зависимость φ° от среды
- •Зависимость φ° от среды
- •Стехиометрические расчеты по уравнению реакции
- •Стехиометрические расчеты по уравнению реакции
- •Задача
- •Задача
- •Стехиометрические расчеты по закону эквивалентов
- •Основные соотношения
- •Задача (решение по закону эквивалентов)
- •Задача (решение по закону эквивалентов)
- •Химическое равновесие
- •Химические реакции
- •Система
- •Системы
- •Равновесное состояние
- •Химическое равновесие
- •Признаки истинного химического равновесия
- •Закон действующих масс
- •Закон действующих масс (гомогенные системы)
- •Закон действующих масс (гетерогенные системы)
- •Константы гетерогенных равновесий
- •Константа равновесия
- •Сложные химические реакции
- •Сложные химические реакции
- •Задача
- •Задача
- •Задача
- •Задача
- •Сдвиг химического равновесия
- •Влияние температуры
- •Влияние температуры
- •Влияние концентрации
- •Влияние концентрации
- •Влияние давления
- •Влияние давления
- •Влияние давления
- •Введение инертного газа
- •Влияние катализатора
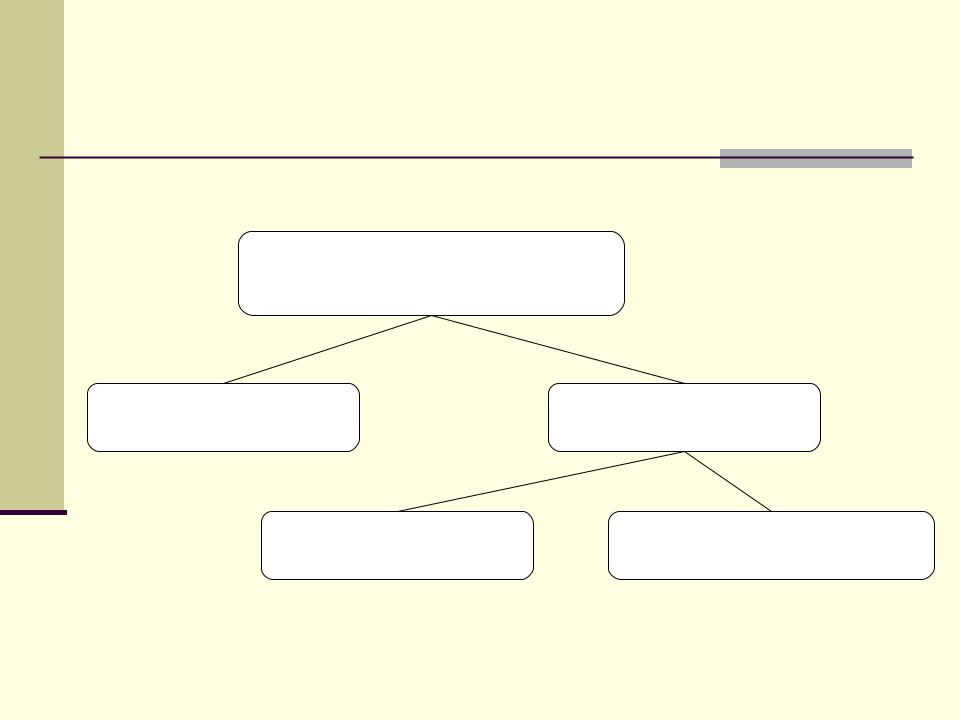
Классы неорганических веществ
Неорганические вещества
Простые вещества |
Сложные вещества |
|
(соединения) |
||
|
Простые соединения |
Сложные (комплексные) |
|
соединения |
||
|
11

Простые вещества
Неметаллы
22, включая 6 благородных газов
Имеют высокие значения электроотрица- тельности (χ):
F 4,1; O 3,5; N 3,1
Образуют анионы
Металлы
11 типичных, остальные
– "амфотерные"
Имеют низкие значения электроотрицатель- ности (χ):
K 0,91; Li 0,97; Ca 1,04Образуют катионы
12

Диагональ амфотерности
|
Be |
Al |
Ge |
Sb |
Po |
χ |
1,47 |
1,47 |
2,02 |
1,82 |
1,76 |
(для А-групп)
В Б-группах все элементы проявляют амфотерные свойства
Входят в состав и катионов, и анионов
13

Классификация простых соединений (по составу)
основана на отношении
к кислороду
самый распространенный элемент на Земле
образует соединения со всеми элементами кроме He, Ne, Ar
к воде
самое распространенное соединение кислорода
14

Классы неорганических соединений
Оксиды ЭхО–IIу Na2O, CO2, ZnO
(OF2, H2O2 к оксидам не относятся)
Гидроксиды ЭхОу.nH2O
NaOH, H2CO3, Zn(OH)2Соли
Na2CO3, NaHCO3, Zn2CO3(OH)2Бинарные соединения NH3, OF2, CaC2
15
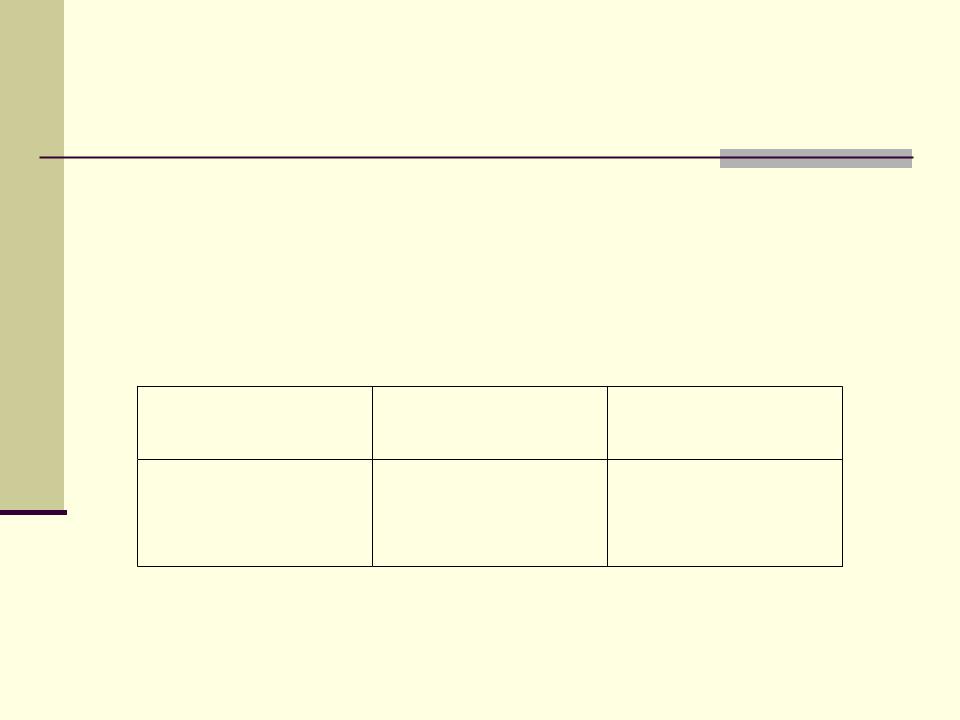
Гидроксиды
Э(ОН)n
образуют не все элементы
(SnO2.nH2O, SO2.nH2O и др.) Для n > 2:
орто-форма |
Э(ОН)3 |
Э(ОН)4 |
|
мета-форма |
ЭО(ОН) |
ЭО(ОН)2 |
|
(– H2O) |
НЭО2 |
Н ЭО |
3 |
|
|
2 |
|
16

Гидроксиды
Основные NaOH, Mg(OH)2
Амфотерные Pb(OH)2, AlO(OH)
Кислотные H2SO4, HNO3
17
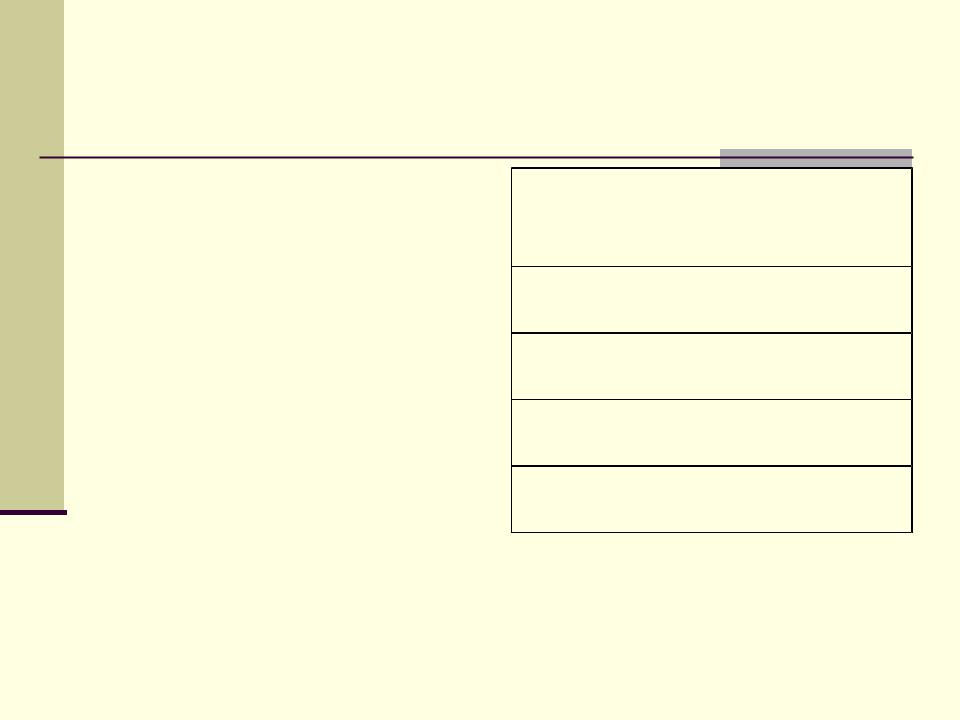
Кислотные гидроксиды (кислородсодержащие кислоты)
Большинство – |
Замещаемый |
Кислотный |
в мета-форме |
атом Н |
остаток |
|
|
|
|
H2 |
SO4 |
|
H NO3 |
|
|
H2 |
PHO3 |
|
B(OH)3 |
|
Не всегда Н замещается сразу: |
|
H3PO4 KH2PO4 K2HPO4 K3PO4 |
18 |

Номенклатура кислородсодержащих кислот
Традиционные
H2CO3 угольная кислота
CO32– карбонат
HCO3– гидрокарбонат и т.д.
Систематические
НхЭОу "у"-оксо-Э(лат.корень)-ат(с.о. или заряд) водорода
H2XeO4 тетраоксоксенонат(VI) водорода
H4I2O9 нонаоксодииодат(VII) водорода
H2S4O6 гексаокостетрасульфат(2–) водорода
19

Основные гидроксиды (основания)
Содержат гидроксидные группы, способные замещаться на кислотные остатки
Всегда в орто-форме
Номенклатура:
LiOH гидроксид лития
Cr(OH)2 гидроксид хрома(II)
20
