
- •Химия элементов. Лекция 8
- •Элементы IБ-группы
- •Элементы IБ- группы
- •Степени окисления
- •Примеры устойчивых соединений
- •Простые вещества
- •В ЭХРН: …H ... Cu …Ag …Au
- •Химическое растворение
- •Кислородные соединения Cu Ag, Au
- •CuCl CuF2
- •Распространение в природе и важнейшие минералы
- •Минералы
- •Получение меди
- •Загрузка печи
- •Добыча золота
- •Цианидный метод извлечения золота и серебра
- •Особенности химии меди
- •Гидроксид Cu(OH)2
- •Комплексные соединения
- •Окислительно-восстановительные свойства
- •Серебро
- •Серебро
Химия элементов. Лекция 8
Общая характеристика элементов IБ- группы. Медь. Серебро
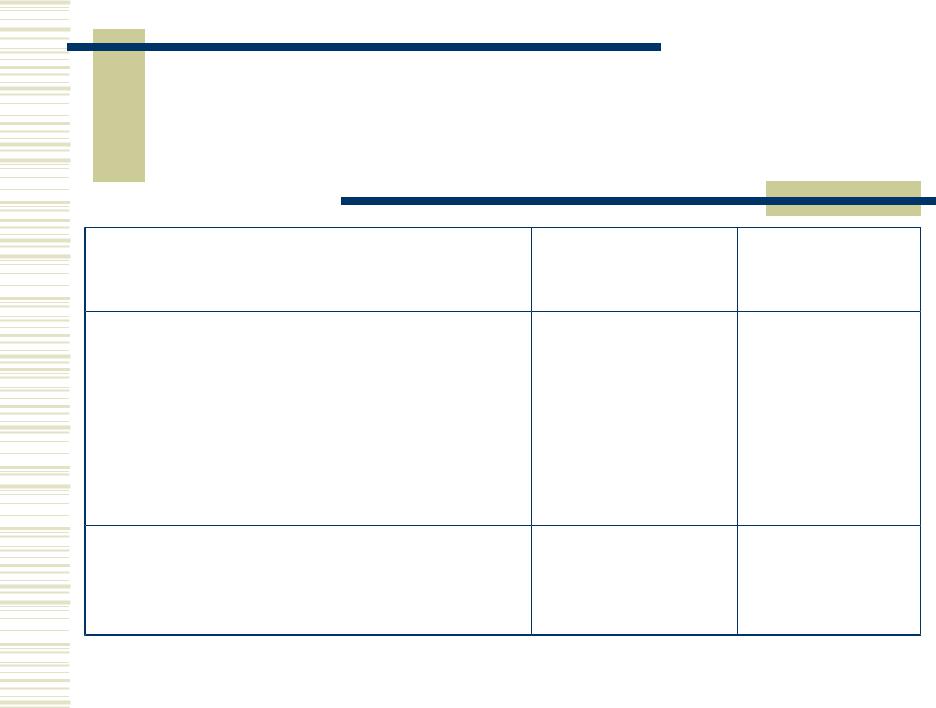
Элементы IБ-группы
Элемент |
Cu |
Ag |
Au |
z |
29 |
47 |
79 |
Ar |
63,6 |
107,9 |
197,0 |
|
1,75 |
1,42 |
1,42 |
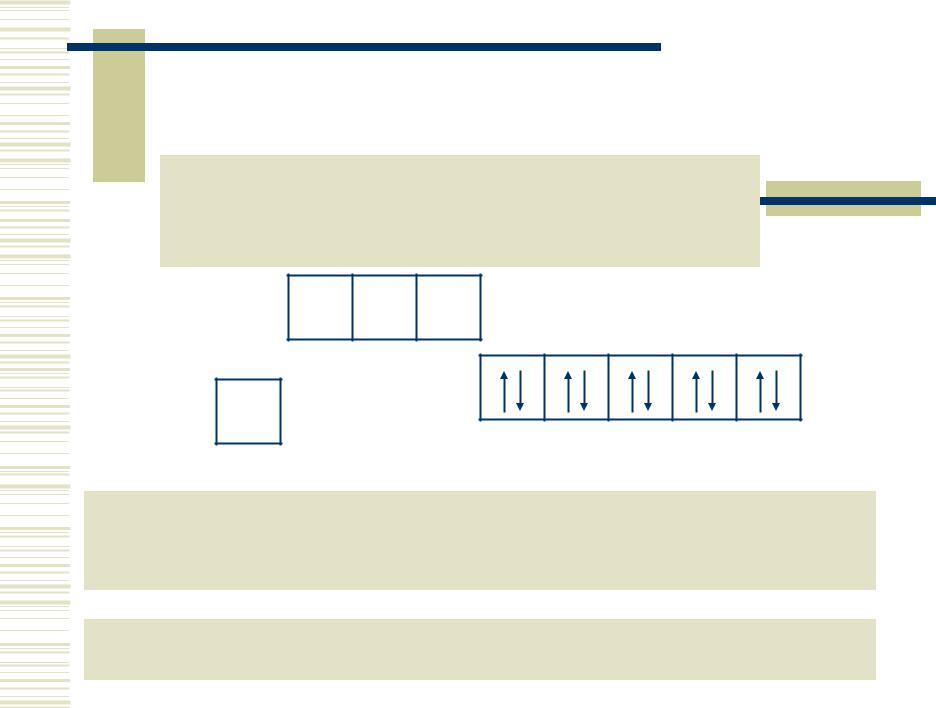
Элементы IБ- группы
Общая электронная формула: […] ns1 (n–1)d10
np 0 ns 1 
(n–1)d 10
 КЧ: 2 (sp -гибр., линейн.), 4 (dsp 2-гибр., квадрат; sp 3-гибр., тетраэдр)
КЧ: 2 (sp -гибр., линейн.), 4 (dsp 2-гибр., квадрат; sp 3-гибр., тетраэдр)
 Степени окисления: 0, +I, +II, +III
Степени окисления: 0, +I, +II, +III
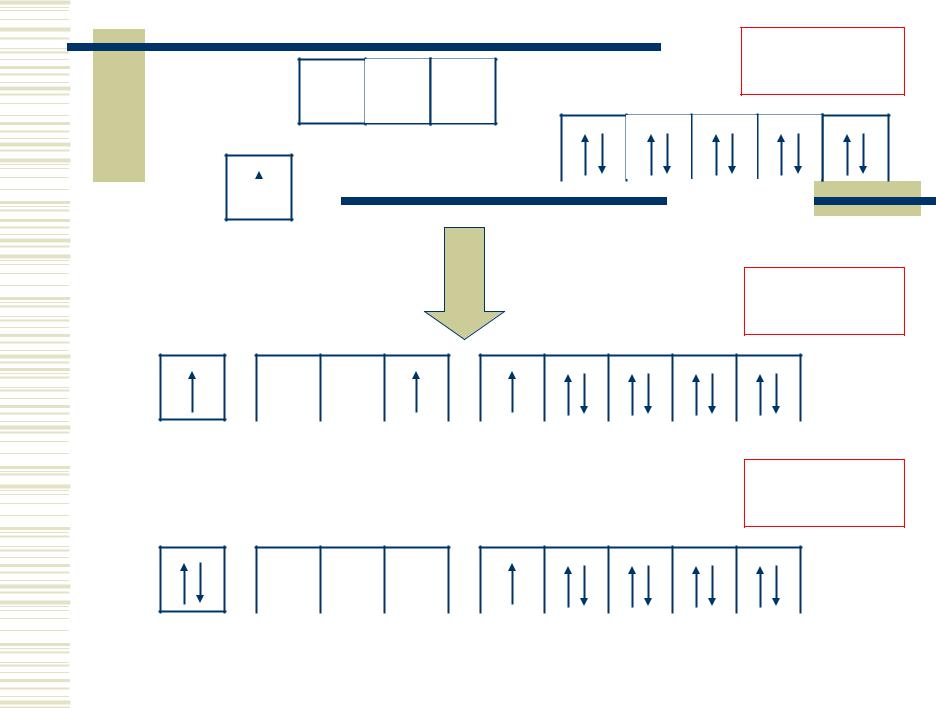
ns
ns
s1d10
np 0
ns 1 |
|
|
|
(n–1)d 10 |
s1p1d 9
1
np 1 |
|
(n–1)d 9 |
s2d 9
2
np 0 |
|
(n–1)d 9 |
Степени окисления
Cu
Ag
Au
+I (d10ns0)
Cu2SO4,
CuCl
Ag(I) уст. ст. окисления
Au2S, AuBr
+II (d9ns0)
 Cu(+II) уст.
Cu(+II) уст. 
ст. окисления
AgCO3,
AgF2
–
+III (d8ns0) NaCuO2
AgF3
Au(+III) уст.
ст. окисления
Примеры устойчивых соединений
+I |
+II |
+III |
|
Простые соединения |
|
AgNO3 |
CuSO4 |
Au2(SeO4)3 |
AgCl |
CuCl2 |
|
Комплексные соединения
[Ag(NH3)2]+  [Cu(NH3)4]2+
[Cu(NH3)4]2+  [AuCl4]–
[AuCl4]–
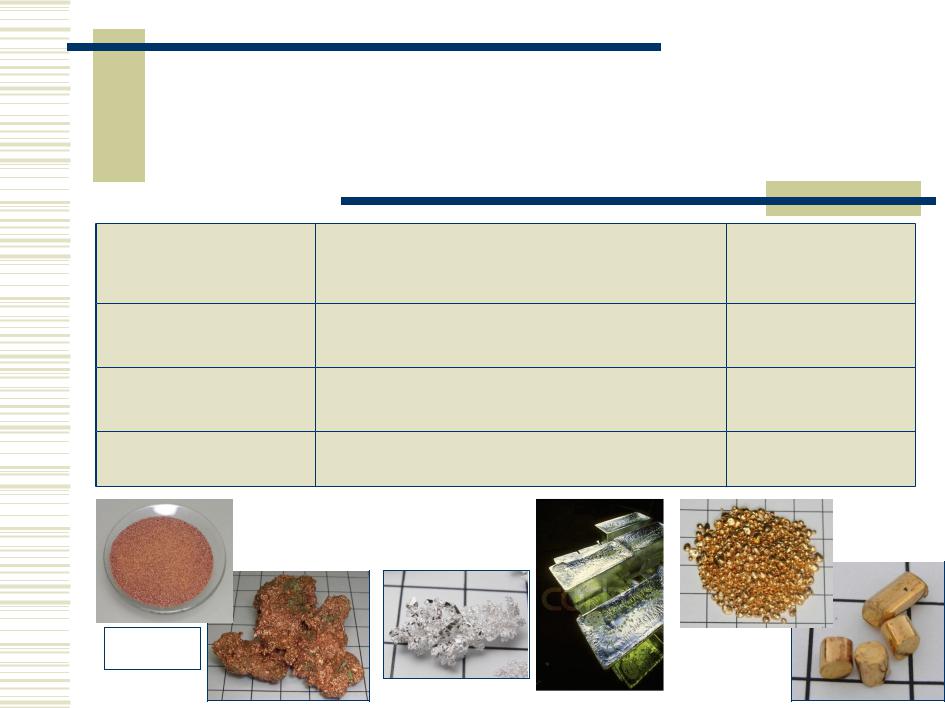
Простые вещества
|
|
|
Медь |
Серебро |
Золото |
||||||
т. пл., С |
1084,5 |
961,9 |
|
1064,4 |
|||||||
т. кип., С |
2540 |
2170 |
|
2947 |
|||||||
, г/см3 |
8,9 |
10,5 |
|
19,3 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
Золото |
|
|
|
|
|
Серебро |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Медь
В ЭХРН: …H ... Cu …Ag …Au
Сu2+/Cu, В: +0,34
ЭIБ + H2O
ЭIБ + H3O+
Cu |
+ |
H2SO4(конц.) |
|
HNO3(конц.) |
|||
Ag |
|||
|
HNO3(разб.) |
||
|
|
Ag+/Ag [AuСl4]–/Au +0,799 +1,00
Cu2+ Ag+

Химическое растворение
В «царской водке» (до ст. ок. +III)
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
В расплаве селеновой кислоты (до ст. ок. +III) 2Au + 6H2SeO4 = Au2(SeO4)3 + 3SeO2 + 6H2O
В щелочной среде (до ст. ок. +I) 2Cu + 8(NH3.H2O) + O2 =
= 2[Cu(NH3)4]2+ + 4OH + 6H2O 2Cu + 4CN + 2H2O = 2[Cu(CN)2] + 2OH + H2
4Ag + 8CN + 2H2O + O2 = 4[Ag(CN)2] + 4OH
Кислородные соединения Cu Ag, Au
 +I: Cu2O уст. красн., т.
+I: Cu2O уст. красн., т.  пл. 1240 С
пл. 1240 С
 +II: CuO черн., разл. до
+II: CuO черн., разл. до
Cu2O и O2 (1026 С)
Cu(OH)2 синий, амфотерн., разл. до CuO и H2O (40-80 С)
 +III: Cu2O3 т-ра разл.
+III: Cu2O3 т-ра разл.  400 С (до CuO и O2 )
400 С (до CuO и O2 )
+I: Ag2O разл. до Ag и O2 (160 С )
+II: «Ag2O2» (AgIAgIIIO2) диамагнитен, разл. до Ag2O и O2 (100 С)
+III: Au2O3 амфотерн., разл. до Au и O2 (160 С)
Au2O3 · 2H2O амфотерный (Kк Kо) – «золотая
кислота»
