
- •Общая и неорганическая химия. Лекция 13
- •Ковалентная связь
- •Параметры ковалентной связи
- •Энергия ковалентной связи
- •Валентное состояние и валентные возможности
- •Основные положения метода валентных связей (МВС)
- •Основные положения МВС
- •Свойства ковалентной связи
- •Перекрывание орбиталей при образовании -связей
- •Перекрывание орбиталей при образовании - и -связей
- •Гибридизация атомных орбиталей
- •Примеры гибридизации
- •Примеры гибридизации
- •Примеры гибридизации
- •Примеры гибридизации
- •Примеры гибридизации
- •Состав
- •Алгоритм предсказания типа гибридизации
- •Алгоритм предсказания типа гибридизации (окончание)
- •Определение типа гибридизации
- •Определение типа гибридизации
- •Полярность химической связи
- •Эффективный заряд и степень окисления
- •Дипольный момент
- •Для двухатомных молекул HГ
- •Дипольный момент многоатомных молекул
- •Векторные диаграммы для определения дипольных моментов молекул
- •Векторные диаграммы для определения дипольных моментов молекул
Общая и неорганическая химия. Лекция 13
Ковалентная химическая связь. Метод валентных связей.
Полярность связей

Ковалентная связь
Возникает за счет увеличения электронной плотности в области между химически связанными атомами
Гипотеза Льюиса (1916): связи между двумя атомами осуществляется парой электронов;
при этом вокруг каждого атома обычно формируется восьмиэлектронная оболочка («правило октета»).
Гилберт-Ньютон ЛЬЮИС (23.10.1875 - 23.03.1946)
Параметры ковалентной связи
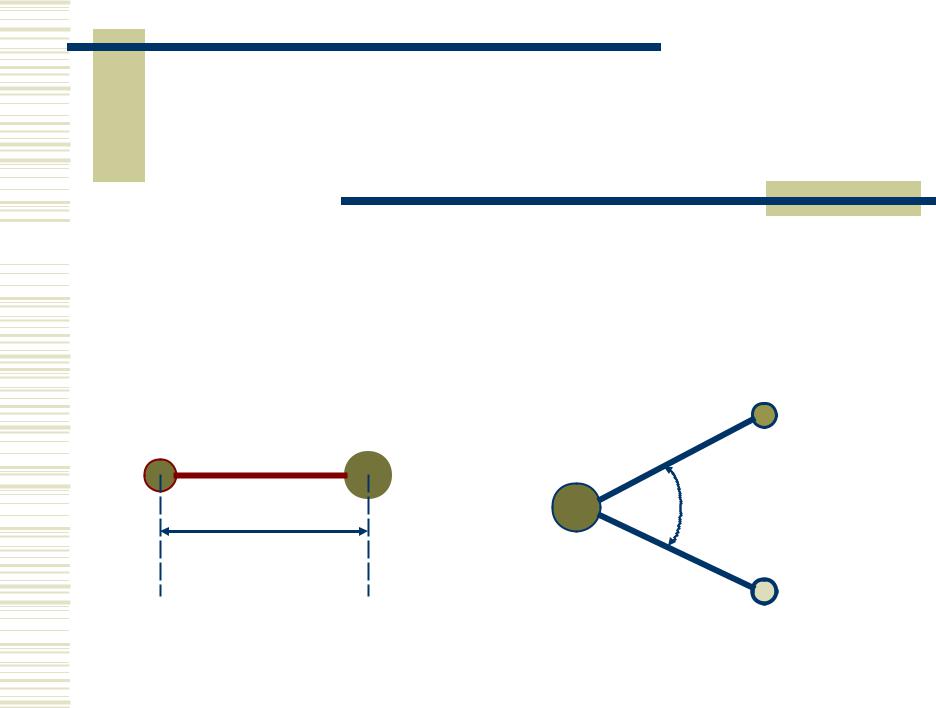
 Длина связи – это
Длина связи – это
расстояние между
ядрами химически связанных атомов.
A  B
B
rAB
Валентный угол – угол между линиями связи, данных атомов.
A
B
= ABC
C

Энергия ковалентной связи
E(AB) – это энергия, необходимая для того, чтобы разорвать связь между атомами A и B и удалить их друг от друга на расстояние, на котором они не взаимодействуют.
Примеры:
Образование и диссоциация молекулы водорода:
Н + Н = Н2 + 435 кДж H2 = H + H – 435 кДж
Энергия связи в молекуле воды:
H2O = 2H + O – 921 кДж; E(OH) = 460,5 кДж/моль
Валентное состояние и валентные возможности
Валентность – это свойство одиночного атома к образованию того или иного числа ковалентных связей.
Валентные возможности атома определяются числом неспаренных электронов и числом вакантных орбиталей данного атома, способных участвовать в образовании связей по донорно- акцепторному механизму.
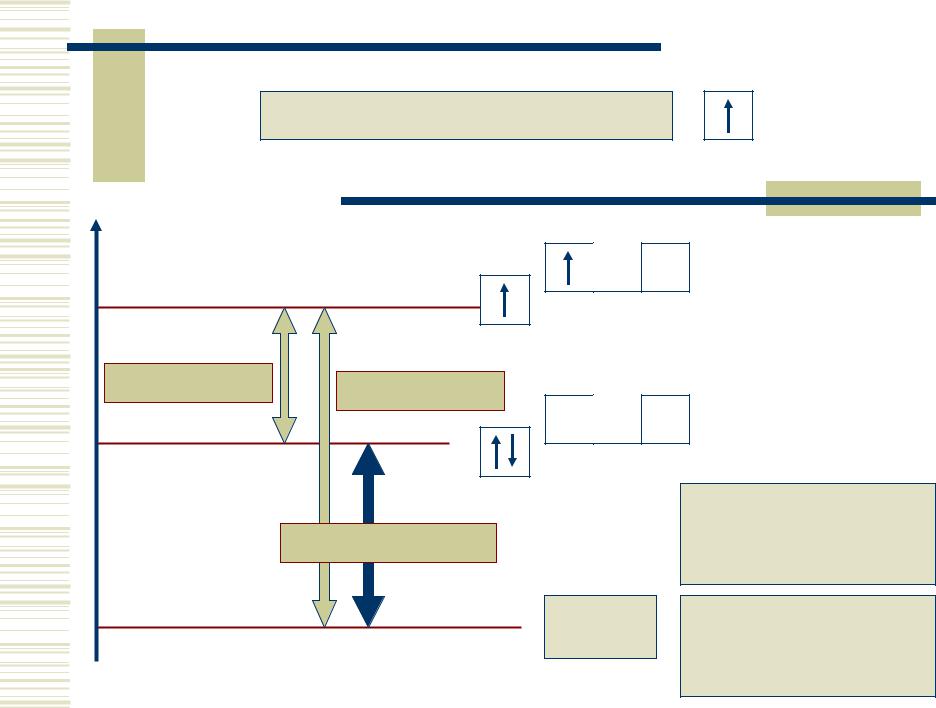
|
Li: [He]2s1; валентность = 1 |
E |
|
Be*: [He]2s12p1 |
|
|
2s12p1 |
323 кДж/моль |
798 кДж/моль |
|
|
Be: [He]2s2 |
2s22p0 |
|
475 кДж/моль |
|
BeF2 |
BeF2:
валентность = 2
[BeF4]2– :
валентность = 4
Основные положения метода валентных связей (МВС)
Ковалентная связь образуется в результате
обобществления неспаренных электронов двумя взаимодействующими атомами. Эта пара электронов локализована в пространстве между ядрами данных атомов.
Ковалентная связь образуется в результате  перекрывания либо двух атомных орбиталей с
перекрывания либо двух атомных орбиталей с
неспаренными электронами (обменный механизм),
либо орбитали с парой электронов и пустой атомной орбитали (донорно-акцепторный механизм).
Основные положения МВС
Перекрывание атомных орбиталей происходит только тогда, когда симметрия перекрываемых орбиталей относительно межъядерной оси одинакова.
В образующейся частице (молекуле или сложном ионе) ядра взаимодействующих атомов считаются локализованными.
Свойства ковалентной связи
Насыщаемость. В соответствии с принципом Паули на перекрываемых орбиталях могут присутствовать не более двух электронов с противоположными спинами).
Направленность. Перекрываемые орбитали должны иметь одинаковую симметрию относительно межъядерной оси (вдоль σ-связей). Совокупность направленных, строго ориентированных в пространстве σ-связей создает структуру химической частицы.
Образование кратных связей при дополнительном перекрывании атомных орбиталей ( - и -связи).
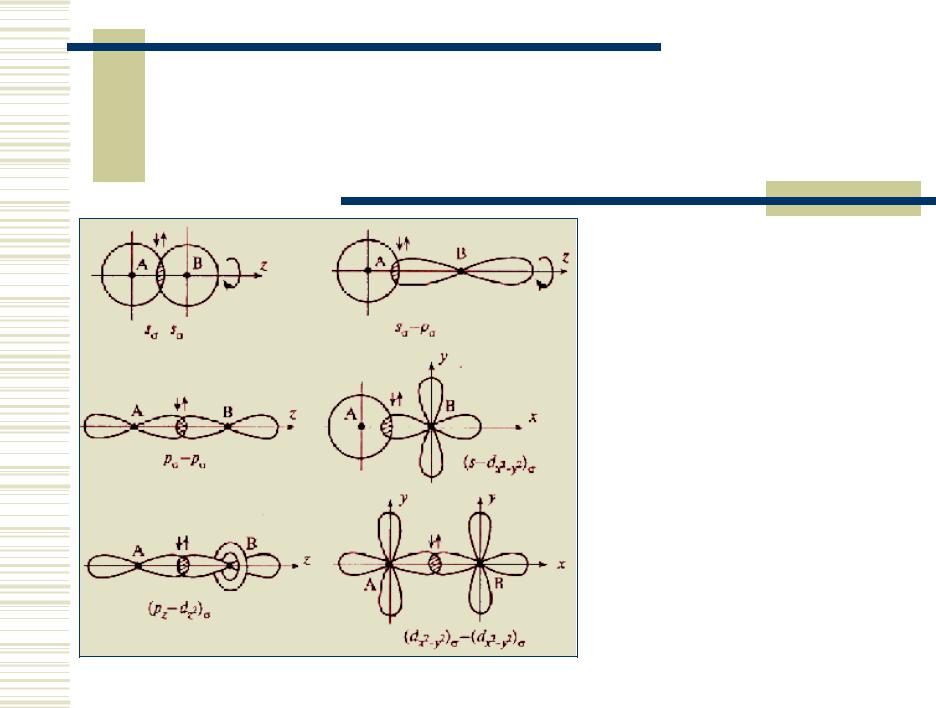
Перекрывание орбиталей при образовании -связей
При образовании сигма-связей максимум электронной плотности находится на линии связи
