
- •Федеральное агенство по образованию Московская государственная академия тонкой химической
- •Растворы
- •Смеси веществ
- •Грубодисперсные системы
- •Истинные растворы
- •Количественный состав раствора
- •Растворы
- •Концентрация вещества Растворы меньше его
- •Растворимость газов в жидкостях
- •Растворимость газов в жидкостях
- •Растворимость газов в жидкостях
- •Растворимость твердых веществ в жидкостях
- •Диаграмма растворимости
- •Перекристаллизация
- •Растворы электролитов
- •Сильные электролиты
- •Слабые электролиты
- •Слабые электролиты
- •Закон разбавления Оствальда
- •Гетерогенные ионные равновесия
- •Растворимость (L), моль/л
- •Задача
- •Условия осаждения и растворения осадков
- •Введение одноименного иона
- •Удаление одноименного иона
- •Удаление одноименного иона
- •Переосаждение
- •В каком минимальном объеме воды можно растворить 1 г гипса?
- •Выпадет ли осадок при сливании равных объемов миллимолярных
- •Протолитическая теория кислот и оснований
- •Протолитическая теория
- •Кислоты
- •Основания
- •Амфолиты
- •Растворители
- •Ионное произведение воды
- •Водородный показатель (рН)
- •Водородный показатель (рН)
- •Шкала рН
- •Константа кислотности
- •Слабые кислоты
- •Сильные кислоты
- •Сила кислот в неводных растворителях
- •Константа основности
- •Слабые основания
- •Сильные основания
- •Малорастворимые гидроксиды
- •Связь Kк и Ko для пары НА/А–
- •Степень протолиза ( )
- •Закон разбавления Оствальда
- •Степень протолиза
- •Учет автопротолиза воды
- •Учет автопротолиза воды
- •Учет автопротолиза воды
- •Сдвиг протолитических равновесий
- •Сдвиг протолитических
- •Определите рН в 0,001 М растворе серной кислоты.
- •Определите рН в 0,002М растворе хлорноватистой кислоты при 25 °C.
- •Определите pH в 0,002М растворе аммиака при 25 °С.
- •Обратимый гидролиз солей
- •Гидролиз солей
- •Гидролиз солей
- •Гидролиз солей
- •Гидролиз кислых солей
- •Гидролиз солей
- •Необратимый гидролиз
- •Необратимый гидролиз
- •Необратимый гидролиз
- •Определите рН 0,1 М раствора хлорида железа(III).
- •Определите рН 0,1 М раствора хлорида железа(III).
- •Определите рН 0,1 М раствора хлорида железа(III).
- •Определите рН в 0,1 М растворе ортофосфата натрия.
- •Определите рН раствора, содержащего 0,001 моль/л уксусной кислоты и 0,1 моль/л ацетата натрия.
- •Определите рН раствора, содержащего 0,001 моль/л уксусной кислоты и 0,1 моль/л ацетата натрия.
- •Определите pH в водном растворе NaHA
- •Определите pH в водном растворе NaHA
- •Определите pH в водном растворе NaHA
- •Кислотно-основные индикаторы
- •Метиловый оранжевый

Федеральное агенство по образованию Московская государственная академия тонкой химической
технологии имени М.В. Ломоносова
Кафедра неорганической химии
Савинкина Е.В.
Лекции по общей и неорганической химии
Растворы
Учебное пособие
Москва МИТХТ им. М.В. Ломоносова
2010
1

УДК 546.04 ББК 24.1
Рецензент: д.х.н. Киселев Ю.М. (химический факультет МГУ)
Рекомендовано к изданию кафедрой неорганической химии МИТХТ
|
(протокол № 3 от 10.11.2010) |
|
Е.В. Савинкина 2010 |
|
МИТХТ им. М.В. Ломоносова 2010 |
Утверждено Библиотечно-издательской комиссией МИТХТ им. М.В.Ломоносова в качестве учебного пособия для студентов 1 курса бакалавриата по направлениям 020100 62 (Химия), 240100 62 (Химическая технология и биотехнология), 150600 62 (Материаловедение и технология новых материалов), 280200 (Защита окружающей среды), 200500 62 (Метрология, стандартизация и сертификация), 080500 (Менеджмент).
Один оптический диск |
|
Объем данных 0,9 Мб |
2 |
Растворы
Общие свойства растворов
Вещество А + вещество В
А + В
Новые вещества |
Неоднородная смесь |
Однородная смесь |
|
(раствор) |
|||
|
|
Раствор – гомогенная система, состоящая из двух или более компонентов, имеющая переменный состав
4

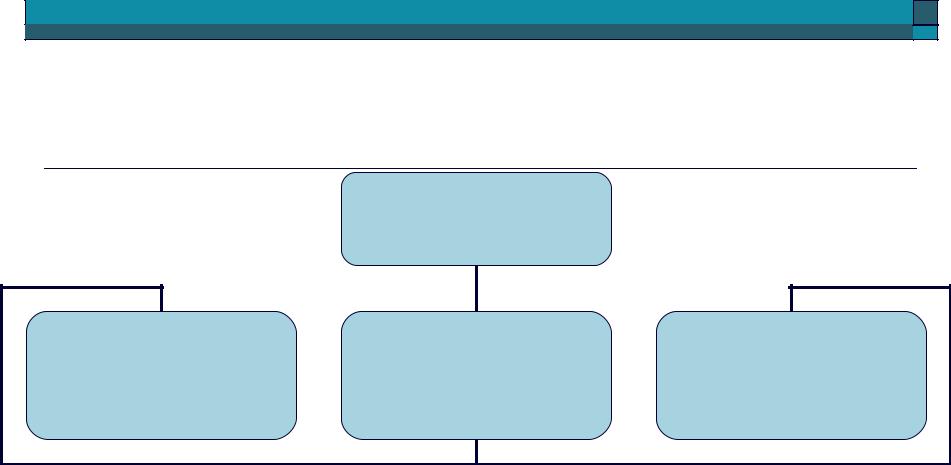
Смеси веществ
Смеси
Грубодисперсные системы (взвеси)
Тонкодисперсные системы (коллоидные системы)
Истинные растворы
Размеры частиц
более 100 нм
1 – 100 нм
менее 1 нм
5

Грубодисперсные системы
Дисперсионная среда – газообразная Дисперсная фаза:
твердая – пыль, дым, порошок
жидкая – смог, облако, туман
Дисперсионная среда – жидкая Дисперсионная фаза:
твердая – суспензия, паста
жидкая – эмульсия
газообразная – пена, газированная вода
Дисперсионная среда – твердая Дисперсная фаза:
твердая – горные породы, цветные стекла, композиты
жидкая – твердые эмульсии |
6 |
газообразная – твердые пены

Истинные растворы
Агрегатное состояние: газообразные, жидкие, твердые растворы
Состав раствора: растворитель + растворенное вещество
Параметры раствора: температура, давление, содержание растворенного вещества
7

Количественный состав раствора
Массовая доля
Молярная концентрация (молярность)
Эквивалентная
концентрация
(нормальность)
Коэффициент
растворимости
Мольная доля
Массовая концентрация
Моляльная концентрация (моляльность)
w(B) m(B) m( p)
c(B) n(B) V ( p)
ceq (B) |
neq (B) |
|
|
|
V ( p) |
|
|||
|
|
|
||
ks m(B) |
|
|||
m(s) |
|
|||
x(B) |
|
n(B) |
|
|
|
|
|||
n(B) n(s) |
|
|||
(B) m(B) |
|
|||
|
V ( p) |
|
||
cm (B) n(B) |
8 |
|||
|
m(s) |
|
||

Растворы
Идеальные
V = 0; Q = 0
Реальные
V ≠ 0
1 л H2O + 1 л C2H5OH → 1,93 л раствора
Q ≠ 0
Qрастворение = – Qразрыв связей + Qобразование связей
9

Концентрация вещества Растворы меньше его
растворимости
Ненасыщенные

Вт → Вр |
Растворимость |
|
вещества – его |
||
|
||
Насыщенные |
концентрация в |
|
насыщенном растворе |
Вт  Вр; истинное
Вр; истинное
Пересыщенные
В ; метастабильное равновесие
Концентрация вещества больше его растворимости 
10
