
- •Лекція 3.3. Основні процеси нагромадження, міграції та трансформації забруднювачів у природних водах
- •1. Способи оцінки інтенсивності водної міграції хімічних елементів
- •2. Природні фізико-хімічні процеси у водах
- •2.2. Кристалізація.
- •2.3. Сорбіція й іонний обмін
- •2.5. Біохімічні процеси
- •3. Техногенна метаморфізація вод
- •I тип техногенної метаморфізації вод – карбонатний
- •II тип техногенної метаморфізації вод – сульфатний
- •III тип техногенної метаморфізації вод – хлоридний
- •4. Геохімічні бар’єри
2.2. Кристалізація.
Кристалізація – це процес виділення твердої фази з насичених розчинів, розплавів, парів. Тверда фаза виділяється з розчину, якщо хімічний потенціал компоненту який утворюється є меншим від хімічного потенціалу цього компонента у розчині. Це відбувається тоді, коли концентрація речовини у розчині стає більшою концентрації насиченого розчину за поточних температурних та баричних умов.
Головні причини кристалізації у природних водах – це випарювальна кристалізація, зміна температури і тиску у місцях розвантаження підземних вод, зміна окисно-відновних умов, змішування вод різного хімічного складу.
У простішому вигляді утворення твердої сполуки з розчину відбувається послідовно і складається з реакції взаємодії компонентів з утворенням спочатку нейтральних молекул:
Men+ + nAm- = MeAn0 (наприклад Fe3+ + 3OH- = Fe(OH)30)
і подальшим фазовим переходом:
MeA0 n(р-н) → MeAn(тв.) (наприклад Fe(OH3)0 р-н → Fe(OH)3 (тв.))
Формування перенасичених розчинів внаслідок випаровувального концентрування.
Процес випаровувального концентрування має важливе значення при осадженні різноманітних сполук з вод аридної зони. Якщо рівень підземних вод знаходиться на глибині менше 2-3 м, то відбувається капілярне підняття цих вод і їх випаравувальне концентрування. При цьому, чим меншою є глибина залягання ґрунтових вод, інтенсивніше відбувається випаровувальне концентрування. Внаслідок випаровувального концентрування з вод послідовно випадають в осад спочатку малорозчинні солі (такі як Al2O3, Fe2O3, MnО4) а потім все більш і більш розчинні (рис.7).
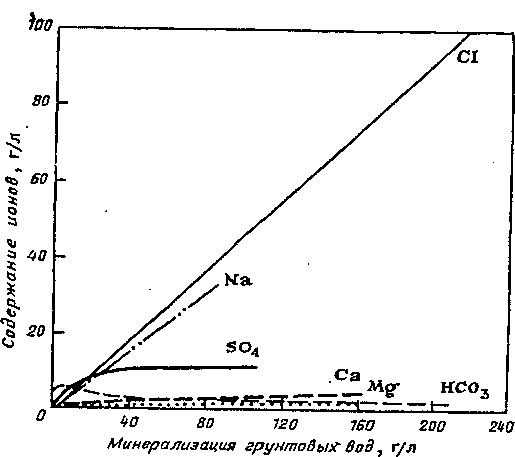
Рис. 7. Залежність між складом і мінералізацією ґрунтових вод у степових районах; НСОз- в десятикратному масштабі (за В.А. Ковдою).
Формування пересичених розчинів внаслідок окисно-відновних реакцій.
Про зміну розчинності сполук елементів зі зміною валентністю розглянуто у підрозділі про розчинення.
Окиснення Fe2+ → Fe3+ з наступним гідролізом:
Fe3+ + 3OH- = Fe(OH)30 Fe(OH)3(тв.)
З процесами кристалізації тісно пов’язані такі процеси: галогенез, сульфідогенез, алюмосилікатогенез, опалогенез, кальцитогенез, оксидогенез, глеєгенез. Усі ці процеси детально описані М.А. Глазовською, і ми їх будемо вивчати у подальшому.
2.3. Сорбіція й іонний обмін
Сорбцією називається процес вибіркового поглинання газів і розчинених речовин твердою фазою. При цьому, сорбуючу тверду речовину називають сорбентом, а речовину яка сорбується – адсорбатом.
Сорбція може бути фізичною і хімічною.
Фізична сорбція обумовлена електростатичними силами, а також силами молекулярного притягання адсорбата (вад-дер-ваальсові сили). У випадку фізичної сорбції сорбована речовина зберігає свою хімічну індивідуальність. Така сорбція зворотна, вона звичайно супроводжується процесом десорбції, який спричинений намаганням частинок до рівномірного розподілу. У зв’язку з цим в системі “тверда фаза - розчин” існує динамічна рівновага між кількістю адсорбованих і десорбованих речовин у певний проміжок часу. Фізична сорбція зменшується зі збільшенням температури і збільшується з ростом тиску і концентрації адсорбата.
Хімічна сорбція – це процес взаємодії між сорбентом і адсорбатом, який супроводжується хімічною реакцією. При цьому кристалічна градка сорбента руйнується і утворюється нова хімічна сполука. Хемсорбція – це незворотній у хімічному сенсі процес.
Виділяють молекулярну і іонну (позитивну і негативну) сорбції. У процесів які відбуваються у довкіллі, а саме формуванні хімічного складу вод, їх самоочищенні дуже важливим є іонна сорбція.
У випадку іонної сорбції сорбційна здатність хімічних елементів збільшується зі збільшенням заряду іону, тобто: Me3+ > Me2+ > Me+
У результаті адсорбційних процесів у гідрогеохімічних системах поверхня твердої фази, яка взаємодіє з водами, є заряджена катіонами і аніонами. При взаємодії такої твердої фази з водами іншого складу відбувається самовільний процес обміну іонів відповідно до їхнього хімічного потенціалами у твердій і рідкій фазах. Такий процес називається іонним обміном. Це самовільний і зворотний обмін між різними фазами гідрохімічної системи, який не призводить до змін у кристалічній структурі твердої фази.
Такі процеси часто виникають між природними чи техногенно зміненими водами і поверхнею глинистих мінералів.
Прикладом катіонного обміну може слугувати реакція:
2Na+тв. + Ca2+р-н ↔ Ca2+тв. + 2Na+р-н,
а прикладом аніонного обміну:
2Cl-тв. + SO2-4(р-н) ↔ SO2-4(тв.) + 2Cl-р-н.
Типовими природними іонообмінниками є мінерали глин, глауконіт, цеоліти, карбонати, гідрооксиди багатовалентних елементів (Fe, Mn, Al). Їх здатність до катіонного чи аніонного обміну визначається значенням так званої ізоелектричної точки. Це те значення pH, за якого загальний заряд поверхні мінерала рівний нулю:
SiO2 (кварц) 2,0
SiO2 (гель) 1,0 – 2,5
Al(OH)3 (гібсит) 9,0
FeO(OH) (гетит) 6-7
Fe2O3∙nH2O 6,9
MnO2 2,0
Каолініт 3,5
Монтморилоніт < 2,5
Тобто глини (каолініт, монтморилоніт) за pH відповідно понад 3,5 і 2,5 заряджаються негативно і є катіонообмінникми. Гідрооксиди заліза і алюмінію у кислих середовищах є аніонообмінниками. А в лужних катіонообмінниками.
Найбільш важливими катіонообмінниками у природних та техногеннозмінених водах є глинисті мінерали які за цією характеристикою поділяються на три групи:
мінерали з максимальною ємністю обміну (понад 80 мг-екв./100 г): монтморилоніт, вермикуліт, бентоніт, нонтроніт, бейделіт, сапоніт;
мінерали з середньою ємністю обміну (15-80 мг-екв./100 г): гідрослюди, ілліт;
мінерали з низькою ємністю обміну (менше 15 мг-екв./100 г): каолініт, галуазит, диккіт, накрит.
Причини такої диференціації у обмінній ємності мінералів лежать в їхніх кристалохімічних особливостях. Монтморилоніт має трьохшарову решітку типу 2:1. Поперечний електростатичний зв'язок між окремими пакетами і шарами монтморилоніта ослаблені, і внаслідок цього його решітка рухома і внутрішня поверхня доступна для іонів різного заряду і води. Тому питома поверхня монтморилоніта є великою, при цьому 80 % обмінних позицій є у міжшарових поверхнях і тільки 20% - на зовнішніх. Мінерали каолінітової групи (каолініт, галуазит, диккит, накрит) мають щільнозв’язану двохпакетну решітку типу 1:1. У цих мінералів є тільки зовнішня поверхня сорбції, тому їхня обмінна здатність є низькою.
