
Лекция 25. Пятичленные гетероциклы с двумя гетероатомами
В данной лекции будут рассмотрены пятичленные ароматические гетероциклические соединения, содержащие два гетероатома, один из которых обязательно атом азота. Поэтому такие гетероциклические соединения объединены под общим названием — азолы. Другим гетероатомом может быть азот, кислород, сера (N, О, S).
Какие нас будут интересовать азолы? Это прежде всего:
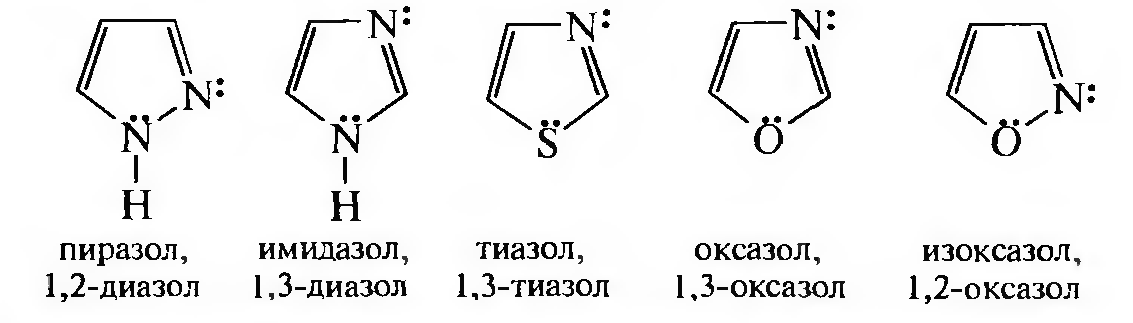
Все приведенные гетероциклы обладают ароматическим характером. Постоянным гетерофрагментом азолов является так называемый «пиридиновый» атом азота, который для образования ароматического секстета предоставляет лишь один р-электрон. Неподеленная электронная пара «пиридинового» атома азота расположена на sp2-гибридизированной атомной орбитали и находится в плоскости гетероциклического ядра. Второй гетероатом на образование ароматического секстета предоставляет пару электронов, которая расположена на р-атомной орбитали

Таким образом, вклад каждого гетероатома в образование единой π-электронной системы различен.
Азолы — соединения с высокими температурами плавления и кипения, хорошо растворимые в полярных растворителях и плохо — в неполярных.
Рассмотрим некоторые особенности азолов.
Кислотность и основность
Все азолы обладают слабыми основными свойствами за счет неподеленной пары электронов атома азота пиридинового типа. При взаимодействии с минеральными кислотами они образуют соли.
Например:
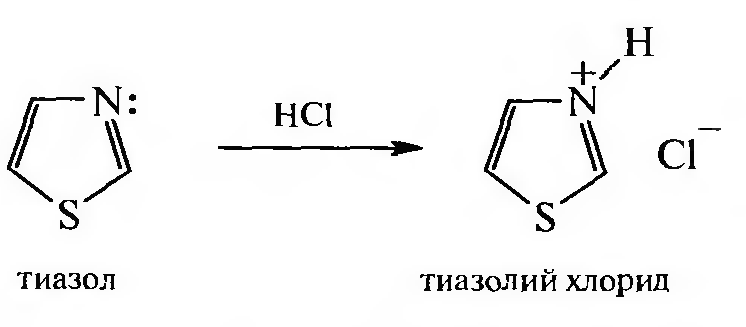
При присоединении протона к молекуле азола образуется катион, в котором сохранена ароматическая структура, а положительный заряд равномерно распределен по всей молекуле — этим можно объяснить то обстоятельство, что азолы не ацидофобны и не окисляются в присутствии сильных минеральных кислот.
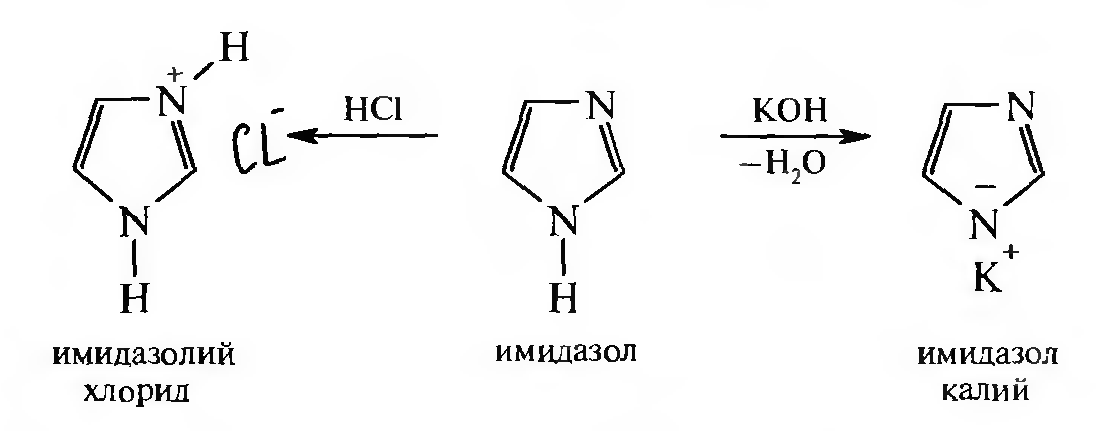
В ряду азолов пиразол и имидазол, помимо основных свойств, проявляют и слабокислотные свойства за счет атома азота пиррольного типа. Следовательно, пиразол и имидазол являются амфотерными соединениями и способны вступать в реакции как с минеральными кислотами, так и со щелочами, образуя при этом соли, например:
Азольная таутомерия
В ряду пятичленных гетероциклов с двумя гетероатомами для пиразола и имидазола характерна азольная таутомерия. Азольная таутомерия обусловлена перемещением атома водорода NH-группы к атому азота пиридинового типа:
 В
молекулах диазолов происходит постоянная
миграция водорода и определить, у какого
из атомов азота находится водород, не
представляется возможным.
В
молекулах диазолов происходит постоянная
миграция водорода и определить, у какого
из атомов азота находится водород, не
представляется возможным.
В результате таутомерных превращений положения 3 и 5 в молекуле пиразола становятся равноценными, 3-метилпиразол и 5-метилпиразол являются таутомерными формами одного и того же соединения:

А в случае имидазола равноценными являются положения 4 и 5:
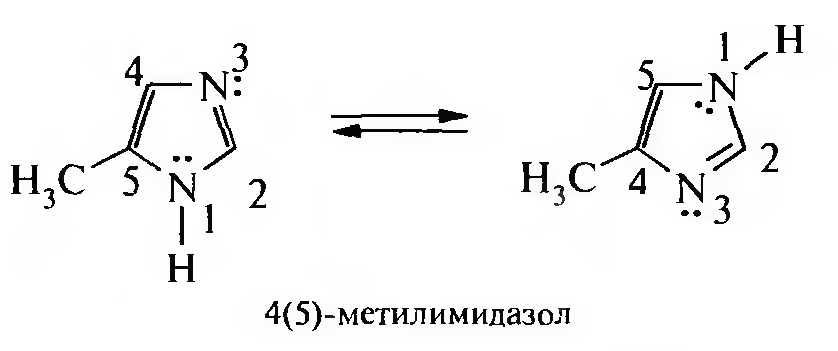
Миграция водорода происходит настолько быстро, что выделить индивидуальные таутомеры не представляется возможным. Поэтому эти соединения так и называют 3(5)-метилпиразол и 4(5)-метил-имидазол.
ПИРАЗОЛ

Кристаллическое вещество с температурой плавления 70 °С, температурой кипения 187 °С, легко растворимое в воде, растворимое в спирте, эфире, бензоле; обладающее запахом пиридина,
Способы получения
Присоединение диазоалканов к алкинам. Реакцию используют для получения пиразола и его производных.
Пиразол получают в результате реакции присоединения диазометана к ацетилену:

Взаимодействие гидразина, алкиларилгидразинов с 1,3-ди- карбонильными соединениями. Этот способ чаще применяют для получения гомологов пиразола. Например, при взаимодействии гидразина с ацетилацетоном образуется 3,5-диметилпиразол:

Химические свойства
Кислотность и основность. Пиразол проявляет амфотерные свойства, благодаря наличию в его структуре атомов азота пиридинового и пиррольного типов.
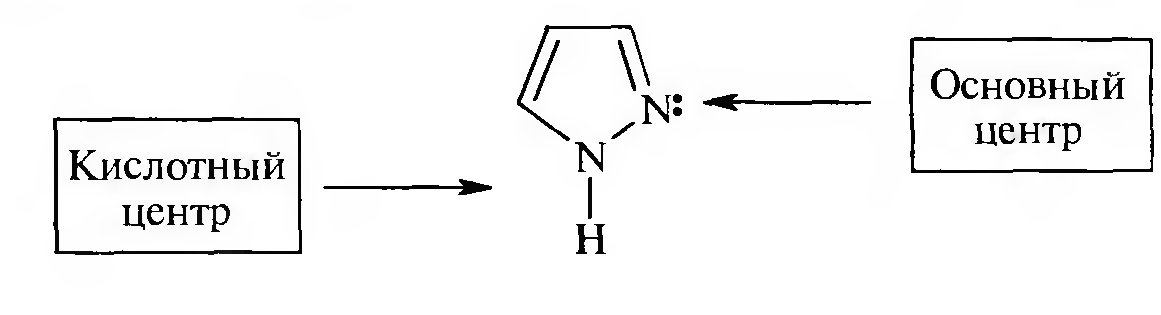
За счет атома азота пиридинового типа пиразол проявляет основные свойства, а за счет атома азота пиррольного типа — слабые кислотные свойства:

