- •27. Трех-, четырех- и пятичленные гетероциклические соединения... 1 Лекция 23. Пятичленные гетероциклы с одним гетероатомом
- •Получение пиррола:
- •2.Получение фурана:
- •В условиях реакции Кольбе — Шмитта пирролид натрия карбоксилируется оксидом углерода (IV):
- •Пирролид натрия формилируется в условиях реакции Раймера — Тимана:
- •И наконец, еще одна особенность — пиррол вступает в реакцию азосочетания.
- •Важнейшие производные пятичленных гетероциклов с одним гетероатомом Производные фурана
- •Производные тиофена

27. Трех-, четырех- и пятичленные гетероциклические соединения... 1 Лекция 23. Пятичленные гетероциклы с одним гетероатомом
Важнейшими представителями этой группы соединений являются пиррол, фуран и тиофен:
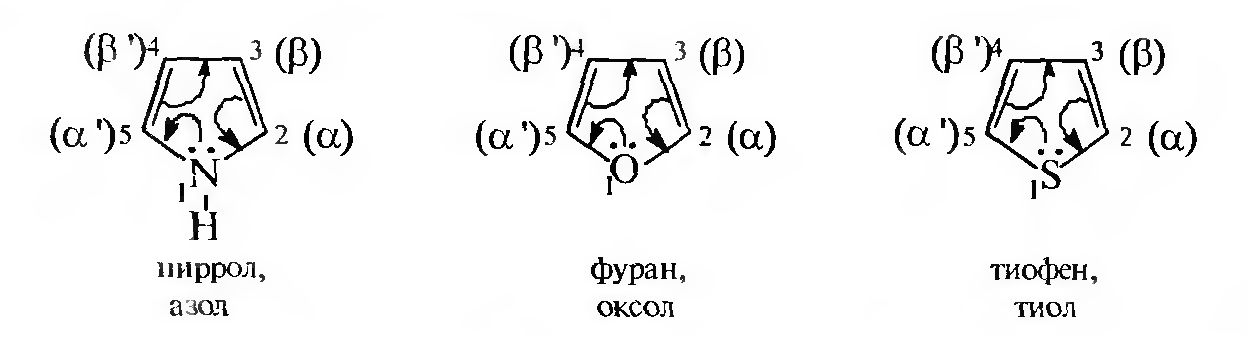
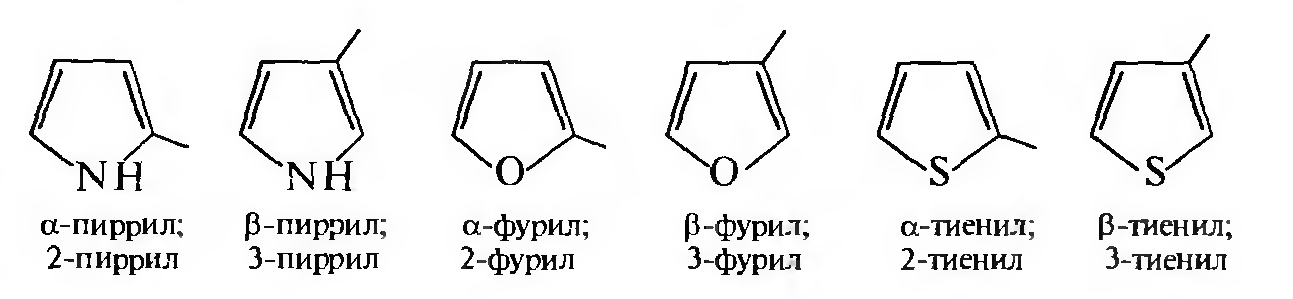
Названия одновалентных радикалов приведенных гетероциклов образуют с помощью суффикса -ил, указывая цифрой или буквой греческого алфавита положение свободной валентности:
Способы получения
Общие способы получения пиррола, фурана и тиофена
Циклизация 1,4-дикарбонильных соединений (синтез Паале — Кнор- ра). При действии на 1,4-дикарбонильные соединения водоотнимающих реагентов (конц. H2S04, Р205) получают фуран и его производные, при использовании аммиака — пиррол и его гомологи, пентасульфида фосфора P2S5 — тиофен и его производные.

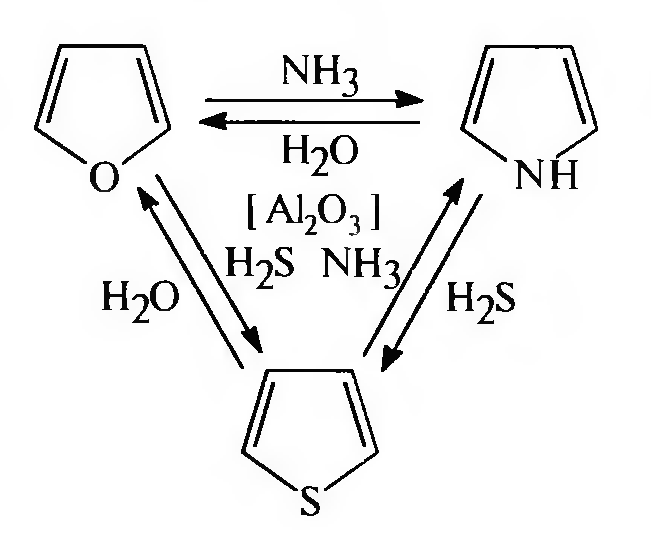
Цикл реакций Юрьева. Позволяет осуществить взаимные превращения фурана, пиррола и тиофена (t ~ 450 °С, катализатор — А1203).
Специфические способы получения
Получение пиррола:
а) из природных источников путем перегонки каменноугольной смолы, а также богатых белками материалов (кости, костный мозг и т. д.);
б) синтетическим путем при нагревании оиаммонийной соли слизевой кислоты:
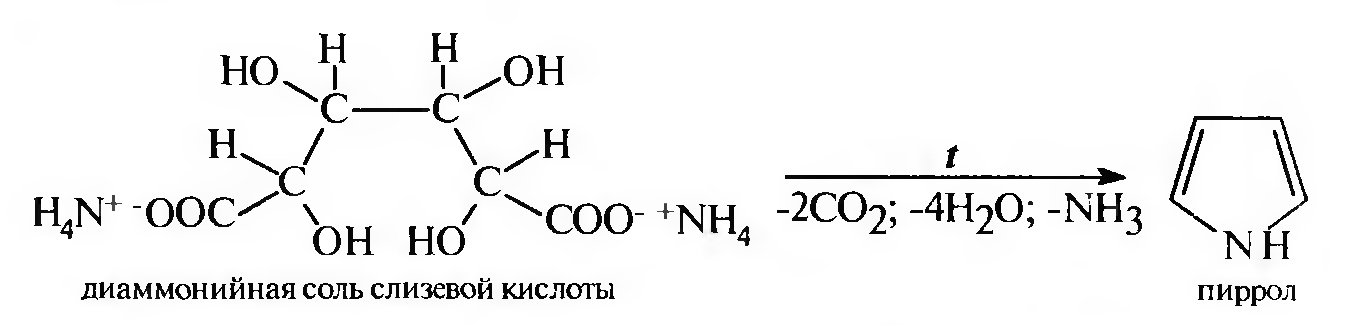
в) при перегонке сукцинимида в присутствии цинковой пыли:
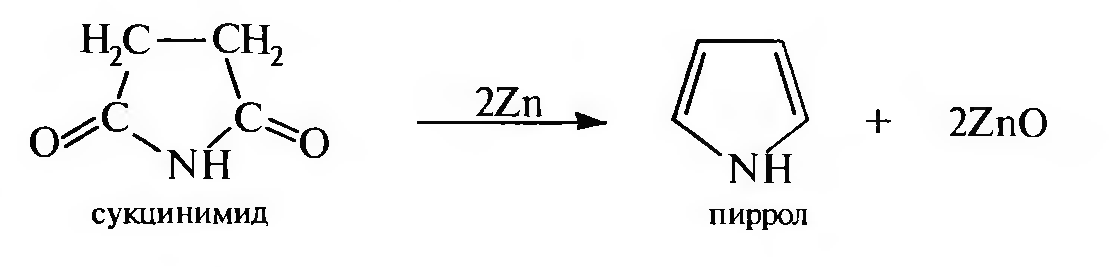
2.Получение фурана:
а) в лабораторных условиях фуран получают сухой перегонкой слизевой кислоты.

б) в промышленности фуран получают из альдопентоз, которые при нагревании с водоотнимающими средствами подвергаются внутримолекулярной дегидратации.
Образовавшийся фурфурол окисляют до пирослизевой кислоты, термическое декарбоксилирование которой приводит к фурану:
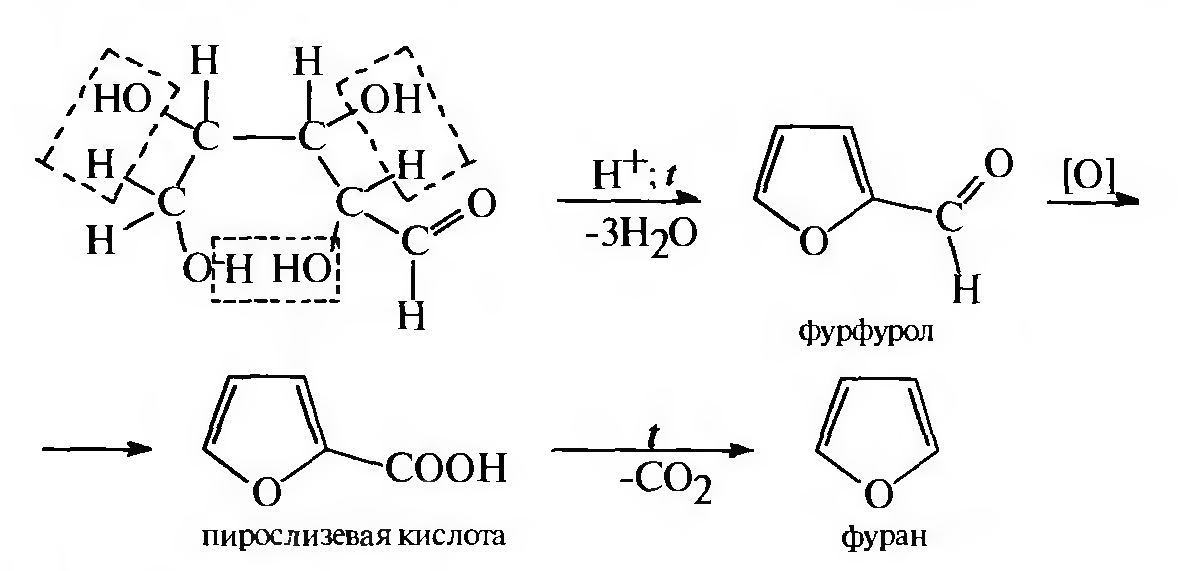
3.Получение тиофена. В промышленности тиофен получают двумя методами:
а) при парофазной циклизации бутана с серой;
б) по реакции Чичибабина при пропускании смеси ацетилена с сероводородом над катализатором А1203:
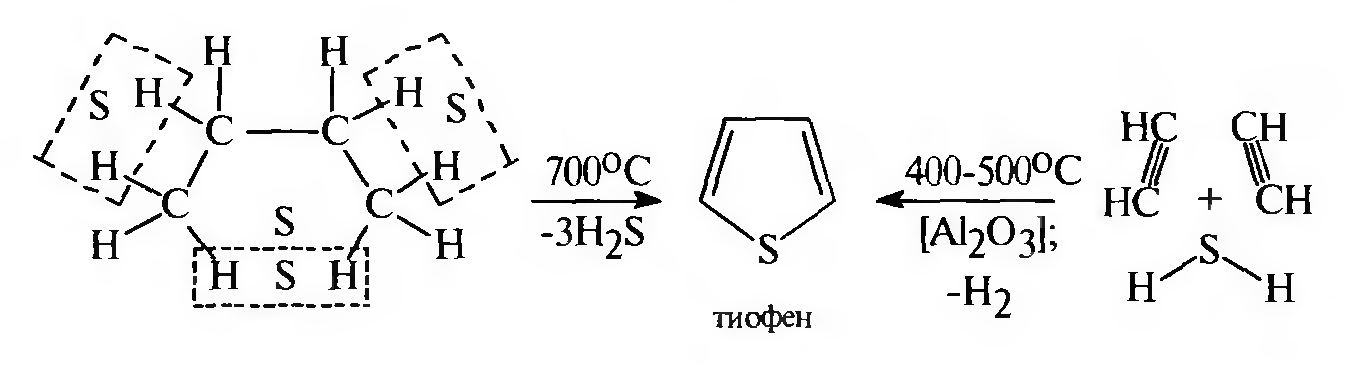
Физические свойства
Пиррол — бесцветная жидкость с запахом, напоминающим запах хлороформа; tкип 130 °С; мало растворим в воде, хорошо растворим в этаноле и бензоле. На воздухе темнеет и осмоляется.
Фуран — бесцветная жидкость со своеобразным запахом, напоминающим запах хлороформа: tкип 32 °С: нерастворим в воде, хорошо растворяется в этаноле и диэтиловом эфире.
Тиофен — бесцветная жидкость со слабым запахом сернистых соединений; tкип 84 °С; нерастворим в воде, хорошо растворим в этаноле, эфире и бензоле. Устойчив к высокой температуре. Окисляется на свету.
Химические свойства
Ароматичность пятичленных гетероциклов с двумя π-связями обусловлена тем, что в сопряжение с π-электронами двойных связей вступает неподеленная пара электронов гетероатомов О, N или S. Образуется замкнутая, сопряженная система, в которой число обобщенных электронов отвечаем правилу Хюккеля (4п + 2).
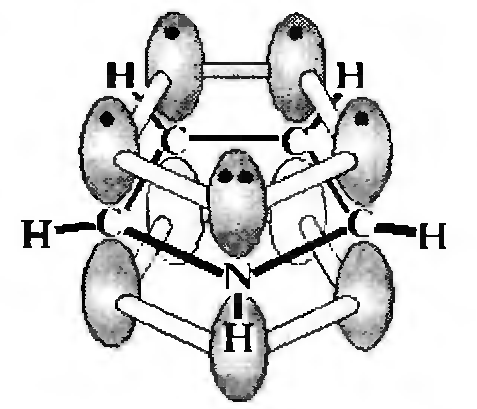
В молекуле пиррола атомы углерода и атом азота находятся в состоянии sp2-гибридизации. За счет sp2-гибридизованных орбиталей каждый атом, входящий в состав цикла, образует три σ-связи, расположенные в плоскости кольца. При этом у атомов углерода и атомов азота остается по одной негибридизованной p-атомной орбитали, которые расположены параллельно друг другу в плоскости, перпендикулярной плоскости кольца. Каждая из p-атомных орбиталей атомов углерода имеет один электрон, а на p-орбитали атома азота находится неподеленная пара электронов. При перекрывании р-орбиталей образуется единый ароматический секстет, охватывающий все атомы цикла.
Атом азота в sр2-гибридизации, имеющий электронную конфигурацию, в которой неподеленная пара электронов занимает негибридизованную р-атомную орбиталь, называется пиррольным.
По аналогии с пирролом гетероатом, вносящий в π-электронную систему два электрона, занимающих р-АО, и образующий с другими атомами только σ-связи, называется гетероатомом пиррольного типа
Реакционная способность пиррола, фурана и тиофена определяется наличием в их структуре цикла с π-электроноизбыточной ароматической системой (шесть π-электронов приходится на пять атомов цикла). Однако степень ароматичности указанных гетероциклов ниже, чем у бензола, и зависит от природы гетероатома. Тиофен по своему химическому поведению в наибольшей степени напоминает бензол.
Фуран имеет наименее выраженный ароматический характер. В некоторых реакциях фуран ведет себя как ненасыщенное (диеновое) соединение. Пиррол занимает промежуточное положение.
Вследствие различной электроотрицательности гетероатома в молекулах пиррола, фурана и тиофена, в отличие от бензола, электронная плотность распределена неравномерно. Следует отметить, что на атомах углерода в α-положении электронная плотность выше, чем в β-положении, что и определяет направленность протекания реакции электрофильного замещения.
А. Общие химические свойства пиррола, фурана и тиофена
Взаимодействие с минеральными кислотами. Фуран и пиррол проявляют высокую реакционную способность в реакциях даже с таким слабым электрофилом, как протон. В присутствии минеральных кислот гетероциклы подвергаются протонированию, которое может осуществляться преимущественно по α-положению. Процесс протонирования сопровождается потерей ароматичности.
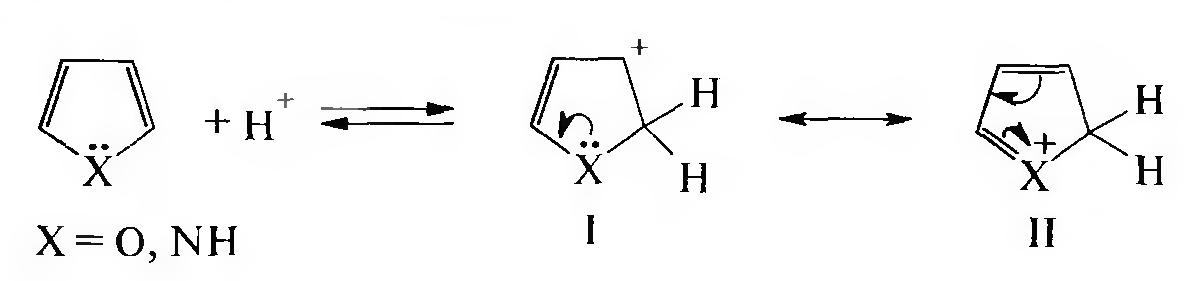
Образовавшиеся структуры I и II лишены ароматичности, и в дальнейшем происходит либо разрыв цикла с образованием полимера (наиболее вероятный процесс для фурана), либо полимеризация с сохранением цикла.
Присоединение протона может происходить и по гетероатому с образованием фуроксониевых и пирролиевых солей с последующей их полимеризацией:
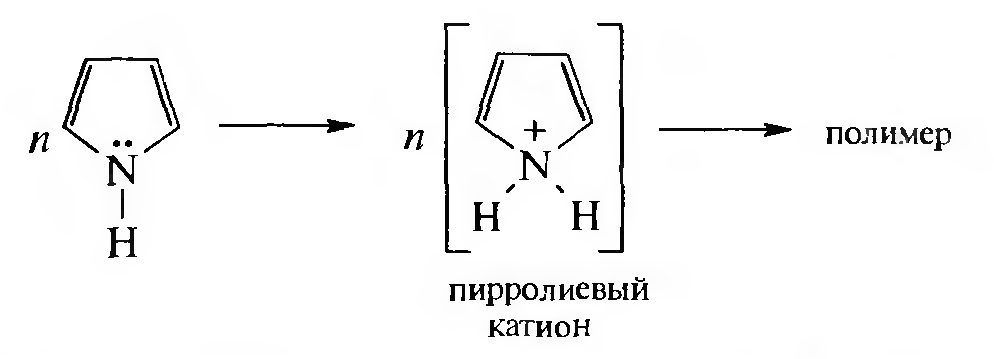
Таким образом, фуран и пиррол в присутствии минеральных кислот осмоляются, образуя полимерные продукты темного цвета. Такое отношение к кислотам называется ацидофобностью, от латинского acidum — кислота и греческого «фобос» — страх.
Введение в фурановое и пиррольное кольцо электроноакцепторных заместителей (-NO2, -СООН, -СОН и др.) приводит к снижению ацидофобности.
Тиофен из-за своей жесткой ароматической структуры не обладает ацидофобностью. Это связано со способностью атома серы в данных условиях изменять свою гибридизацию и неспособностью образовывать сульфониевые соли.
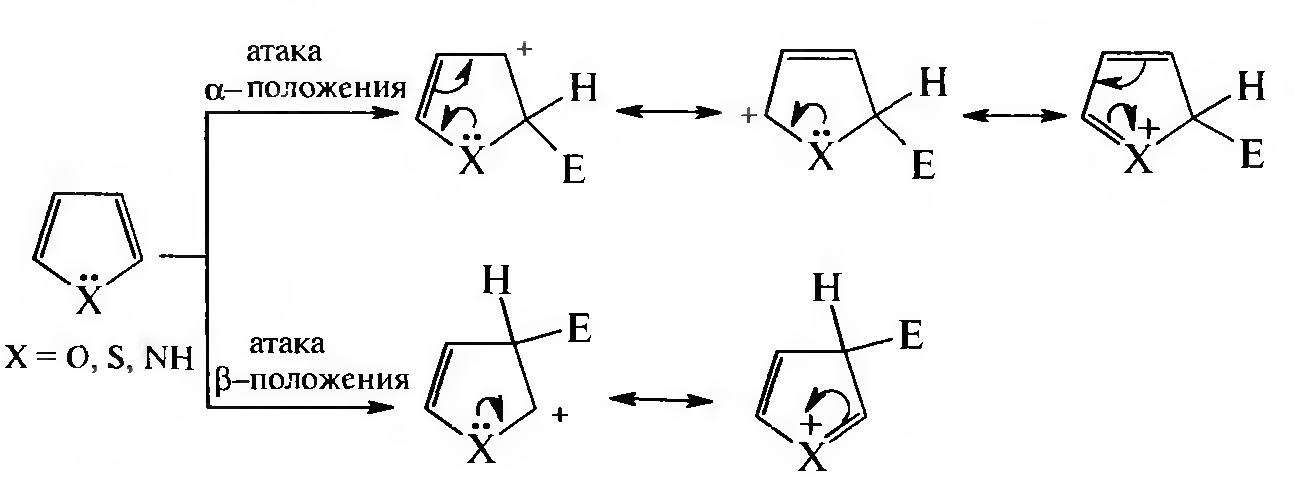
Реакции электрофильного замещения (SE). Как отмечалось выше, электронная плотность в молекулах фурана, пиррола и тиофена распределена неравномерно, что связано с наличием и природой гетероатома. Пара электронов гетероатома сопряжена с π-электронами кольца, электронная плотность на гетероатоме понижается, а в α-положениях — повышена (аналогично влиянию донорных заместителей в орто-положениях аренов).
В первую очередь замещается атом водорода при α-углеродном атоме; если это положение занято, то замещение протекает по β-положению. Такая направленность замещения обусловлена тем, что при участии α-углеродных атомов образуется более устойчивый σ-комплекс, благодаря большей возможности для делокализации положительного заряда.
Сульфирование. При проведении реакций SE необходимо помнить об ацидофобности и высокой реакционной способности фурана и пиррола.
Для сульфирования фурана и пиррола используют мягкий сульфирующий реагент — пиридинсульфотриоксид:
 Пиридинсульфотриоксид
не обладает кислотными свойствами, но
сохраняет сульфирующее действие.
Пиридинсульфотриоксид
не обладает кислотными свойствами, но
сохраняет сульфирующее действие.
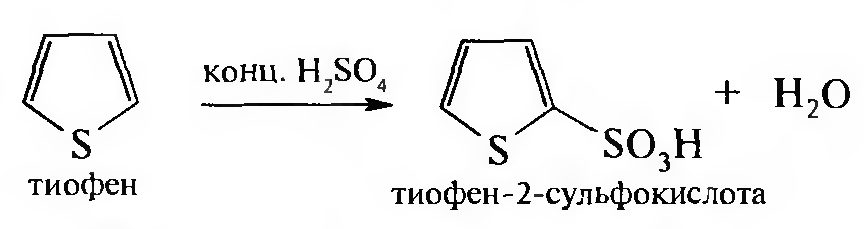
Тиофен легко сульфируется концентрированной серной кислотой на холоду:
Нитрование. Нитрование фурана, пиррола и тиофена проводят аце- тилнитратом — продуктом взаимодействия азотной кислоты с уксусным ангидридом:
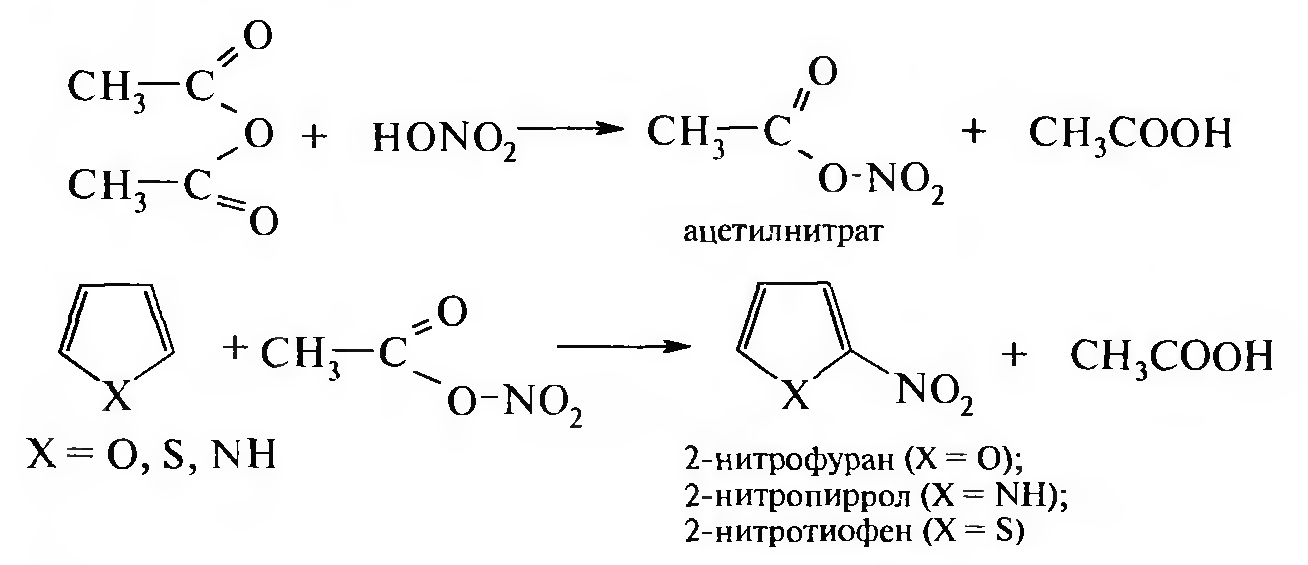
Нитрование тиофена можно проводить концентрированной азотной кислотой, однако предпочтение отдают ацетилнитрату.
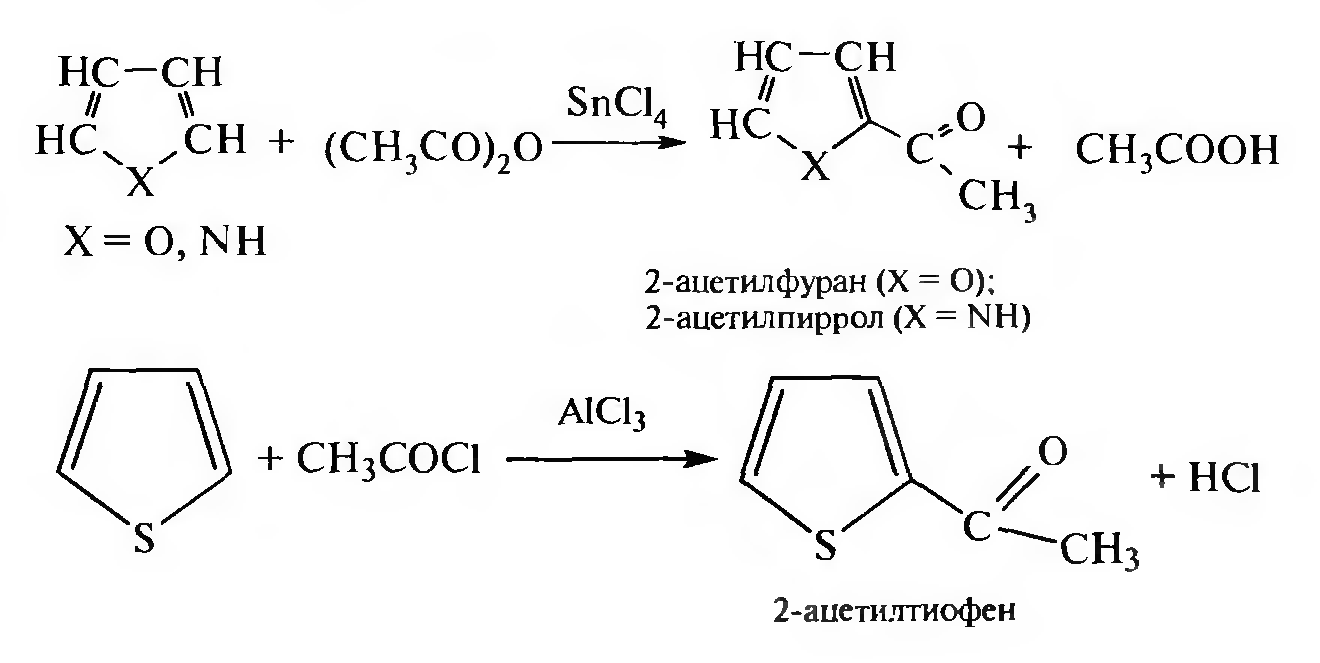
Ацилирование. При ацилировании ацидофобных гетероциклов в качестве ацилирующих реагентов используют ангидриды карбоновых кислот в присутствии катализаторов — кислот Льюиса (тетрахлорид олова, хлорид цинка и др.). Тиофен ацилируют хлорангидридами карбоновых кислот в присутствии катализатора хлорида алюминия А1С13:
Галогенирование. Прямое галогенирование фурана и пиррола протекает очень бурно, реакция поддается контролю с трудом и может привести к разрушению гетероциклических ядер. Галогенирование осуществляют с помощью сульфурилхлорида S02C12. Происходит постепенное замещение атомов водорода на галогены.
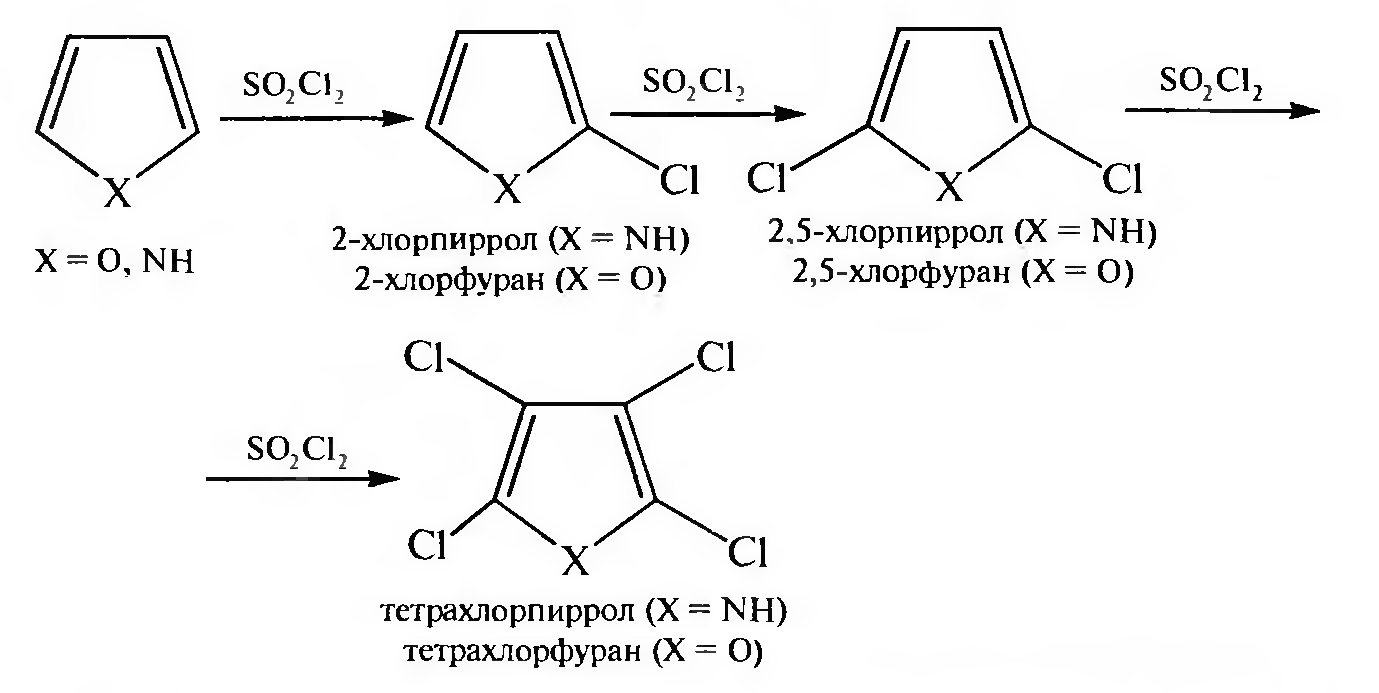 Тиофен
галогенируется на холоду непосредственным
действием галогена (хлора или брома).
Образуются моно-, ди-, три- и тетразамещенные
производные тиофена:
Тиофен
галогенируется на холоду непосредственным
действием галогена (хлора или брома).
Образуются моно-, ди-, три- и тетразамещенные
производные тиофена:

Реакция с йодом протекает медленно в присутствии катализатора HgO.
Реакции присоединения. Для пятичленных гетероциклов реакции присоединения менее характерны, чем реакции электрофильного замещения. Рассмотрим реакции восстановления, окисления и диеновый синтез.
Реакции восстановления. Восстановление фурана происходит при высокой температуре (140 °С) при давлении 100—150 атм в присутствии катализатора (никель Ренея, палладий).
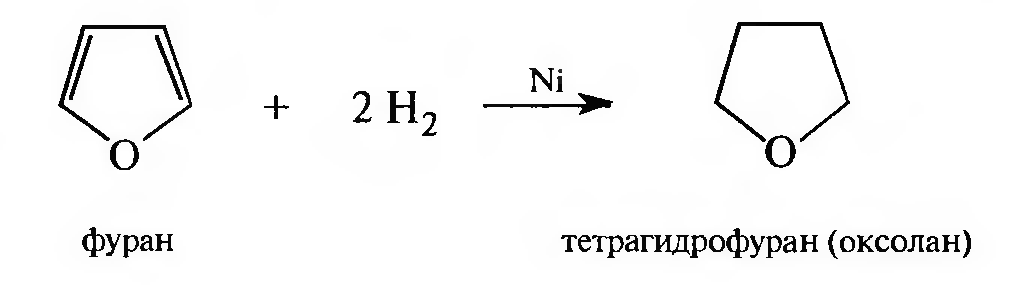
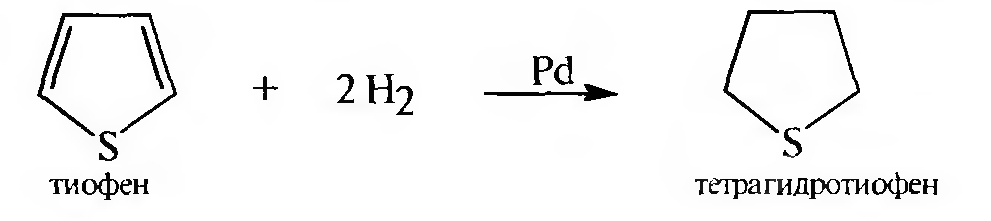
Восстановление тиофена происходит легко при комнатной температуре и давлении в присутствии катализатора — палладия.
Частичное восстановление пиррола с образованием 2,5-дигидропиррола (пирролина) происходит при действии цинка в уксусной кислоте (водородом в момент выделения). Полное восстановление пиррольного цикла до тетрагидропиррола (пирролидина) осуществляют в условиях каталитического гидрирования над платиновым или палладиевым катализатором.
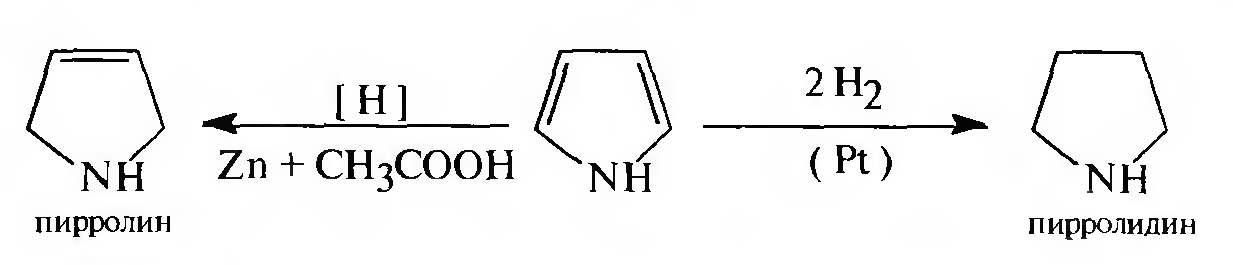
Реакции окисления. Фуран и пиррол чрезвычайно чувствительны к действию окислителей. Легко окисляются даже кислородом воздуха. Окисление проходит с разрывом гетероциклического ядра и образованием пиррольных и фурановых полимерных смол. Пропускание смеси фурана с воздухом над катализатором V205 и температуре 320 °С приводит к образованию малеинового ангидрида:

При окислении пиррола хромовой кислотой образуется имид ма- леиновой кислоты.

Тиофен окисляется с большим трудом.
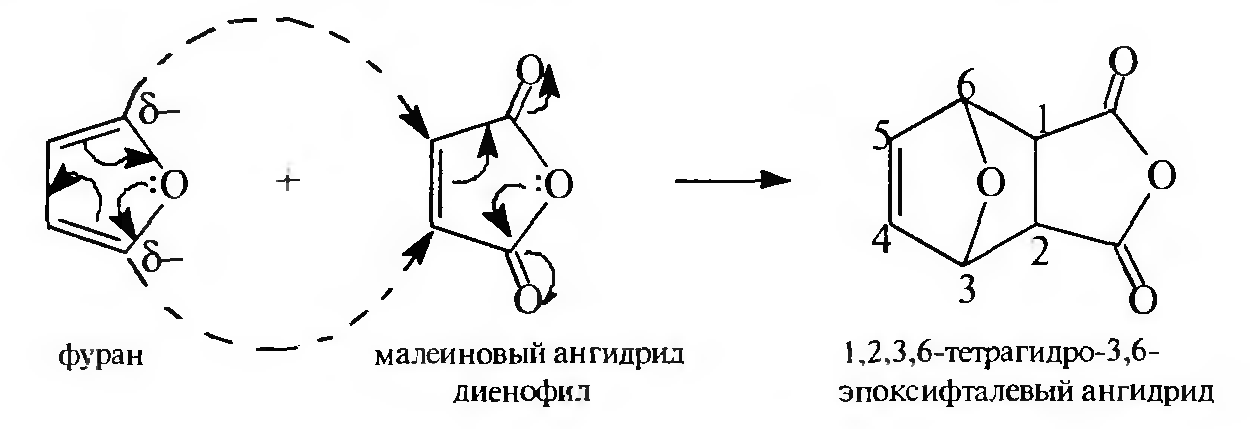
Диеновый синтез. Занимая промежуточное положение между ароматическими соединениями и 1,3-диенами, фуран вступает в характерную для сопряженных диенов реакцию Дильса — Альдера:
Реакции, идущие с расширением цикла, а) При нагревании фури- лалкилкетонов с аммиаком получают замешенные 3-гидроксипиридины:
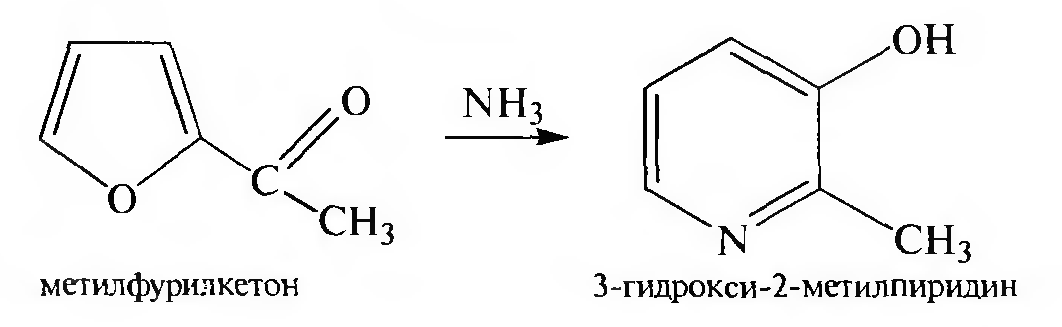
б) При взаимодействии пиррол-калия с хлороформом в присутствии этилата натрия пиррольное ядро превращается в пиридиновое. Реакция происходит через стадию образования дихлоркарбена:
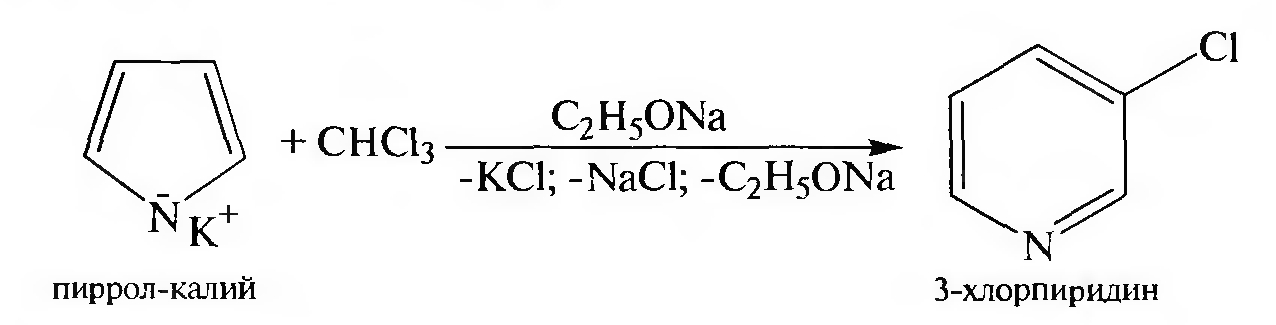
Взаимные превращения пятичленных гетероциклов с одним гетероатомом. Советский химик-органик Ю.К. Юрьев в 1936 г., учитывая высокую реакционную способность гетероциклов, показал возможность взаимных превращений фурана, пиррола и тиофена.
Методы идентификации пятичленных гетероциклов с одним гетероатомом
Для обнаружения фурана и пиррола применяют очень простой и доступный метод — окрашивание сосновой лучины: сосновая лучинка, смоченная хлороводородной кислотой и фураном, окрашивается в интенсивно-зеленый цвет; в парах пиррола она приобретает ярко-красную окраску.
Тиофен открывают индофениновой пробой: смесь изатина с концентрированной серной кислотой в присутствии даже следов тиофена окрашивается в синий цвет.
Б. Специфические химические свойства пиррола
Пиррол относится к природным соединениям. Это бесцветная жидкость с температурой кипения 130 °С, малорастворимая в воде.
Отметим свойства, характерные для пиррола и не отмеченные в общей характеристике реакционной способности пятичленных гетероциклов.
Кислотно-основные свойства пиррола и продуктов его восстановления, которые не свойственны фурану и тиофену.
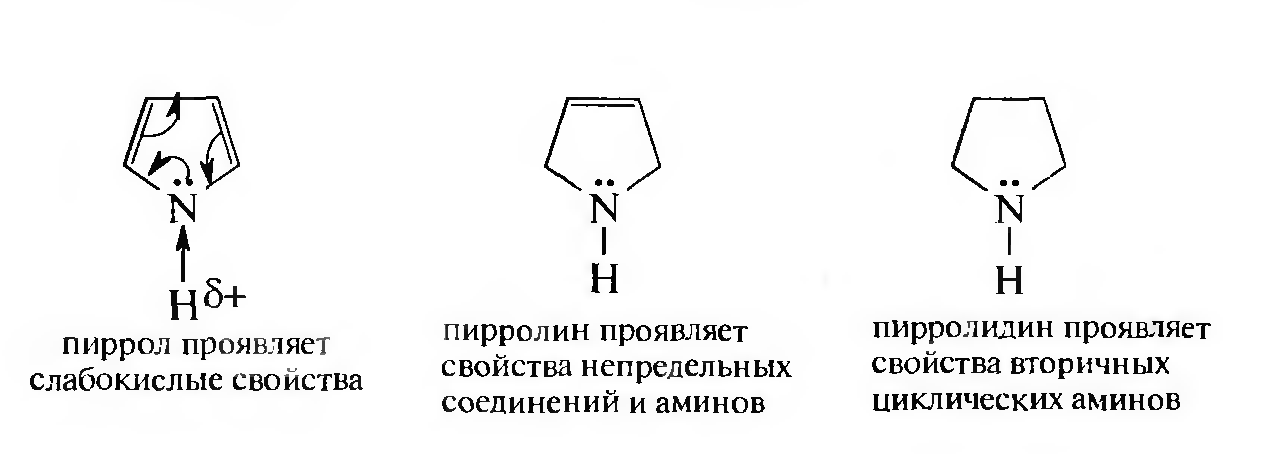
Пиррол — слабая NH -кислота (рКа= 17,5), пара электронов атома азота вступает в сопряжение с π-электронами, что приводит к поляризации NH-связи и увеличению подвижности атома водорода.
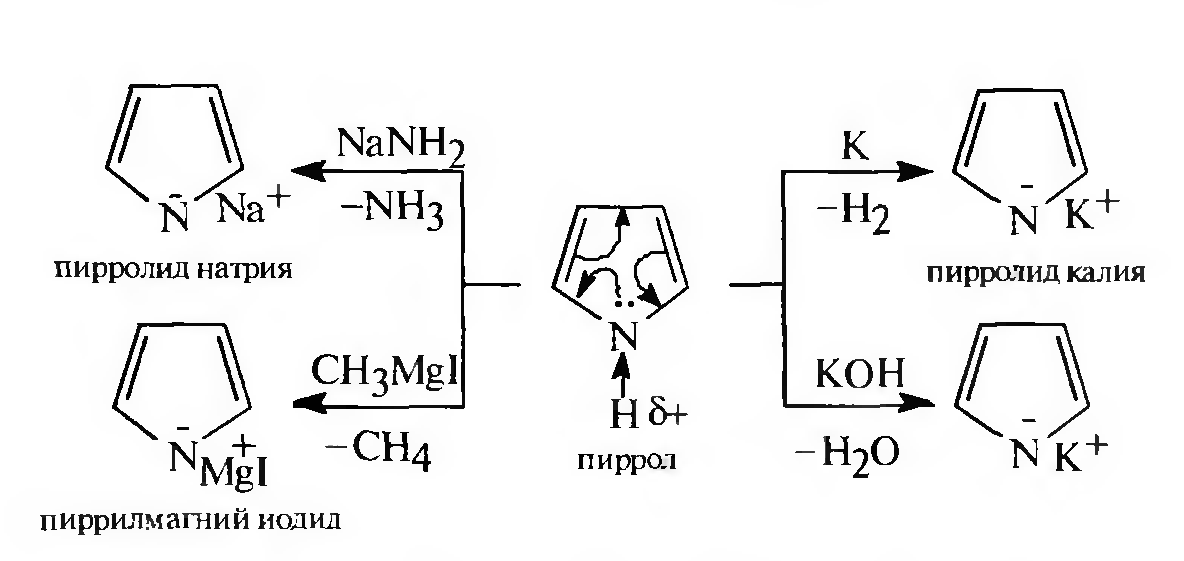
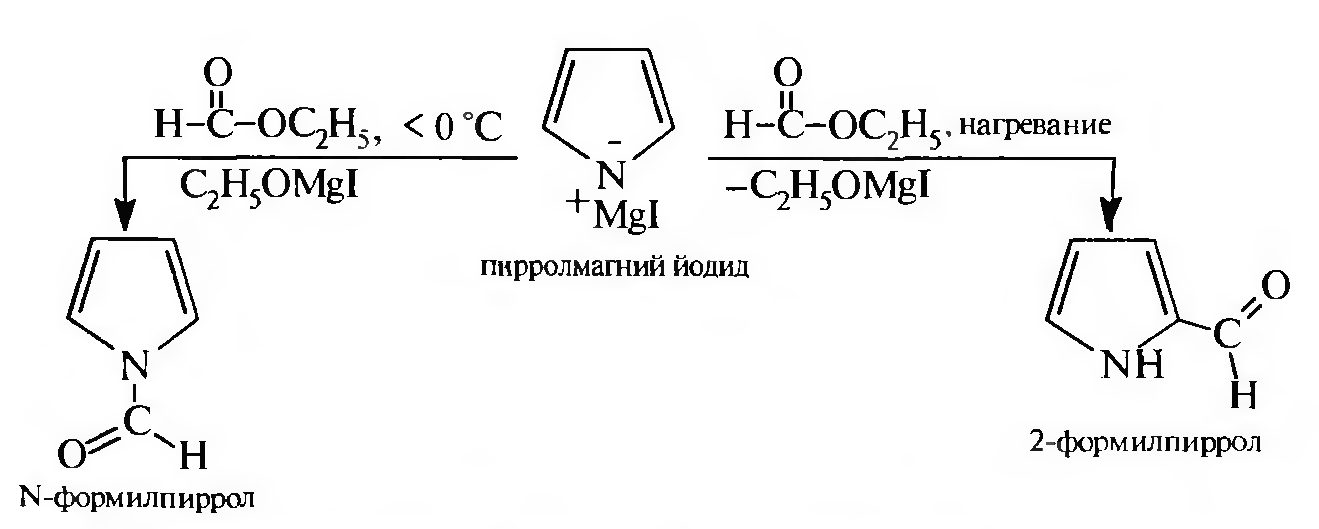
Соли пиррола являются peaкционноспособными веществами и широко применяются в органическом синтезе для введения в молекулу пиррола алкильных и арильных заместителей. Направление реакции зависит от температурного режима:
 Наряду
с хлорангидридами карбоновых кислот в
реакциях ацили- рования используют
сложные эфиры.
Наряду
с хлорангидридами карбоновых кислот в
реакциях ацили- рования используют
сложные эфиры.