
Яблочная кислота
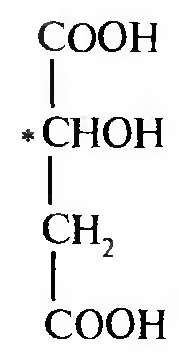
Яблочная кислота — это двухосновная трехатомная кислота. Молекула яблочной кислоты содержит один асимметрический атом углерода, поэтому существует в виде двух оптических изомеров и оптически неактивной рацемической форме:
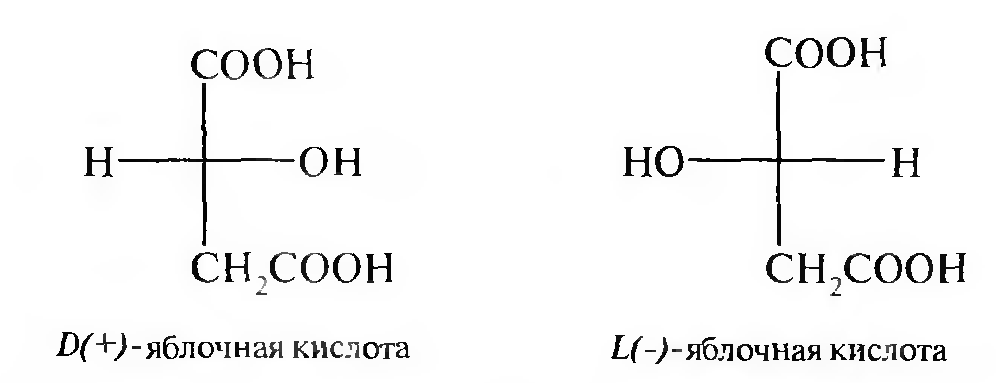
Винная кислота
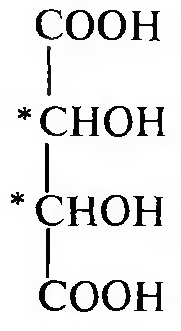
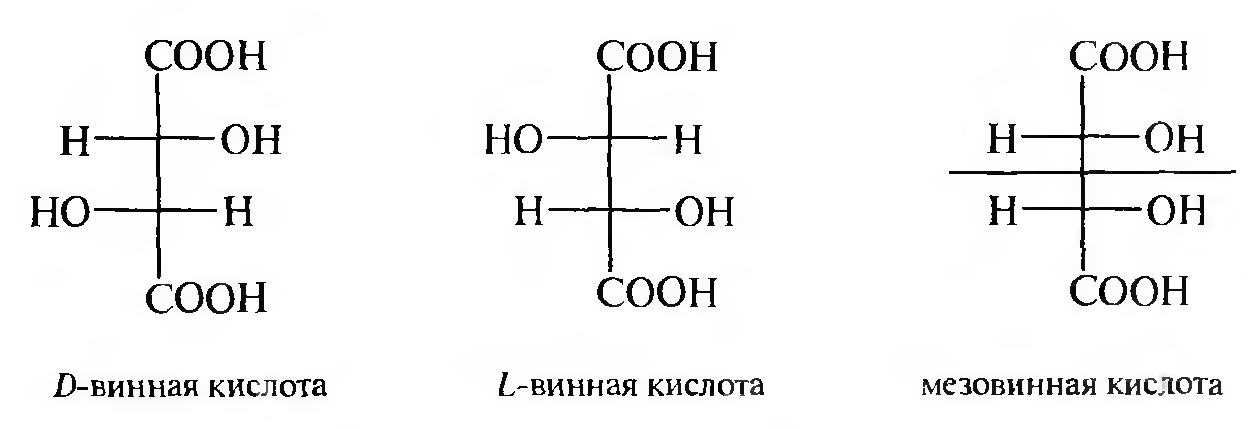
Винная кислота — двухосновная, четырехатомная. Молекула винной кислоты содержит два асиметрических атома углерода и существует в виде трех стереоизоизомеров. D-винная кислота, L-винная кислота и мезовинная кислота.
При хранении вина она выделяется в виде нерастворимой кистой калиевой соли (калий виннокислый).
Лимонная кислота
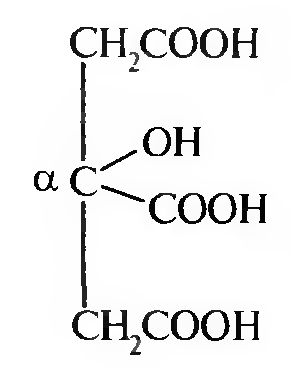
Это четырехатомная, трехосновная кислота. Относится к α-гидроксикислотам.
Как и все α-оксикислоты. лимонная кислота при нагревании с концентрированной H2S04 разлагается с выделением муравьиной кислоты и ацетондикарбоновой кислоты:
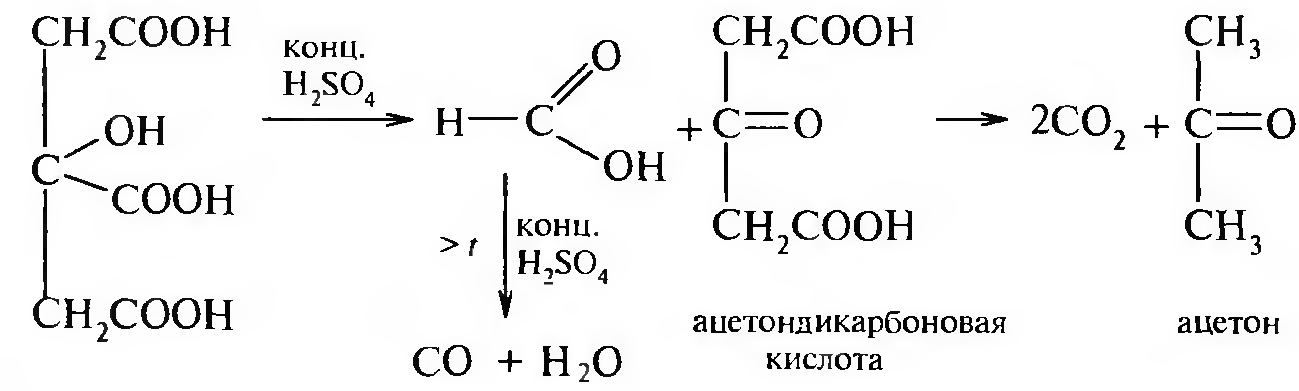
Ацетондикарбоновая кислота при нагревании декарбоксилируется с образованием ацетона. Соли лимонной кислоты называют цитратами. Лимонная кислота, также как и винная, относится к пищевым кислотам. Цитрат натрия используется при консервировании крови.
Фенолокислоты
Фенолокислотами называют производные аренкарбоновых кислот, у которых один или несколько атомов водорода в ароматическом ядре замещены на гидроксильную группу, то есть это соединения, которые содержат фенольную и карбоксильную группы.
Например:
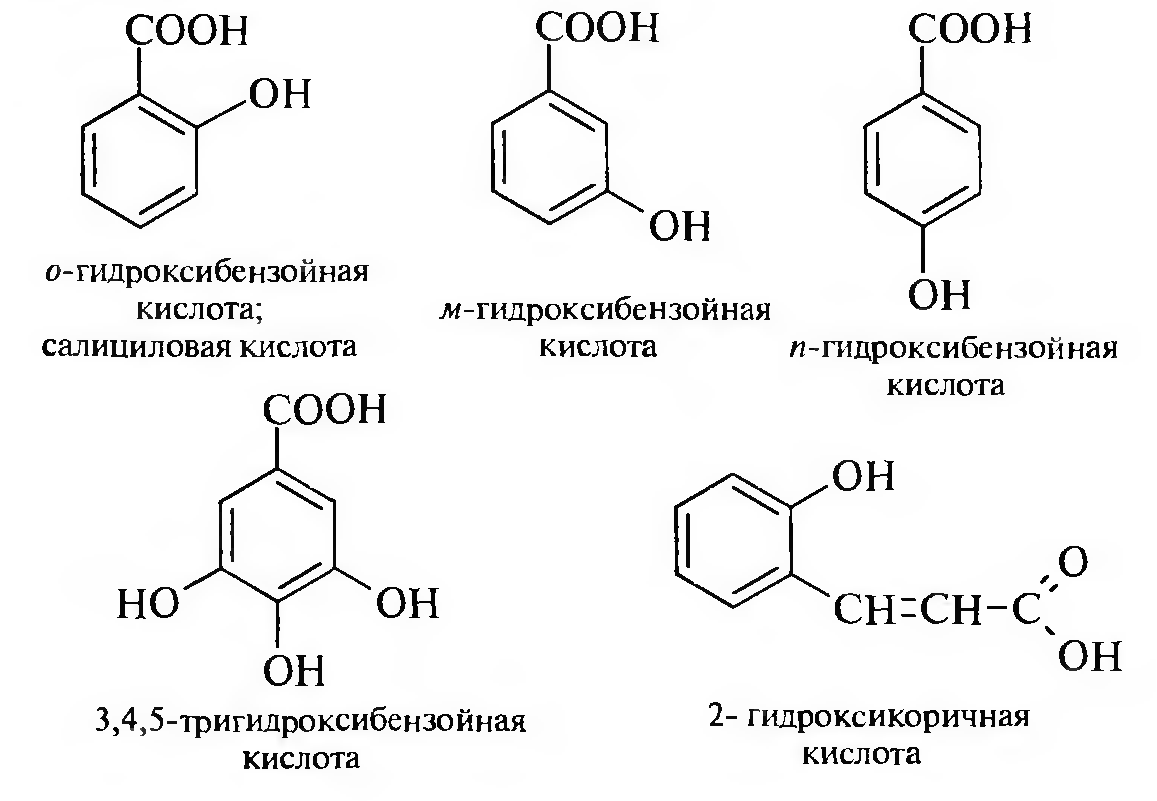
Даже если карбоксильная группа находится в боковой цепи, но в молекуле содержится фенольный гидроксил, — это тоже фенолокислоты.
Способы получения
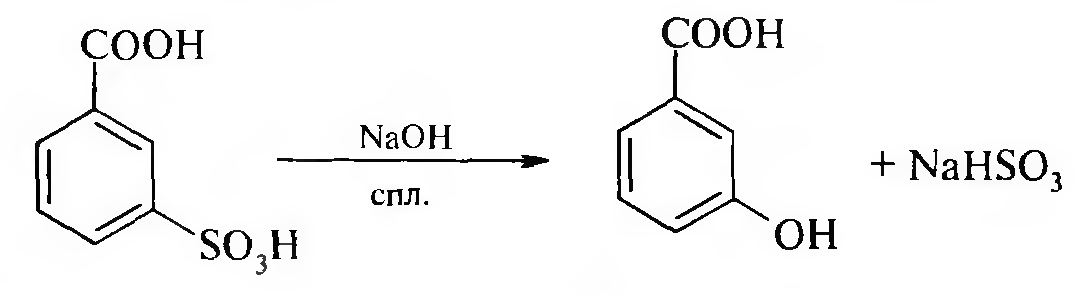
Сплавлением сульфобензойных кислот со щелочами:
Карбоксилирование фенолов оксидом углерода (IV) (Реакция Кольбе — Шмитта). Нагревание фенолов в щелочной среде с оксидом углерода (IV) приводит к образованию салициловой кислоты:
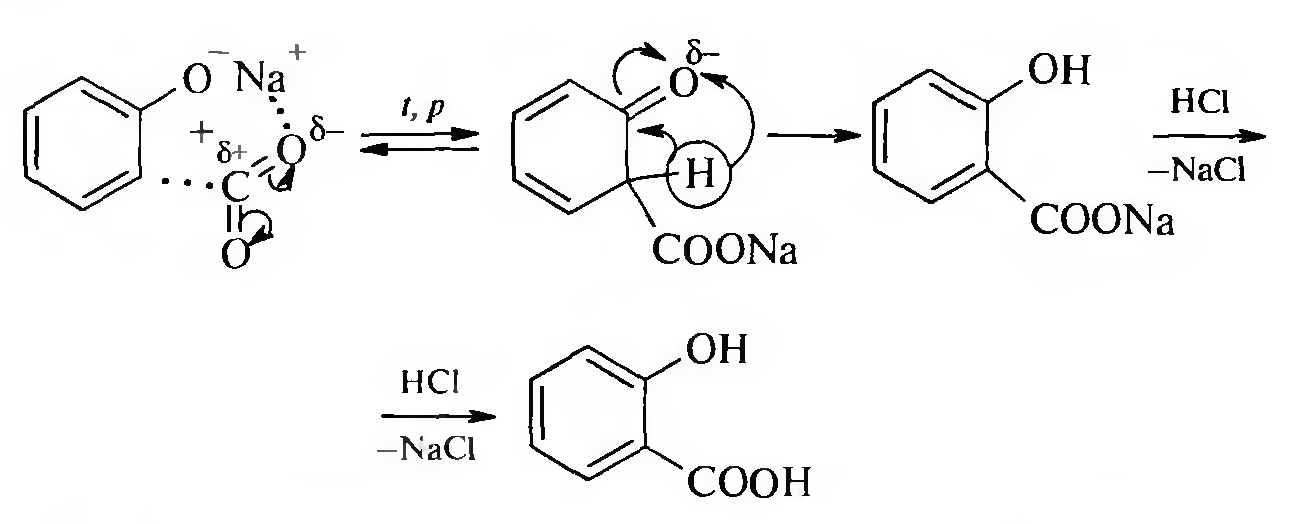
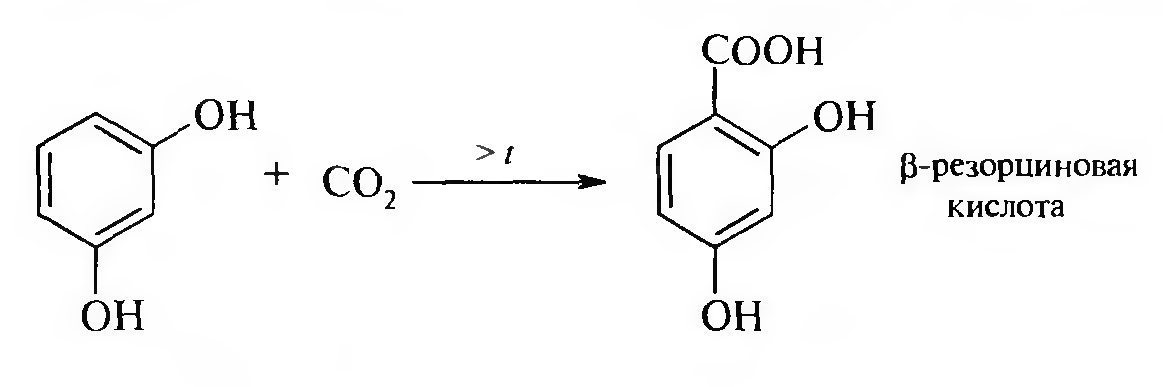
Для двухатомных фенолов присоединение С02 идет более легко:
Физические свойства
Фенолоксикислоты — кристаллические вещества, труднорастворимые в воде, перегоняются с водяным паром. Они более сильные кислоты, чем бензойные, с FeCl3 дают фиолетовое окрашивание.
Химические свойства
В химическом отношении это бифункциональные соединения. Они дают все производные по функциональным группам:
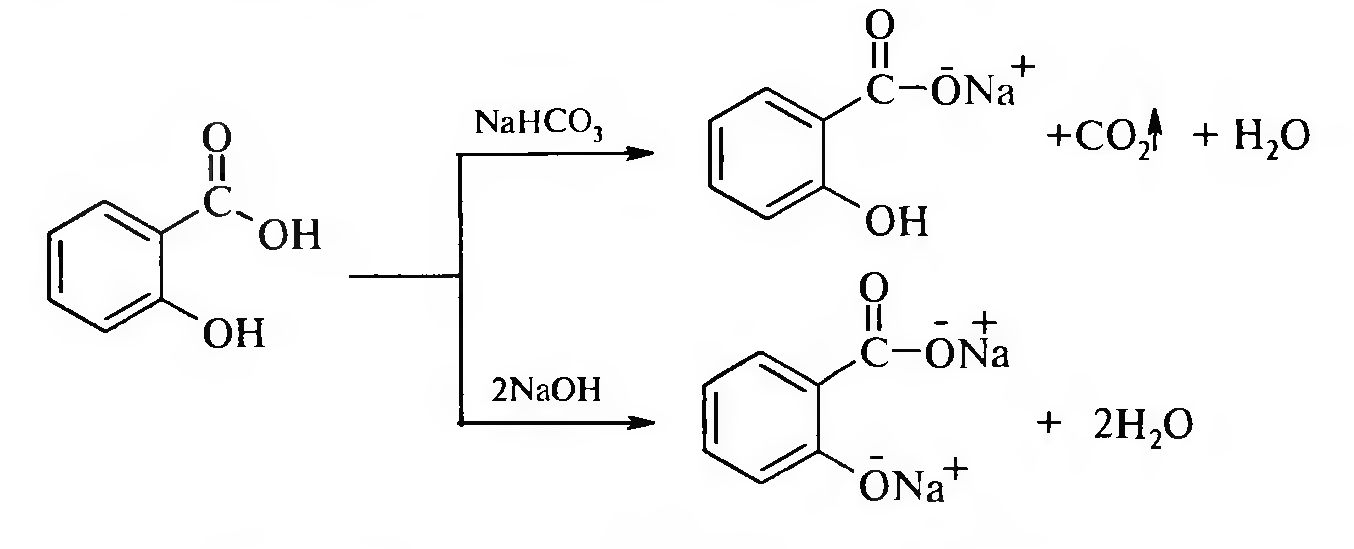
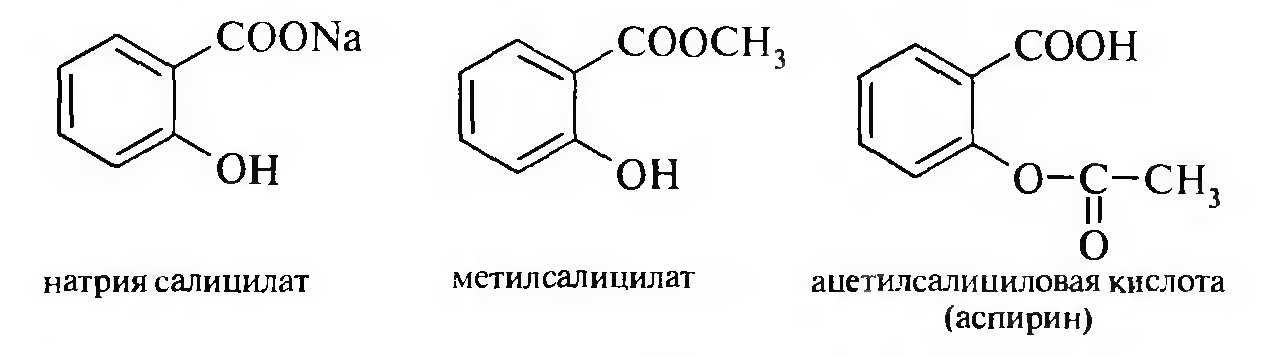
В реакцию с гидрокарбонатом натрия вступает только карбоксильная группа. При этом образуется мононатриевая соль салициловой кислоты, а при действии щелочей образуется динатриевая соль салициловой кислоты.
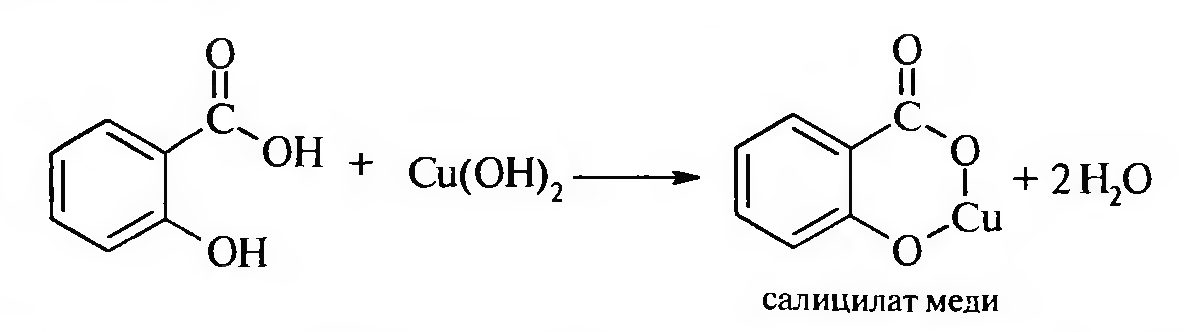
Благодаря близости двух функциональных групп в молекуле салициловая кислота, в отличие от своих изомеров, взаимодействует с гидроксидом меди (II):
С участием карбоксильной группы протекают реакции со спиртами, галогенирующими реагентами:
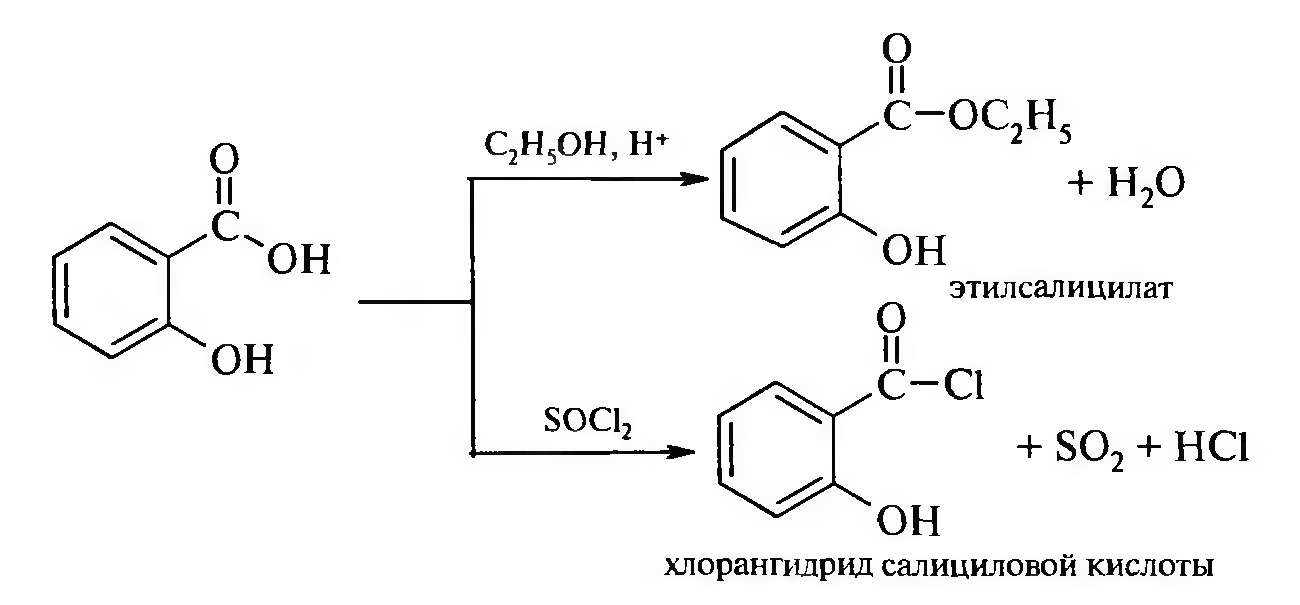
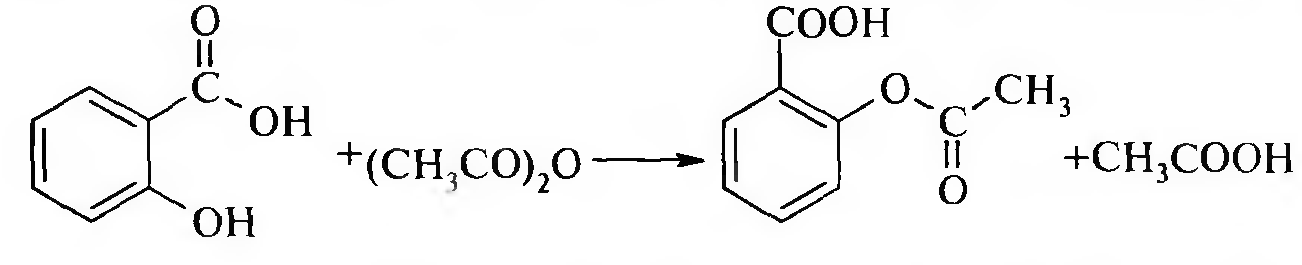
При взаимодействии салициловой кислоты с уксусным ангидридом образуется ацетилсалициловая кислота:
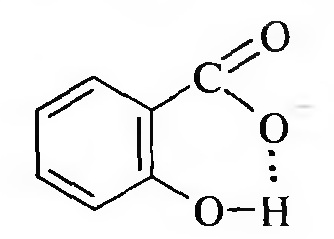
Салициловая кислота по кислотным свойствам превосходит бензойную кислоту, а также о- и п-гидроксибензойные кислоты. Это можно объяснить тем, что происходит дополнительная стабилизация салицилат-иона за счет образования внутримолекулярной водородной связи
При нагревании салициловая кислота легко декарбоксилируется:
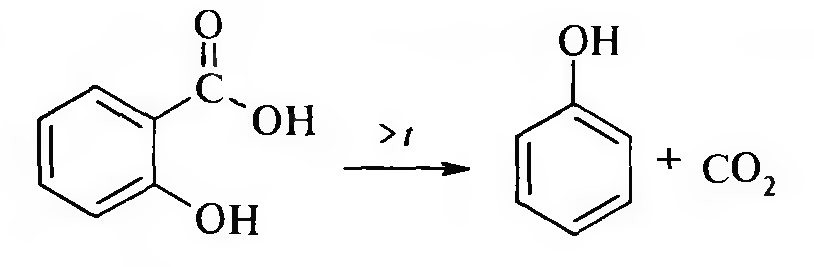
Применение
Производные салициловой кислоты используются в качестве анальгетических, жаропонижающих и противовоспалительных средств, например:
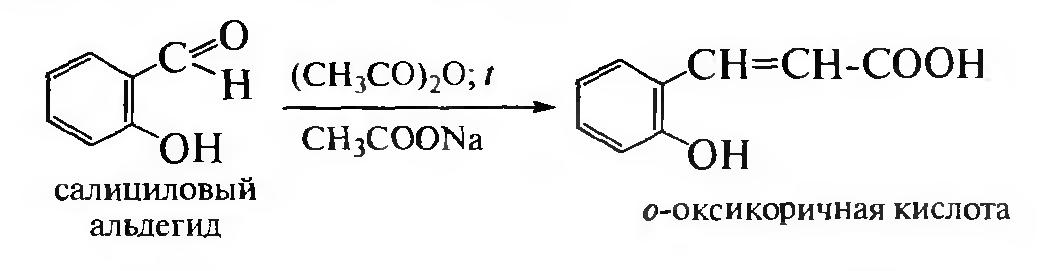
о-ОКСИКОРИЧНАЯ КИСЛОТА
Содержит в своей структуре непредельную связь, карбоксильную группу в боковой цепи и фенольный гидроксил.
Получают по реакции Перкина:
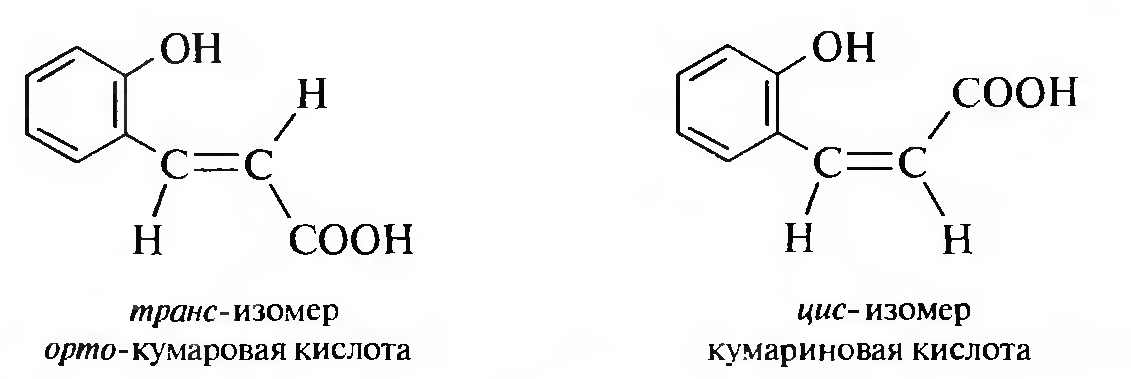
Для о-гидроксикоричной кислоты известны два изомера цис- и транс-:
Из полигидроксикарбоновых кислот отметим протокатеховую и галловую кислоты.
